
Именно строение кристаллов дало учёным возможность впервые заглянуть в мир атомов в 1910-х годах. Тогда Уильям и Лоуренс Брэгг, отец и сын, разработали рентгеновскую кристаллографию. Пропуская рентгеновский луч через кристалл (пользуясь тем, что длина волны рентгеновского излучения мала – сравнима с расстоянием между слоями атомов) Брэгги смогли увидеть внутреннюю структуру алмаза.
На фото: кристалл сульфата меди, снятый на макрообъектив.
Чтобы получить изображения для своей коллекции из 300 фотографий, изданных в виде книги The Beauty of Chemistry [«Красота химии»], Вэньтин Чжу и Янь Лян использовали инфракрасную фотографию, высокоскоростные фотоаппараты и технику микрофотографии. И всё это – с целью погрузить читателей в микроскопический мир молекул и потрясающих реакций, происходящих между ними. Автор научно-популярных текстов Филипп Болл комментирует происходящее на фотографиях, проводя тур по окружающей нас недооценённой красоте. Он описывает как принципы, создающие уникальную симметрию снежинок, так и механизмы, объединяющие очень похожие на живые усики силикатных солей с происхождением самой жизни.
 Вероятно, самой простой и удивительной из этих концепций служит водородная связь, скрепляющая элементы такой жизненно важной субстанции, как вода. Каждая молекула воды состоит из двух атомов водорода, соединённых с атомом кислорода, но у кислорода на внешней оболочке расположено шесть электронов. Для формирования химической связи с водородом требуется всего два электрона, поэтому четыре электрона с отрицательным зарядом, группирующиеся по два, висят там в своём микропространстве, надеясь как-то сбалансировать свой заряд. Эти пары оказывают слабое воздействие на атомы водорода, присутствующие в соседних молекулах воды, формируя длящиеся всего одну триллионную долю секунды кратковременные связи, а потом снова отрываются от них и связываются с другим атомом водорода. Этот непрекращающийся танец порождает химическое движения, делающее возможным жизнь, Болл называет «молекулярным диалогом» между порядком и хаосом.
Вероятно, самой простой и удивительной из этих концепций служит водородная связь, скрепляющая элементы такой жизненно важной субстанции, как вода. Каждая молекула воды состоит из двух атомов водорода, соединённых с атомом кислорода, но у кислорода на внешней оболочке расположено шесть электронов. Для формирования химической связи с водородом требуется всего два электрона, поэтому четыре электрона с отрицательным зарядом, группирующиеся по два, висят там в своём микропространстве, надеясь как-то сбалансировать свой заряд. Эти пары оказывают слабое воздействие на атомы водорода, присутствующие в соседних молекулах воды, формируя длящиеся всего одну триллионную долю секунды кратковременные связи, а потом снова отрываются от них и связываются с другим атомом водорода. Этот непрекращающийся танец порождает химическое движения, делающее возможным жизнь, Болл называет «молекулярным диалогом» между порядком и хаосом.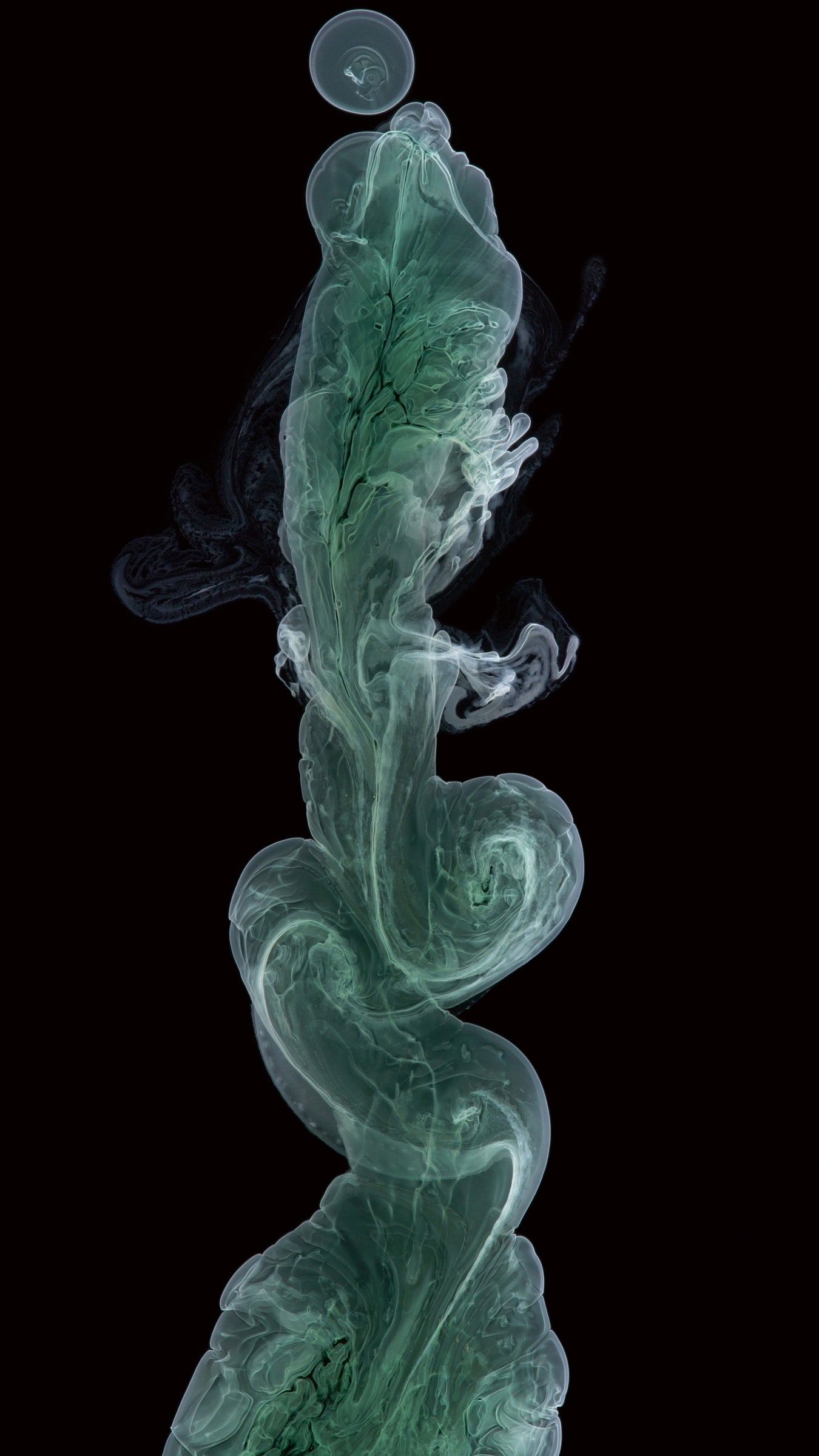
Гидроксид хрома (III)
Этот гидроксид хрома осаждается в процессе отверждения, одновременно завихряясь и растворяясь в своём контейнере. Такая реакция происходит при соединении двух жидких веществ, содержащих одновременно положительно и отрицательно заряженные ионы. Они начинают молекулярные завихрения, обмениваясь партнёрами. В данном случае ионами обмениваются хлорид хрома и гидроксид натрия. Положительно заряженные молекулы хрома и отрицательно заряженные молекулы гидроксида притягиваются друг к другу, поскольку так появляется энергетический баланс. Они формируют прочные связи, удерживающие молекулы на месте, и создающие твёрдый побочный продукт, в который все эти молекулы воды просто не умещаются. Также во время реакции появляется хлорид натрия, то есть столовая соль, прекрасно растворяющаяся в воде.

Кристалл сульфата меди
Кристаллы – величайшее достижение атомной эффективности. Их структура растёт из крохотной группки очень организованно расположенных атомов, когда окружающие их молекулы начинают регулярно повторять один и тот же узор, выстраиваясь друг за другом. Кристаллы сульфата меди, как на фото выше, легко получить даже дома – достаточно небольшого набора ингредиентов и немного терпения.

Фрактальные кристаллы никотиновой кислоты
Древовидно растущие кристаллы формируют ветвящиеся структуры вместо единого кристаллического блока. На фото выше — кристаллы никотиновой кислоты (они же – ниацин, витамин B3), формирующие похожие на одуванчики структуры, если перенасыщенный раствор этой кислоты быстро охладить. Физический процесс формирования этих древовидных структур по сути такой же, как и кристаллизация – просто он ускоряется резким изменением температуры или химического состава.
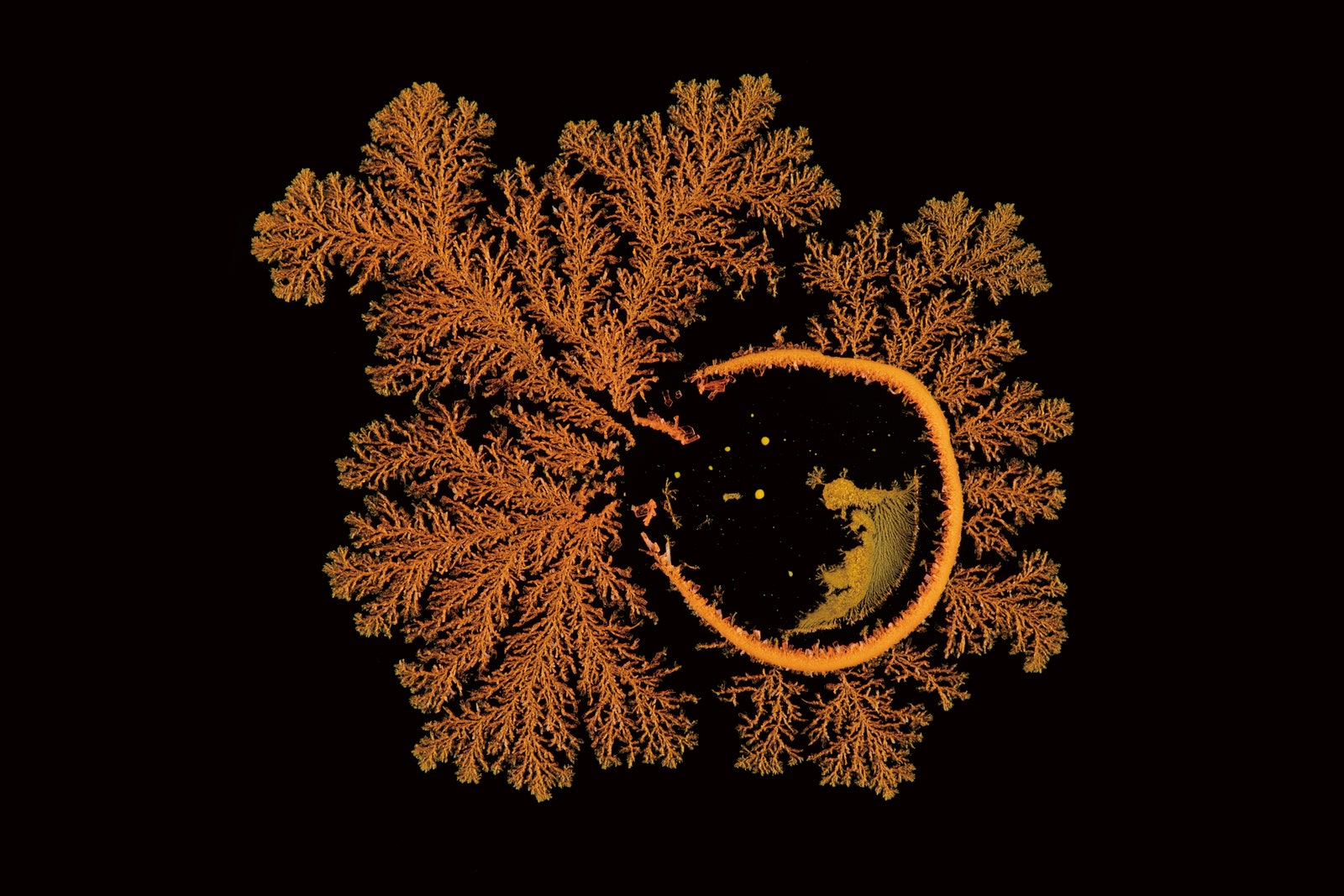
Дихромат калия
На фото – раствор дихромата калия, кристаллизирующийся во время быстрого испарения воды. Узоры получаются из-за неоднородности раствора. Это пример нестабильности роста – в некоторых местах частиц собирается больше, из-за чего они быстрее кристаллизуются, образуя сложные фрактальные узоры.

Кольца Лизеганга
Названные в честь первооткрывателя явления — немецкого химика и предпринимателя Рафаэля Лизеганга, нашедшего их в 1986 году, эти странные кольца – результат выпадения осадка в геле. В чашку Петри, содержащую дихромат калия, добавляется нитрат серебра. В тех местах, где эти вещества встречаются, они обмениваются ионами и образуют хромат серебра. Пока существует несколько конкурирующих теорий, объясняющих появление этих колец. Многие учёные считают, что изначальное отложение хромата серебра становится перенасыщенным и благодаря диффузии проникает через гель, создавая новую химическую зону накопления, в которой опять достигает насыщения, и формирует таким образом концентрические окружности.

Восстановление перманганата калия сахарозой
Перманганат калия, он же «минеральный хамелеон» — положительно заряженное вещество, окислитель. Сам кислород любит забирать электроны у окружающих атомов. В растворе сахара кислород в перманганате калия забирает электроны у молекул сахаров, что приводит к «восстановительной» реакции. Получая электроны и приближаясь к химическому равновесию, перманганат меняет цвет с фиолетового через зелёный, голубой и красновато-коричневый.
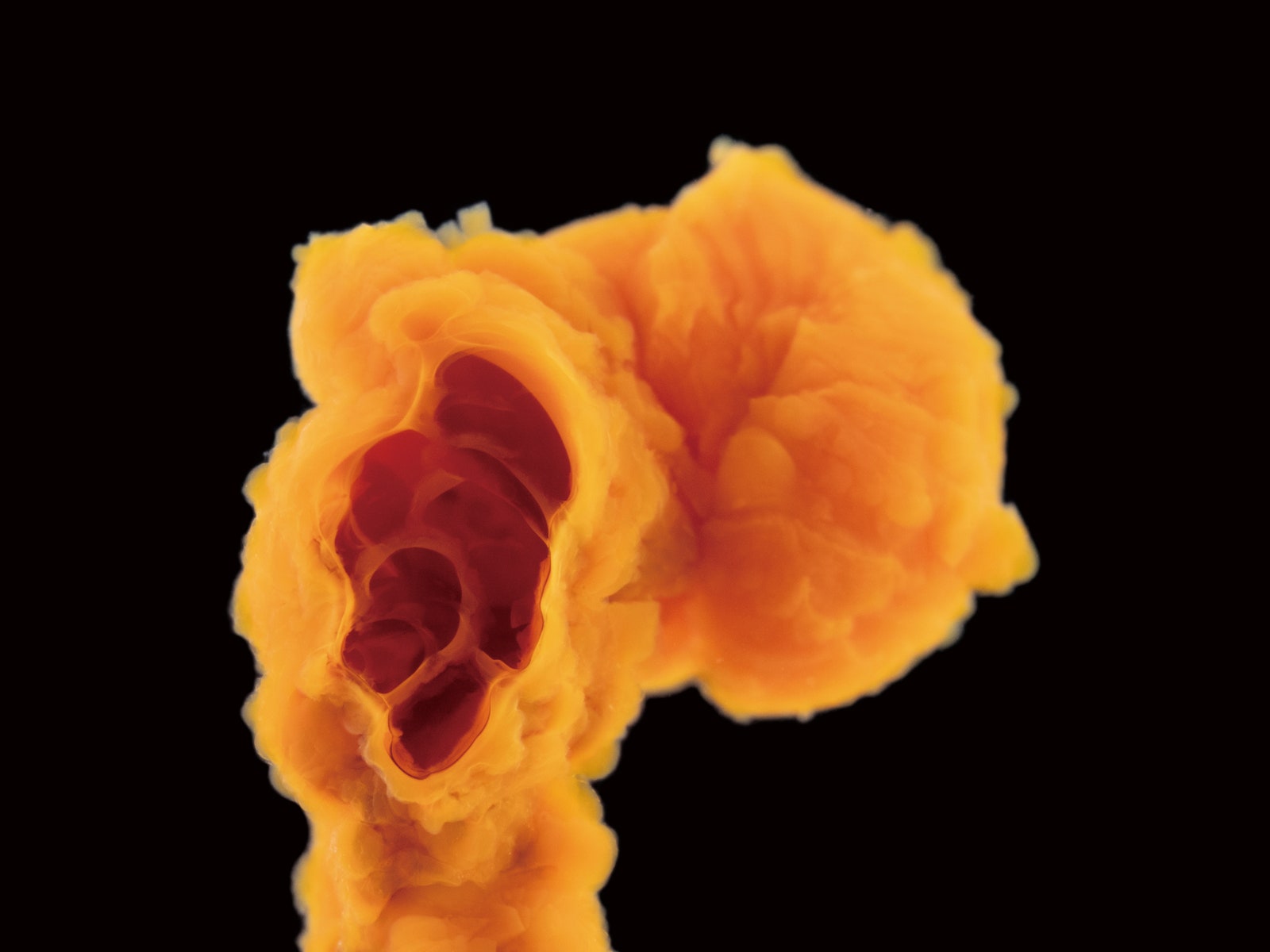
Сульфат аммония-железа (соль Мора)
Эта полая веточка сульфата аммония-железа подвешена в химическом саду – силикатном растворе, содержащем соли железа, выпадающие в осадок. Поскольку ионы силикатов склонны к формированию длинных цепочек и листов, они превращают обычное выпадение в осадок в процесс, порождающий неорганический сад со множеством угловатых «ветвей» и выразительных «цветков». Обмениваясь с окружающим раствором ионами, соли железа отверждаются и формируют тонкие полые мембраны, заполненные водой, плотность которых меньше окружающей их жидкости. С повышением внутри этих трубок давления они ветвятся и растут непредсказуемым образом.
Комментарии (7)

Port5
26.10.2021 16:55+4Спасибо за статью. Снимки кристаллов очень красивы. Это одна из вещей, которыми можно любоваться бесконечно (как и блеском бриллиантов, которые суть тоже кристаллы). Однако что касается научпопа, изложение довольно странное. Зараннее прошу прощения за критику, но если статью будет читать школьник или студент, то это может создать явно некорректное представление о сути некоторых вещей.
Для формирования химической связи с водородом требуется всего два электрона, поэтому четыре электрона с отрицательным зарядом, группирующиеся по два, висят там в своём микропространстве, надеясь как-то сбалансировать свой заряд.
Смысл выделенной фразы непонятен. Да, в любой молекуле есть "мгновенные диполи", могут существовать локальные заряды. Но что именно "надеются сбалансировать" две электронные пары кислорода в электрически нейтральной молекуле воды?
Эти пары оказывают слабое воздействие на атомы водорода, присутствующие в соседних молекулах воды, формируя длящиеся всего одну триллионную долю секунды кратковременные связи, а потом снова отрываются от них и связываются с другим атомом водорода.
Это справедливо для жидкости, например для жидкой воды. Но статья же про кристаллы. В кристалле (твёрдом состоянии) водородные связи могуть быть вполне однозначными и никуда не "отрываться" и не "связываться с другим атомом". Внутримолекулярные и супрамолекулярные водородые связи также могут иметь вполне постоянную и однозначную направленность и для молекул вещества в жидком состоянии (например, водородные связи между комплементарными парами в двойной нити ДНК).
Этот непрекращающийся танец порождает химическое движения, делающее возможным жизнь
Химические "движения" это броуновское движения (энергия, температура). Слабые взаимодействия, такие как водородные связи, могут влиять на направление и результат этого движения, но никак не являются им самим. Кроме того, в случае воды как основы жизни ключевым является не сколько движение, сколько специфическая структура обычного льда, дающая ему плотность меньше единицы, что предотвращает промерзание водоёмов до самого дна. Впрочем, такой структурой лёд действительно обязан водородным связям.
Их структура растёт из крохотной группки очень организованно расположенных атомов, когда окружающие их молекулы начинают регулярно повторять один и тот же узор, выстраиваясь друг за другом.
Рост молекулярного кристалла (например, льда) начинается с организованно расположенных молекул (воды, в случае льда), а не неких атомов.
Перманганат калия, он же «минеральный хамелеон» — положительно заряженное вещество, окислитель.
Перманганат калия, KMnO4, это электрически нейтральная штука, а не "положительно заряженное вещество".
Сам кислород любит забирать электроны у окружающих атомов. В растворе сахара кислород в перманганате калия забирает электроны у молекул сахаров, что приводит к «восстановительной» реакции.
В анионе MnO4(-) окислителем является ион марганца в высшей степени окисления +7, Mn(VII), а вовсе не килород, который там сыт по горло электронами и добирать ему попросту некуда. Поэтому это вещество и называют хамелеоном - восстанавливаясь с +7 до более низких степеней окисления марганец может давать самые разные поглощения в видимой области спектра (разные окраски), в зависимости от достигнутой степени окисления (т.е. электронной конфигурации).
Ну и просто о "наболевшем" - вот те самые фрактальные кристаллы это головная боль для упомянутой рентгеновской кристаллографии) Многие вещества имеют тенденцию кристаллизоваться в такой форме в силу внутреннего строения. Бывает растут безумно красивыми снежинками с очень тонкими кристаллами-иголками. В микроскоп красиво, но в рентгеновский дифрактометр взять нечего, сплошные сростки и двойники, пока найдёшь подходящий кристалл проклянёшь всё на свете)

maxpivovar
27.10.2021 02:20+2В школьные годы вырастил кристалл медного купороса. еле влезал в спичечный коробок.
drWhy
27.10.2021 09:57+1На школьной практике колол лезвием с угла тонкие пластинки от бруска NaCl размером с небольшой кирпич, правда готового. Ну и классика — нитрид трииода на промокашках.

AndreyDmitriev
Химия - вообще удивительная штука. Я какое-то время назад увидел видео о том, что ртуть делает с алюминием - завораживает конкретно:
VT100
Алюминий растворяется в ртути. Отдельные атомы (группы атомов) алюминия на поверхности амальгамы гораздо легче окисляются кислородом. А поскольку их довольно много — возникают нити и сетки окиси алюминия.
Или нет?
Port5
Примерно так (детальный процесс там довольно сложен, на самом деле), за исключением того, что идёт образование амальгамы (сплава) конкретного состава; растворимость (именно растворимость) алюминия в ртути невелика. Алюминий это чрезвычайно активный металл, но обычно он пассивирован очень плотной плёнкой оксида на своей поверхности. В месте царапин и тд ртуть входит в контакт с металлическим алюминием и образует амальгаму. Оксидная плёнка на ней неустойчива и не образует плотного слоя, необходимого для защиты от дальнейшего окисления. В результате алюминий начинает реагировать как с кислородом воздуха, так и с водой (влагой), с образованием рыхлого оксида.