Корреляция еще не означает причинность. Эти фраза вдалбливается в голову всем изучающим статистику с первых занятий. При этом корреляция, конечно же, на эту самую причинность намекает — часто у двух коррелирующих параметров если и не прямая причинно-следственная связь, то хотя бы общая внешняя причина. Один из моих любимых примеров: продажи мороженого хорошо коррелируют с количеством утопленников, но при этом обе переменные друг от друга не зависят, а обусловлены третьим фактором — погодой.
В борьбе со старением постоянно возникают и быстро входят в моду новые и новые гипотезы какой-то Великой Терапии, которая поможет одержать в этой борьбе решительную победу. Не так давно это была Её Величество Теломераза, но пару лет назад её сместили с трона сенолитики?—?средства борьбы с сенесцентными клетками. Это такие клетки-зомби, которые мало того, что уже не выполняют свои функции и при этом отказываются умирать, но ещё и отравляют всё вокруг себя, выделяя коктейль провоспалительных веществ, называемый “senescence-associated secretory phenotype” или SASP.

Правда, как это уже часто бывало, корреляция может опять пытаться проявить своё коварство и направить нас по ложному следу: то, что в организме по мере старения становится больше сенесцентных клеток, ещё не означает, что они являются его драйвером. И очень похоже, что они таким ложным следом могут оказаться. Последние исследования Андрея Гудкова?—?профессора, доктора биологических наук, основателя и научного директора биотехнологической компании Cleveland BioLabs, и вообще одного из самых успешных русских биологов за рубежом?—?результаты по которым он представил в январе 2017 на Скриппсовской конференции по биологии старения, заставляют меня всё больше в этом уверяться. Вообще, для меня это очень интересные, я бы даже сказал революционные, данные. Вот его полная видеопрезентация, посмотрите, не пожалеете:
Что же Андрей рассказал такого революционного? А вот что:




Какая у Андрея Гудкова гипотеза на этот счёт? Что, по его мнению, объясняет все эти загадочные наблюдения, резюмированные на слайде ниже?

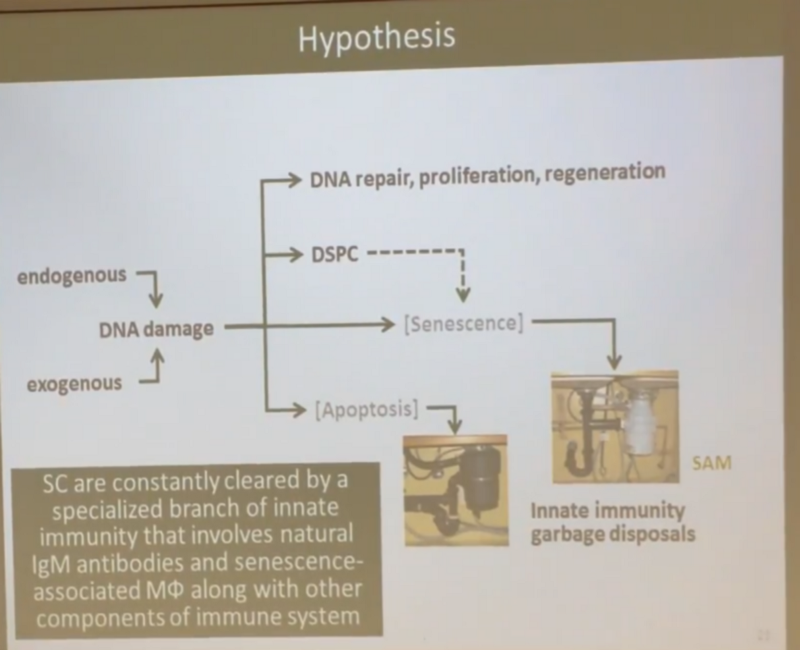
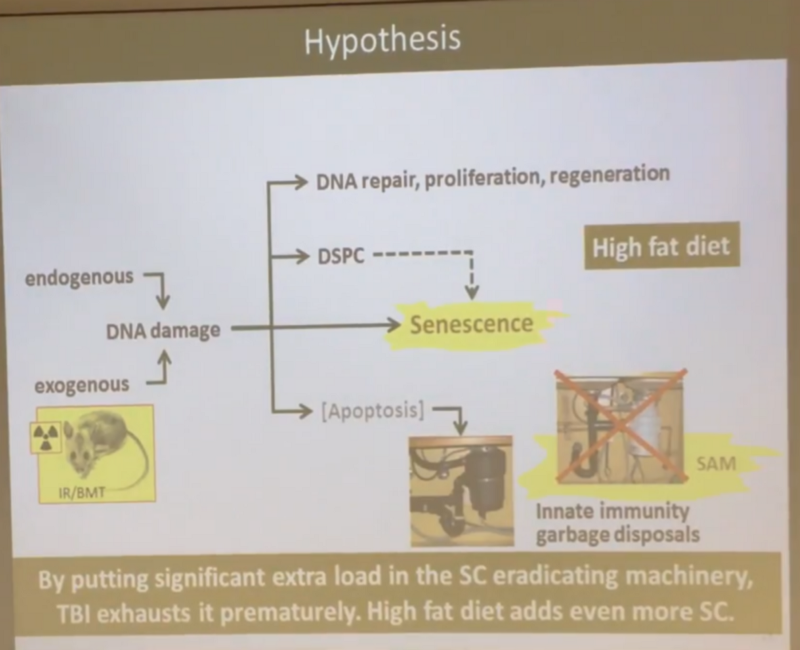
Гипотеза следующая: по мере возникновения повреждений ДНК большинство клеток (не убитых тотчас же с помощью апоптоза), в которых эти повреждения организму немедленно починить не удалось, не превращается сразу в сенесцентные (как в неверной, по мнению Андрея, общепринятой сегодня гипотезе со слайда выше), а замирает в некоем состоянии, названном им DSPC (Dormant Senescent-Prone Cells, или “затаившиеся про-сенесцентные клетки”).
То есть эти клетки продолжают жить и функционировать, а сенесцентными становятся только если у них возникает необходимость делиться, но тут в дело вступает (врожденная) иммунная система, в которой отлично отлажена функция отлова и убийства сенесцентных клеток — за это в ней отвечают макрофаги и иммуноглобулины М (IgM). Схематично новая гипотеза Андрея выглядит вот так:
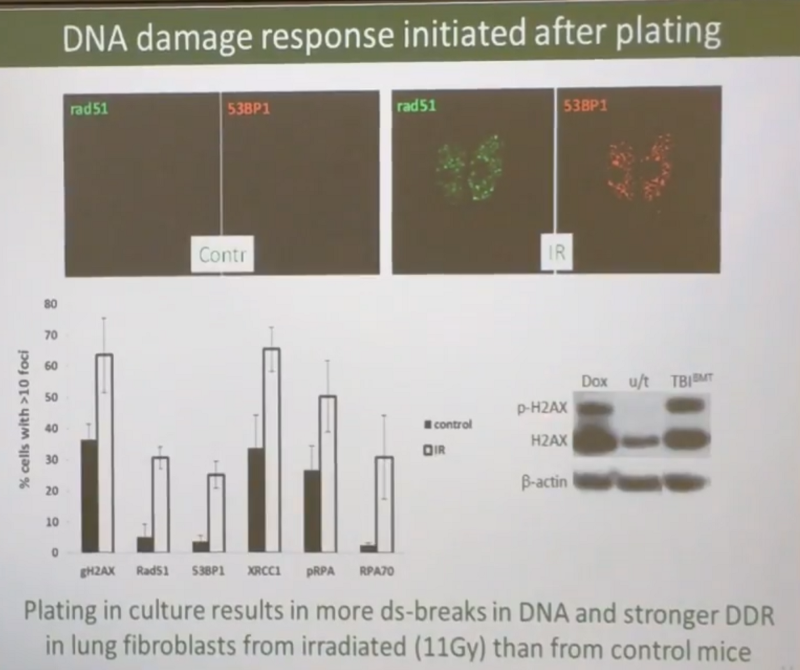
Правда, Андрей считает, что всё вышесказанное верно только для мезенхимальных клеток, а эпителиальные клетки после облучения идут по самому верхнему пути на слайде выше, то есть поломки ДНК в них сразу чинятся. В подтверждение того, что мезенхимальные клетки полны поломок, Андрей приводит данные, что у облученных мышей в них на порядок больше двухцепочных разрывов ДНК:

Проверял ли Андрей эпителиальные клетки на двухцепочные разрывы, чтобы протестировать свою гипотезу, что поломки в них сразу чинятся, я не знаю. Но на основании экспериментальных данных по мезенхимальным клеткам, Андрей считает, что после облучения почти 100% из них становятся такими “про-сенесцентными” (DSPC), как он пишет на этом слайде:
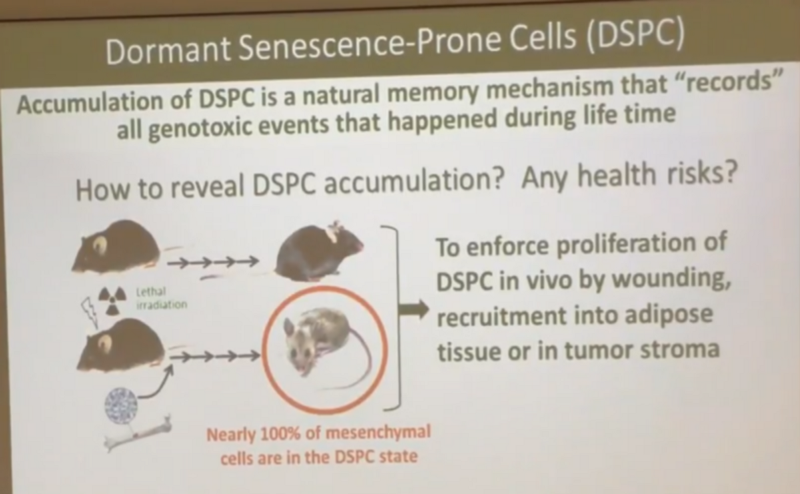
И именно то, что при делении они становятся сенесцентными и убиваются иммунной системой, как раз объясняет, по мнению Андрея, лучшую резистентность облученных мышей к раку?—?опухоль не может быстро расти, так как новые кровеносные сосуды, призванные снабжать ее кровью, растут у таких мышей гораздо медленней, поскольку клетки-предшественницы этих сосудов все являются про-сенесцентными.
Про-сенесцентность таких клеток Андрей доказал экспериментально — в клеточной культуре клетки облученных мышей почти сразу превращаются в сенесцентные и не растут, в отличие от клеток контрольных мышей:

Что еще, по мнению Андрея, подтверждает эту гипотезу, так это то, что на высококалорийной диете (или высокожирной, если быть точным), облученные мыши умирают ещё быстрее. Правда, в других экспериментах было показано, что жирная диета и сама по себе укорачивает жизнь мышам, и тот факт, что группа необлученного контроля на жирной диете тоже потеряла около 10% популяции одновременно с облученной группой, в моих глазах, даёт повод для некоторых сомнений. Поэтому очень хотелось бы видеть полную кривую дожития для необлученного контроля на жирной диете:

Как Андрей показал, что именно иммунная система отвечает за контроль и ликвидацию сенесцентных клеток? Очень красиво. Он поместил сенесцентные клетки в некую конструкцию, напоминающую металлическую клетку для ныряльщиков к акулам, и вживил эти конструкции в мышь. А затем посмотрел, что за акулы к этим “клеткам” приплывают. Акулами оказались, в основном, макрофаги (с обычным антуражем других иммунных клеток — эозинофилами и пр.).
Вот на этом графике показано, что без защитных “клеток” сенесцентные клетки очень быстро исчезают (популяция снижается в 100 раз) после вживления в мышь (зеленая кривая), а когда их помещают в защитную капсулу, делая недоступными для любых других клеток, их численность практически не снижается (синяя кривая):

А вот и акулы: макрофаги. Причем, что удивительно — сами эти макрофаги начинают экспрессировать сенесцентный маркер бета-галактозидазы, который ранее считали маркером исключительно сенесцентных клеток. Почему это происходит, я пока не понял, и Андрей, по-моему, тоже.

Причем Андрей показал и в другом эксперименте, что значительная часть тех клеток, которые мы раньше считали сенесцентными, является макрофагами, которые сами по себе вряд ли являются сенесцентными (то есть не выделяют SASP — уже упомянутый коктейль провоспалительных факторов), а, скорее всего, разбросаны среди популяции настоящих сенесцентных клеток, как бойцы на поле брани:
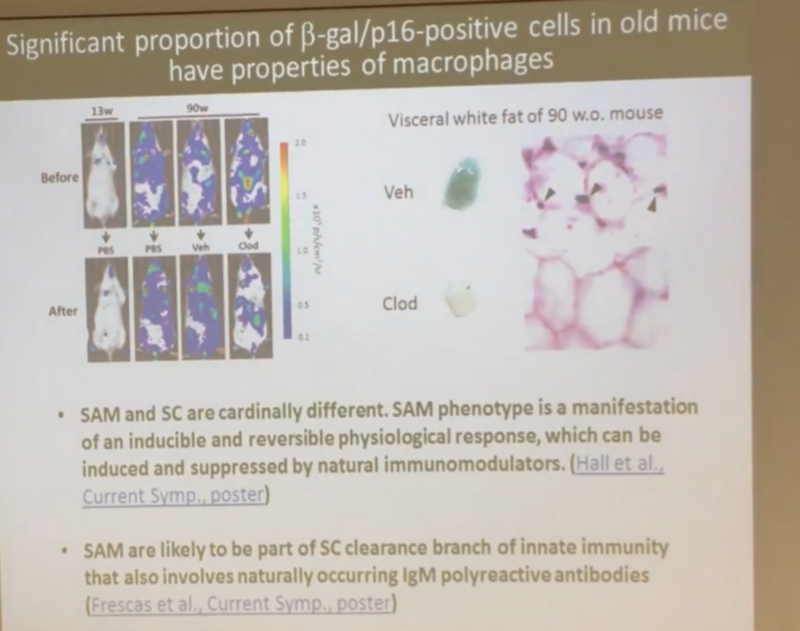
Главный вопрос и у меня, и у Андрея — почему эти бойцы так хорошо справляются с сенесцентными клетками до наступления старости, а потом справляться резко перестают. Тут наши точки зрения расходятся. Андрей считает, что с возрастом исчерпывается некий ресурс иммунной системы, и именно поэтому она перестает с ними справляться. А у облученных мышей этот ресурс исчерпывается быстрее, потому что там сенесцентных клеток намного больше:
С гипотезой ресурса я, конечно же, не согласен. Я не могу себе представить, что 11 Гр радиации, превращающие 100% мезенхимальных клеток в про-сенесцентные, начинает исчерпывать ресурс только по прошествии года, да и то сокращая среднюю ПЖ лишь на 28%, а максимальную ПЖ на 18–20%.
При этом мне очень интересно, почему эпителиальные клетки, согласно гипотезе Андрея, избавлены от этой участи. Мне кажется важным вникнуть, что именно происходило у облученных мышей с быстроделящимися тканями и как это стыкуется с гипотезой про-сенесцентных клеток. Ведь в организме довольно много быстрообновляющихся популяций: кишечник, желудок, легкие, половая система (кровяная система не в счет, так как она формируется в основном костным мозгом, который облученным мышам был пересажен от интактных доноров):
Также мне не очень понятно как мезенхимальные клетки облученных мышей умудрялись продолжать функционировать и безошибочно синтезировать правильные белки для своей жизнедеятельности, если у них было в разы больше поломок ДНК (ведь белки строятся по ДНК). Кстати, это еще один отличный контраргумент против гипотезы “старения от накопления мутаций” (ведь есть ещё кто-то, кто в эту гипотезу верит…). Если помните, двухцепочных разрывов ДНК у облученных мышей было на порядок больше.
В любом случае мне гораздо более правдоподобной видится концепция запрограммированного снижения качества репарационных механизмов, которые в молодости даже после мега-дозы радиации не допускают возникновения сенесцентных клеток, а в старости даже у контрольных мышей вызывают схожие их количества.
При этом жирная диета — это сигнал для внутренних часов ускорять старение. А ограничение калорий — сигнал обратный, значительно продлевающий жизнь обычным мышам. Да, и сублетальные дозы радиации (в 25–50 раз выше фоновой), кстати, тоже продлевали жизнь мышам на 20%. Что, в моем понимании, плохо сочетается с любыми концепциями ресурсов. Кстати, было бы интересно посмотреть эффект ограничения калорий на облученных мышей.
У Андрея есть свой сенолитик, EBS3899 (от Everon Biosciences), который отлично работал в клеточных культурах, но при трансляции в живой организм был, по словам Андрея, гораздо менее эффективен: эффект увеличения СПЖ на 13% наблюдался только у мышей мужского пола, и только если сенолитик применялся на 89-й неделе жизни (более раннее применение к увеличению ПЖ не приводило, как и его применение у самок):

Поэтому главный вывод Андрея, как я его услышал, в том, что надо искать инструменты воздействия на другие механизмы старения (разводные ключи на слайде), если мы хотим добиться гораздо большего увеличения ПЖ:

И в этом с Андреем сложно не согласиться.
Кстати, возможно, с ним согласен даже Нед Дэвид, глава Unity Biotechnology — крупнейшего стартапа по разработке сенолитиков, в который инвестировали Питер Тиль и Джефф Безос. Дэвид уже дважды встречался с Хуаном Карлосом Исписуа Бельмонте, автором так любимой мною работы, и в марте 2017 года они уже обсуждали некоторые возможные последующие шаги.
Что ж, с большим интересом будем следить за дальнейшим развитием событий.

В борьбе со старением постоянно возникают и быстро входят в моду новые и новые гипотезы какой-то Великой Терапии, которая поможет одержать в этой борьбе решительную победу. Не так давно это была Её Величество Теломераза, но пару лет назад её сместили с трона сенолитики?—?средства борьбы с сенесцентными клетками. Это такие клетки-зомби, которые мало того, что уже не выполняют свои функции и при этом отказываются умирать, но ещё и отравляют всё вокруг себя, выделяя коктейль провоспалительных веществ, называемый “senescence-associated secretory phenotype” или SASP.

Правда, как это уже часто бывало, корреляция может опять пытаться проявить своё коварство и направить нас по ложному следу: то, что в организме по мере старения становится больше сенесцентных клеток, ещё не означает, что они являются его драйвером. И очень похоже, что они таким ложным следом могут оказаться. Последние исследования Андрея Гудкова?—?профессора, доктора биологических наук, основателя и научного директора биотехнологической компании Cleveland BioLabs, и вообще одного из самых успешных русских биологов за рубежом?—?результаты по которым он представил в январе 2017 на Скриппсовской конференции по биологии старения, заставляют меня всё больше в этом уверяться. Вообще, для меня это очень интересные, я бы даже сказал революционные, данные. Вот его полная видеопрезентация, посмотрите, не пожалеете:
Экспериментальные наблюдения
Что же Андрей рассказал такого революционного? А вот что:
- У мышей, облученных на 10 неделе жизни “смертельной” дозой радиации в 11 Гр (видимо, эта доза смертельна, если мышам после облучения не пересадить сразу донорский костный мозг, что и было сделано в экспериментах Гудкова), не обнаруживается никаких сенесецентных клеток даже через 30 недель после облучения. Что весьма странно, потому что in vitro (в клеточных культурах) облучение — гарантированный способ отправить значительную часть клеток в сенесцентное состояние (вот, на фото ниже темные скопления — это сенесцентные клетки; обратите внимание, сколько их при облучении клеточной культуры дозой в 11 Гр):

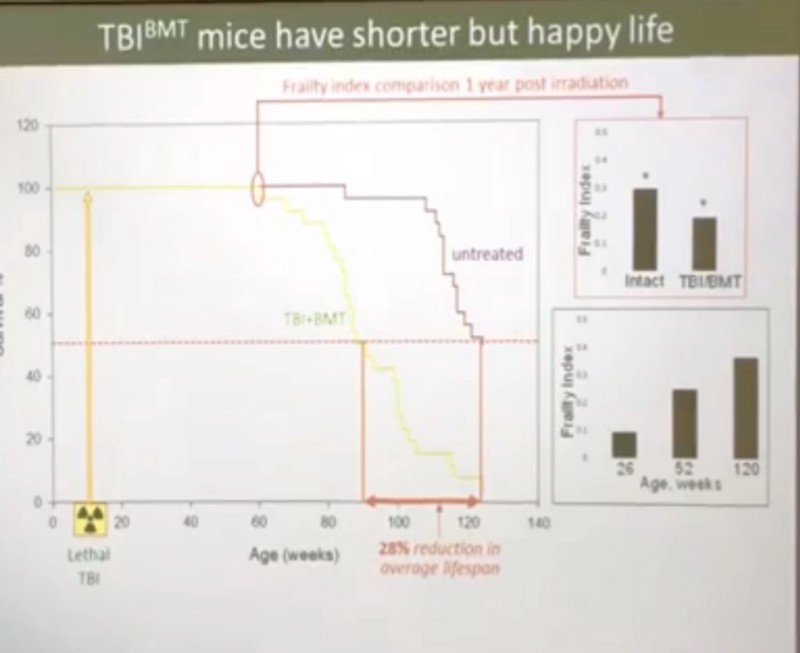
- Более того, индекс хрупкости у облученных мышей спустя год после радиации был лучше, чем у мышей контрольных, не получавших облучение, да и жили облученные мыши не кардинально меньше контрольных (средняя ПЖ в 90 недель против 120 контрольных, а максимальная ПЖ облученных мышей была 120 недель против 135 недель в другом эксперименте):

- При этом у мышей не только не обнаруживается сенесцентных клеток, но и цитокиновый профиль воспалительного ответа не отличается от контрольных мышей, чего нельзя сказать о необлученных старых мышах, у которых воспалительный ответ намного выше (тот самый inflammaging). То есть иммунная система после облучения прекрасно работает на том же уровне, что и у необлученных сверстников. Тут, правда, важно помнить, что костный мозг у облученных мышей донорский, и что именно он является источником гемопоэтических стволовых клеток, предшественниц подавляющего большинства иммунных клеток (тканевые макрофаги и прочие тканевые иммунные резиденты — исключение). Но в любом случае очень странно видеть, что облучение никак не влияет ни на воспалительный ответ, ни на количество сенесцентных клеток. На слайде ниже приведены 40-недельные облученные (3-й ряд) мыши, в сравнении с 40-недельными (1-й ряд) и 98-недельными (2-й ряд) необлученными. Наглядно видно, что сенесцентные клетки (синие пятна) присутствуют только у необлученных 98-недельных мышей. Последняя колонка справа — цитокиновый профиль иммунного ответа:

- Кстати, и транскриптом у облученных и необлученных 40-недельных мышей почти идентичен, в отличие от транскриптома 98-недельных мышей:

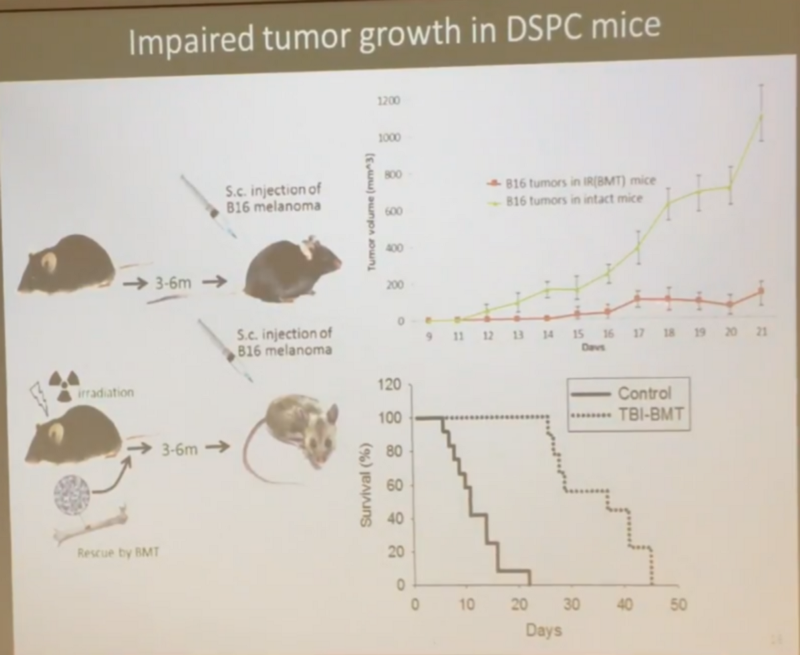
- А резистентность к раку у облученных мышей вообще выше. В модели индуцированного рака, когда мышам вводят клетки меланомы (B16 melanoma cells), облученные мыши жили дольше необлученных, хоть у них и было гораздо больше метастазов в легких:

- И раковые опухоли у облученных мышей росли гораздо медленней (красная кривая против зеленой), а средняя выживаемость была в 3,5 раза выше необлученных (то есть еще лучше, чем равная средняя выживаемость в предыдущем эксперименте):

Гипотеза Андрея Гудкова
Какая у Андрея Гудкова гипотеза на этот счёт? Что, по его мнению, объясняет все эти загадочные наблюдения, резюмированные на слайде ниже?

Гипотеза следующая: по мере возникновения повреждений ДНК большинство клеток (не убитых тотчас же с помощью апоптоза), в которых эти повреждения организму немедленно починить не удалось, не превращается сразу в сенесцентные (как в неверной, по мнению Андрея, общепринятой сегодня гипотезе со слайда выше), а замирает в некоем состоянии, названном им DSPC (Dormant Senescent-Prone Cells, или “затаившиеся про-сенесцентные клетки”).
То есть эти клетки продолжают жить и функционировать, а сенесцентными становятся только если у них возникает необходимость делиться, но тут в дело вступает (врожденная) иммунная система, в которой отлично отлажена функция отлова и убийства сенесцентных клеток — за это в ней отвечают макрофаги и иммуноглобулины М (IgM). Схематично новая гипотеза Андрея выглядит вот так:

Правда, Андрей считает, что всё вышесказанное верно только для мезенхимальных клеток, а эпителиальные клетки после облучения идут по самому верхнему пути на слайде выше, то есть поломки ДНК в них сразу чинятся. В подтверждение того, что мезенхимальные клетки полны поломок, Андрей приводит данные, что у облученных мышей в них на порядок больше двухцепочных разрывов ДНК:


Проверял ли Андрей эпителиальные клетки на двухцепочные разрывы, чтобы протестировать свою гипотезу, что поломки в них сразу чинятся, я не знаю. Но на основании экспериментальных данных по мезенхимальным клеткам, Андрей считает, что после облучения почти 100% из них становятся такими “про-сенесцентными” (DSPC), как он пишет на этом слайде:

И именно то, что при делении они становятся сенесцентными и убиваются иммунной системой, как раз объясняет, по мнению Андрея, лучшую резистентность облученных мышей к раку?—?опухоль не может быстро расти, так как новые кровеносные сосуды, призванные снабжать ее кровью, растут у таких мышей гораздо медленней, поскольку клетки-предшественницы этих сосудов все являются про-сенесцентными.
Про-сенесцентность таких клеток Андрей доказал экспериментально — в клеточной культуре клетки облученных мышей почти сразу превращаются в сенесцентные и не растут, в отличие от клеток контрольных мышей:

Что еще, по мнению Андрея, подтверждает эту гипотезу, так это то, что на высококалорийной диете (или высокожирной, если быть точным), облученные мыши умирают ещё быстрее. Правда, в других экспериментах было показано, что жирная диета и сама по себе укорачивает жизнь мышам, и тот факт, что группа необлученного контроля на жирной диете тоже потеряла около 10% популяции одновременно с облученной группой, в моих глазах, даёт повод для некоторых сомнений. Поэтому очень хотелось бы видеть полную кривую дожития для необлученного контроля на жирной диете:

Иммунная система — санитар леса
Как Андрей показал, что именно иммунная система отвечает за контроль и ликвидацию сенесцентных клеток? Очень красиво. Он поместил сенесцентные клетки в некую конструкцию, напоминающую металлическую клетку для ныряльщиков к акулам, и вживил эти конструкции в мышь. А затем посмотрел, что за акулы к этим “клеткам” приплывают. Акулами оказались, в основном, макрофаги (с обычным антуражем других иммунных клеток — эозинофилами и пр.).
Вот на этом графике показано, что без защитных “клеток” сенесцентные клетки очень быстро исчезают (популяция снижается в 100 раз) после вживления в мышь (зеленая кривая), а когда их помещают в защитную капсулу, делая недоступными для любых других клеток, их численность практически не снижается (синяя кривая):

А вот и акулы: макрофаги. Причем, что удивительно — сами эти макрофаги начинают экспрессировать сенесцентный маркер бета-галактозидазы, который ранее считали маркером исключительно сенесцентных клеток. Почему это происходит, я пока не понял, и Андрей, по-моему, тоже.

Причем Андрей показал и в другом эксперименте, что значительная часть тех клеток, которые мы раньше считали сенесцентными, является макрофагами, которые сами по себе вряд ли являются сенесцентными (то есть не выделяют SASP — уже упомянутый коктейль провоспалительных факторов), а, скорее всего, разбросаны среди популяции настоящих сенесцентных клеток, как бойцы на поле брани:

Главный вопрос и у меня, и у Андрея — почему эти бойцы так хорошо справляются с сенесцентными клетками до наступления старости, а потом справляться резко перестают. Тут наши точки зрения расходятся. Андрей считает, что с возрастом исчерпывается некий ресурс иммунной системы, и именно поэтому она перестает с ними справляться. А у облученных мышей этот ресурс исчерпывается быстрее, потому что там сенесцентных клеток намного больше:

С гипотезой ресурса я, конечно же, не согласен. Я не могу себе представить, что 11 Гр радиации, превращающие 100% мезенхимальных клеток в про-сенесцентные, начинает исчерпывать ресурс только по прошествии года, да и то сокращая среднюю ПЖ лишь на 28%, а максимальную ПЖ на 18–20%.
При этом мне очень интересно, почему эпителиальные клетки, согласно гипотезе Андрея, избавлены от этой участи. Мне кажется важным вникнуть, что именно происходило у облученных мышей с быстроделящимися тканями и как это стыкуется с гипотезой про-сенесцентных клеток. Ведь в организме довольно много быстрообновляющихся популяций: кишечник, желудок, легкие, половая система (кровяная система не в счет, так как она формируется в основном костным мозгом, который облученным мышам был пересажен от интактных доноров):

Также мне не очень понятно как мезенхимальные клетки облученных мышей умудрялись продолжать функционировать и безошибочно синтезировать правильные белки для своей жизнедеятельности, если у них было в разы больше поломок ДНК (ведь белки строятся по ДНК). Кстати, это еще один отличный контраргумент против гипотезы “старения от накопления мутаций” (ведь есть ещё кто-то, кто в эту гипотезу верит…). Если помните, двухцепочных разрывов ДНК у облученных мышей было на порядок больше.
В любом случае мне гораздо более правдоподобной видится концепция запрограммированного снижения качества репарационных механизмов, которые в молодости даже после мега-дозы радиации не допускают возникновения сенесцентных клеток, а в старости даже у контрольных мышей вызывают схожие их количества.
При этом жирная диета — это сигнал для внутренних часов ускорять старение. А ограничение калорий — сигнал обратный, значительно продлевающий жизнь обычным мышам. Да, и сублетальные дозы радиации (в 25–50 раз выше фоновой), кстати, тоже продлевали жизнь мышам на 20%. Что, в моем понимании, плохо сочетается с любыми концепциями ресурсов. Кстати, было бы интересно посмотреть эффект ограничения калорий на облученных мышей.
Так что там с сенолитиками?
У Андрея есть свой сенолитик, EBS3899 (от Everon Biosciences), который отлично работал в клеточных культурах, но при трансляции в живой организм был, по словам Андрея, гораздо менее эффективен: эффект увеличения СПЖ на 13% наблюдался только у мышей мужского пола, и только если сенолитик применялся на 89-й неделе жизни (более раннее применение к увеличению ПЖ не приводило, как и его применение у самок):

Поэтому главный вывод Андрея, как я его услышал, в том, что надо искать инструменты воздействия на другие механизмы старения (разводные ключи на слайде), если мы хотим добиться гораздо большего увеличения ПЖ:

И в этом с Андреем сложно не согласиться.
Кстати, возможно, с ним согласен даже Нед Дэвид, глава Unity Biotechnology — крупнейшего стартапа по разработке сенолитиков, в который инвестировали Питер Тиль и Джефф Безос. Дэвид уже дважды встречался с Хуаном Карлосом Исписуа Бельмонте, автором так любимой мною работы, и в марте 2017 года они уже обсуждали некоторые возможные последующие шаги.
Что ж, с большим интересом будем следить за дальнейшим развитием событий.

Поделиться с друзьями
Комментарии (3)
ferreto
28.06.2017 23:39Странно от вас это слышать: "А ограничение калорий — сигнал обратный, значительно продлевающий жизнь...". А как же "голодай не голодай..."

kvasvik
Для чистоты экспреримента, надо было и мышам из контрольной группы сделать пересадку костного мозга от тех же доноров. А то теперь не понятно, сокращение числа токсичных клеток вызвано их стерилизацией или подсадкой молодого костного мозга.