Можно сколько угодно говорить о том, что с медициной в России что-то не так, но защита потребителя у нас одна из лучших в мире. По сравнению с нашими европейские нормы по медицинским изделиям — это просто филькина грамота.
У нас в последние годы надо доказывать любой эффект. То есть, если вам встретилась мазь от морщин, а морщины она не убирает, можно пожаловаться в Роспотребнадзор. И где-то далеко на производстве послышится звук открываемой банки вазелина. Если вам поплохело после того, как вы приняли какой-нибудь лечебный бальзам, тоже можно жаловаться. И снова — чпок, к кому-то придут с проверкой.
Нас вся эта история ужесточения требований серьёзно коснулась пару лет назад, когда мы регистрировали Блефарогель. Но давайте я просто расскажу подробно сколько вазелина, слез и соплей мы потратили на этот процесс.
4 круга ада
Основа для регистрации медицинских изделий — это постановление № 1416.
Там описаны правила и порядок регистрации. Для того чтобы пройти эту довольно сложную процедуру, нужно провести следующие испытания:
- Токсикологические (доказывающие, что изделие безопасно с точки зрения материалов и используемых в формуле веществ).
- Технические (доказывающие, что изделие по своим свойствам и техническим характеристикам соответствует требованиям ТУ и эксплуатационной документации производителя, а также то, что процесс производства будет единообразен и не надо будет проверять каждый отдельный элемент партии).
- Клинические (доказывающие эффективность и безопасность решения медицинской задачи).
- И экспертизу качества, эффективности и безопасности, где комиссия собирает все данные по изделию в одну кучу и принимает решение о возможности его регистрации и выпуске на рынок.
Важный момент: по закону медицинское изделие не может лечить. То есть если оно оказывает лечебный эффект, то это лекарство, совершенно другая категория. Медизделие может быть чем-то вспомогательным в процессе. Например, если регистрируется тонометр, надо доказать, что он измеряет давление, что рукав в местах соприкосновения с кожей не вызовет аллергию или разные дерматиты, что давление будет измеряться с заданным допуском в течение всего срока эксплуатации прибора. В случае с какой-нибудь уткой надо доказывать её гипоаллергенность и безопасность для пациента. В случае с нашими гелями главное — пройти Росздравнадзор, в том числе токсикологию.
Раньше с токсикологией было относительно просто. Сегодня надо начать с аналитики компонентов и их взаимодействия. Что важно, касается это не только самого изделия, но и упаковки. Раньше проверили бы только гель, а сейчас по новым стандартам — гель и упаковку (флакон с крышкой) всех используемых фасовок и цветовой гаммы, а также их взаимодействие. Сделано это для того, чтобы вещества флакона не меняли свойства геля, мигрируя в его состав.
Сначала нужно провести литобзор, то есть найти информацию в виде статей и отзывов на зарегистрированные аналоги, доказывающую их эффективность и безопасность, найти практику по действующим веществам и доказать, что они в смеси безопасны.
Почему первый этап по литобзору? Напомню, что у нас не лекарство, а медизделие. Там не требуется испытывать новую формулу. Чаще всего.
Выглядит это так: ссылаемся на статьи для экспертизы, то есть находим в архивах журналы, нотариально заверяем скриншоты и копии, чтобы комиссия потом сама не искала.
Затем нужны отзывы из клинической практики по зарегистрированным аналогам. То есть мы должны найти публикации (или взять уже когда-то зарегистрированный ближайший аналог и проверить, как он решает эту задачу). На основании собранной информации о зарегистрированных аналогах оформляется акт оценки результатов клинических испытаний медицинских изделий.
Далее с пакетом документов, подтверждающих проведение всех этапов, указанных выше, а также с другими дополнительными документами на медицинское изделие направляемся в Росздравнадзор для регистрации.
Как проходит процесс
Сначала подаётся заявление и досье на будущее изделие в Росздравнадзор. В заявлении описывается назначение, класс риска, область применения и другая информация о медицинском изделии, а также данные о производителе. Кроме заявления, прикладывается комплект документов: протоколы, акты обо всех проведённых испытаниях, техническая документация (ТУ), эксплуатационная документация (инструкция по применению, этикетки), фотографические изображения, отчёт об анализе рисков, сведения о нормативной документации, акт квалификационных испытаний, а также договоры аренды и другие документы производителя.
То есть на момент подачи заявления надо закончить все внутренние тесты (у нас внутри производства в собственной лаборатории они делаются жёстче, чем в гослабораториях, потому что это элементарно выгоднее — заходить с первого раза и не сталкиваться с отзывами партий потом в процессе продаж). Потом сдать в одну из лабораторий с государственной аккредитацией токсикологию.
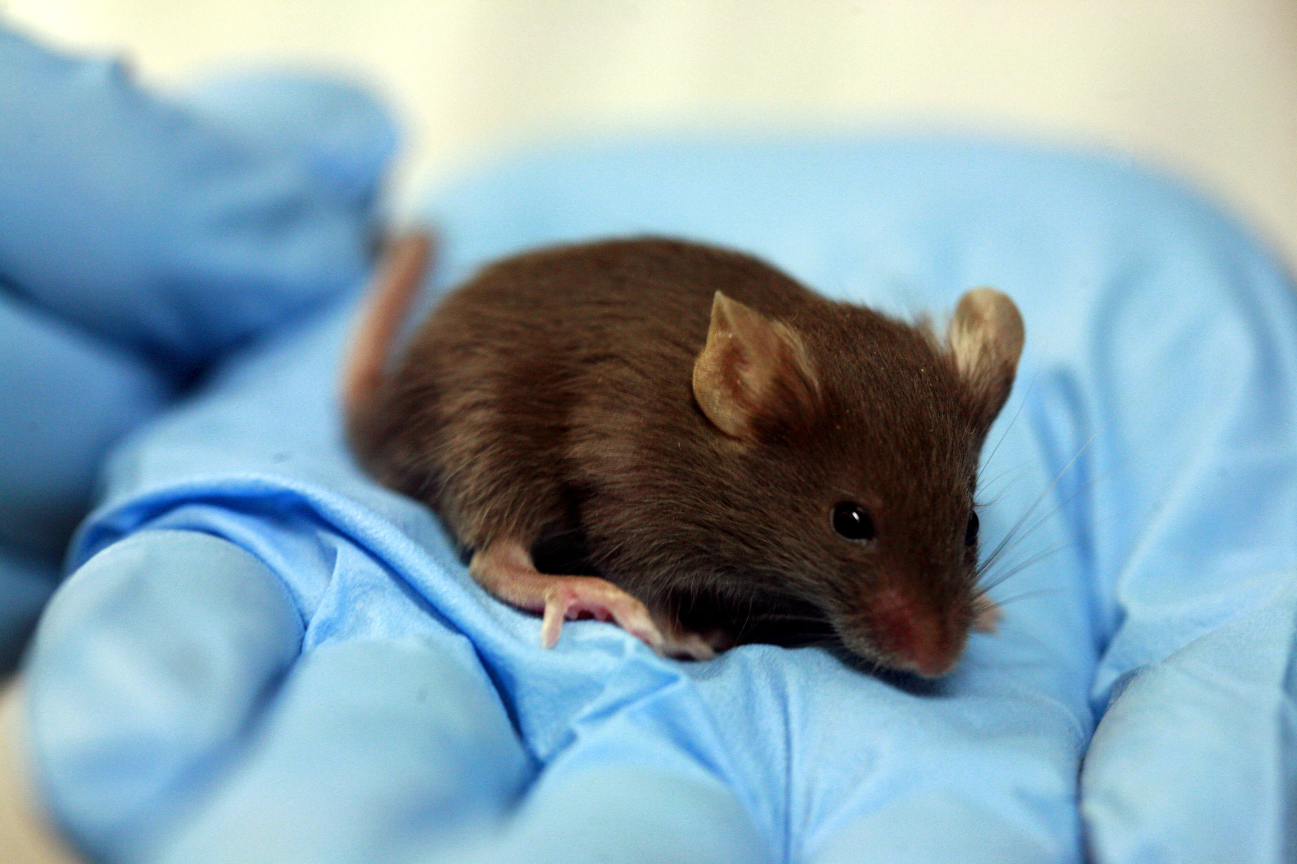
В нашем случае, например, Блефарогель (средство для гигиены век при профилактике синдрома сухого глаза) — это гель, который наносится на веки и кожу лица. На токсикологии были мыши. Что с ними точно делали, не знаю, но предполагаю, что выбривали два участка на каждом животном, один мазали гелем, второй оставляли или мазали чем-то нейтральным. И следили за мышкой. Внутрь мыши, к счастью, не пихали. (Ладно, почти не пихали — дело в том, что в паспорте безопасности [или MSDS — material safety data sheet] пропиленгликоля есть данные по смертельной дозе при приёме перорально. Его надо 4 грамма на мышь [её физически разрывает при этом, скорее всего]. И ведь как-то они эту дозу устанавливали…) Но вернёмся к более удачливым мышиным товаркам, которых просто мажут. У них есть соседки, которым достались чистые флаконы от средства, в которые наливают воду и отстаивают. Затем их мажут этой водой из флаконов, чтобы проверить, что пластик со временем не выпускает что-то опасное. Или нет: точная методика производителям не раскрывается, есть высокая вероятность, что эту воду из флакона просто химически анализируют и уже при подозрениях заносят внутрикожно.
Мышек нам жалко, но подход такой: если бы не наши тесты, они бы вообще не родились. В целом их там не мучают (по крайней мере, мы заходим уже с готовым исследованием на себе). Ещё мы знаем, что лаборанты испытывают к мышкам тёплые чувства, сравнимые с любовью деревенского жителя к курице. И мы подозреваем, что в конце исследований мышка не утилизируется окончательно, а отправляется на реабилитацию перед новыми тестами. Но это только теория: если здесь есть кто-то, кто может рассказать про их судьбу, то было бы замечательно.
К этой же заявке надо приложить технические исследования. Конкретно — написать ТУ (нормативный документ на медицинское изделие, устанавливающий технические требования) и доказать, что медицинское изделие ему соответствует. Эксперты согласовывают наши условия. Потом там же проверяется стабильность серийных образцов и соответствие их «досье» изделия: цвет, запах, электропроводность, ослабление УЗ-сигнала и так далее — всё то, что указано. На этой стадии часто требуют переформулировать то или иное слово в описании изделия. Тот же наш Медиагель имеет разную вязкость: это одно удостоверение регистрации, но три набора испытаний — для средней вязкости, более жидкого и более плотного геля.
Такие же регулярные проверки на соответствие ТУ мы проводим на собственном производстве. Всего один раз за всю практику был случай, когда мы приблизились к допустимым границам теста, обычно идём ровно по центру допусков между границами.
Класс риска изделия определяется по его назначению, способу применения, длительности применения, инвазивности и другим критериям. У нас у гелей для УЗИ, например, длительность контакта с кожей до одного часа — это первый класс. А во второй класс, например, попадают гинекологические зеркала, разные вещи для новорождённых.
Есть разница в клинических испытаниях. Первый класс — клинические испытания можно делать сразу. Второй класс и выше — клиника только после официального разрешения Росздравнадзора. До клинических испытаний команда разработки имеет право испытывать только на себе. Цель — убедиться в основном эффекте. Цель беты — понять возможные побочные эффекты и разные интересные случаи вроде «на фоне приёма других лекарств». Клинические испытания начинаются тогда, когда в теории доказана безопасность медизделия.
Отмечу, что если речь не про медизделие, а про косметику, то исследования ведутся на добровольцах в клиниках, имеющих аккредитацию на научные исследования такого типа.
На практике так: комиссия заканчивает анализ документов (за исключением медизделий 1-го класса риска применения и медизделий для диагностики in vitro), затем присылают письмо и дают 50 рабочих дней на то, чтобы провести клинические исследования и предоставить им результаты. По большинству наших гелей вся клиническая практика была получена ещё до ужесточения требований, поэтому сложностей никаких не было. Но вот сейчас у нас целевой заказ от офтальмологов на новый Блефарогель Форте — это как Блефарогель-2 с соединениями серы для демодекса, только для запущенных случаев. Если Блефарогель-1 — это «чтобы глаза не болели, пока я сижу за компьютером», Блефарогель-2 — «чтобы не было воспаления от клеща и ему нечего было есть на веках», то Блефарогель Форте будет «геноцид клещей любой ценой». В смысле, что мы сознательно повышаем опасность аллергии, увеличивая долю действующих веществ, но рекомбинируем формулу так, чтобы помогло в особо сложных случаях. Поскольку это делается по запросу врачей, которые только предвидят, что им нужно такое средство.
Конец эпопеи
Дальше проверяется полнота документов в Росздравнадзоре: выделяется консультант-исполнитель, который просто проверяет пакет. Документы сканируют и отправляют в экспертную организацию в ведомстве Росздравнадзора. В результате в Росздраве документально оформляется заключение на основе совокупности всех документов. Делает его экспертная группа. Если всё хорошо и документы друг другу соответствуют, то дальше дают разрешение на госрегистрацию.
С этого момента ничего трогать нельзя вообще. Заменить букву на этикетке либо заменить значок автоматически означает, что надо проходить перерегистрацию. Нас попросили как-то поменять этикетку Медиагеля-с на русско-английскую. Это значит проведение перерегистрации. Полгода ушло на то, чтобы внести английский текст.
Поскольку процесс экспертный, то во многом он связан с конкретными толкованиями довольно сложных норм. Это значит, что несколько раз вы можете подать документы по одной и той же схеме, а потом окажется, что будет нужна новая бумажка. В целом это некая случайность: могут завернуть на каждой переподаче. Старая госрегистрация при этом остаётся и никуда не девается, но мы теряем деньги на испытания и платим большую госпошлину даже за регистрацию и внесение изменений. И ещё тратим государственных мышей.
Дальше надо ждать приказа на бумаге. Когда будет приказ, изделие попадёт в реестр, то есть на сайт, на котором аптеки смотрят, что есть что. Только с этого момента можно что-то делать. Аптека не берёт изделия, которых нет в РУ Минздрава, если это не косметика, конечно.
Только в этот момент можно начинать производство. Без номера Минздрава не можем не только продавать, но даже производить в России.
Всё, начиная с этого момента мы делаем медизделие серийно. Из опыта: очень важно иметь развитую лабораторию контроля качества, потому что любая жалоба означает тщательную проверку на производстве (комиссии, судя по поведению, нельзя возвращаться без отчёта о хоть каких-то нарушениях) и остановку отгрузок. В этом плане мы предпочитаем проводить приёмо-сдаточные и периодические испытания самостоятельно и исследования на малых выборках перекрывать своими собственными. Я имею в виду, что 10 добровольцев из норматива — это мало, а вот 100 добровольцев — это уже более-менее репрезентативная выборка. В долговременной перспективе более масштабные исследования всегда окупаются, и для меня большая загадка, почему так не всегда делают другие производители.
В следующем посте я постараюсь рассказать про ещё один важный этап исследований — челлендж-тест: это когда образцы специально загрязняются патогенными бактериями. Эту часть исследований ни в коем случае нельзя делать где-то близко от производства или исследовательских лабораторий, поэтому челлендж-тесты выносятся наружу.
Комментарии (25)

Kamalesh
09.08.2018 13:09У нас в последние годы надо доказывать любой эффект. То есть, если вам встретилась мазь от морщин, а морщины она не убирает, можно пожаловаться в Роспотребнадзор.
Ну и далее по тексту мне показалось, что вы не слишком довольны таким положением вещей.
Если не принимать во внимание как эти нормы реализуются на практике, то сам подход совершенно правильный. Я как потребитель могу это только приветствовать. Да, сложно, возможно дорого, но информация об изделии или лекарстве должна соответствовать его реальным свойствам. А не быть просто «с неонкой унутре».
PS Так сколько мышей пострадало-то? :)
elena_pastukhova Автор
09.08.2018 13:43Мы как раз очень довольны и наоборот за строгость системы. Я, как и вы, потребитель, и хочу быть уверена, что в аптеках (и магазинах) продается качественный товар. Да, как производителей косметики и медизделий, нас порой излишняя бюрократия раздражает, конечно же.
Что касается мышей, то надеюсь, от наших средств ни одна мышь в итоге не пострадала. :)

artskep
09.08.2018 15:26У нас в последние годы надо доказывать любой эффект.
Ага, конечно. А Кагоцел, Арбидол (и пачка других фуфломицинов) типа весь из себя доказанный.
Я понимаю вашу боль с прохождением регистрации, но, увы, стандарты у нас хромают…
Foggy4
09.08.2018 19:20+3Дополню вас: Оциллококцинум. Государственный реестр лекарственных средств: №П N014236/01-251217. Фармако-терапевтическая группа: гомеопатическое средство.
«У нас в последние годы надо доказывать любой эффект.» — перед законом все равны, но некоторые видимо равнее?
ogost
10.08.2018 06:28Анаферон туда же. Он всё ещё продаётся в России? У нас вовсю его продают, более того, иногда некоторые врачи даже его прописывают. (Хотя может они это делают чтобы отвязаться от назойливых мамаш, которые всегда знают лучше врача как лечить её дитятко)

arielf
09.08.2018 17:21Как оказалось в России проще зарегистрировать новое лекарство. Ваши комментарии.
Пример в нынешней России — «ионы Скулачёва». Больше 20 л Скулачёв пилил свои уникальные антиоксиданты и ничего не выпилил. За 20 л учёные и инженеры научились выращивать органы, напечатали целую роговицу и кусочки сетчатки — изобрели генные терапии и много чего ещё. Скоро будет легче вырастить новый глаз, чем лечить его нерабочими «ионами»! Он и сына в бизнес привлёк, и внуки не за горами, и всё за наши налоги!
Petr Talantov выполнил анализ их публикации:
Регулярная рубрика “Не поверите, но я читал Вашу статью” снова в эфире. Недавно у нас в гостях побывала группа исследователей с Кафедры детских болезней Первого МГМУ им. И.М. Сеченова. Путем смелой игры с данными и здравым смыслом заведующая кафедрой Н. А. Геппе и ее коллеги “доказали”, что гомеопатический препарат “Коризалия” эффективно лечит насморк левой ноздри.
В этот раз источником вдохновения послужил материал телеканала Russia Today, рассказавшего о невероятных успехах российской инновационной медицины. Героями выпущенного RT сюжета стали борцы за вечную молодость. Интервью телеканалу дает некто Максим Скулачев, продвигающий препарат “от старения” SkQ1. Автор препарата — его отец Владимир Скулачев (вот откуда первые две буквы в названии, а вовсе не от слова Skolkovo, как вы подумали). Расписывая достоинства препарата, Максим разумно полагает, что скромность — путь в безвестность. “Как разрабатываемый вами препарат изменит жизнь человечества?”, — спрашивает корреспондент Russia Today. “Он даст шанс продлить молодость, по крайней мере вдвое.”, — отвечает Максим, — “Сейчас считается, что крайняя отметка молодости организма — 45 лет. Таким образом, можно будет продлить молодость до 90 лет.” Впечатляет, да?
russian.rt.com/science/article/490572-lekarstvo-ot-starosti-uchenye
Пока гениальное изобретение российских ученых проходит клинические испытания, мы можем приобрести в аптеках созданные ими на основе SkQ1 глазные капли “Визомитин”, предназначенные для лечения катаракты и синдрома сухого глаза. По словам Максима они прошли “все стадии сертификации и клинических исследований в России и США”.
Впрочем, перед тем, как начать гордиться международным прорывом российских ученых стоит глубоко вдохнуть и сосчитать до десяти. В американском реестре клинических испытаний ClinicalTrials.gov удалось обнаружить только небольшое клиническое испытание второй фазы. А на рынок лекарства выпускают лишь после масштабных КИ третьей фазы. Получается, что информация о прохождении глазными каплями всех стадий КИ в США не соответствует действительности. Впрочем, и результаты зарегистрированного испытания второй стадии до сих пор не опубликованы. ClinicalTrials.gov поясняет, что оно не прошло контроль качества, а исследователи не смогли дать удовлетворительных ответов на возникшие у реестра сомнения.
clinicaltrials.gov/ct2/show/results/NCT02121301
Однако у самих исследователей сомнений не возникло, они опубликовали результат в журнале Advances in Therapy. Поэтому у нас есть возможность познакомиться с исследованием самостоятельно и попробовать понять, что же именно не устроило ClinicalTrials.gov в работе Скулачевых и ко. Вот, собственно, публикация.
www.ncbi.nlm.nih.gov/pmc/articles/PMC4735228
Начало оптимистичное: авторы, конечно же, приходят к выводу о том, что SkQ1 является эффективным лечением синдрома сухого глаза. Однако по мере того, как я читал статью, в воздухе все отчетливее пахло “Коризалией”. Например, исследовательская группа не стесняется заявлений вроде “SkQ1 демонстрирует большую эффективность, чем у плацебо, хотя разница статистически недостоверна”. То есть отличия с высокой вероятностью случайны и не обусловлены терапевтическим действием (вероятно, по той простой причине, что оно не существует). Называть это “эффективностью”, мягко говоря, неприлично.
А дальше обнаруживаем классическую манипуляцию вероятностями, пи-хакинг во всей красе. Авторы разбили роговицу глаза на множество крохотных участков (верхний, нижний, центральный, темпоральный, назальный) и делают много бессмысленно отдельных сравнений в надежде хоть где-нибудь, до получить вожделенный p < 0.05. Понятно, что при множественных сравнениях чисто случайным образом хоть где-нибудь, да нарисуется нужное значение. Ну это как заявить, что ты экстрасенс и умеешь выкидывать на игральном кубике три шестерки подряд, а потом кинуть его 500 раз и где-нибудь на 373 попытке, получив наконец желаемую последовательность, победно закричать “Ага, я же говорил!”. И у наших борцов со смертью таки получается показать “терапевтический эффект” в центральной части роговицы для одной из дозировок. В остальной части роговицы чудо-лекарство типа не работает. Правда, если сделать необходимую для таких случаев статистическую поправку на множественные сравнения, то и от этого “результата” не останется и следа. Минимальное p = 0,15 (всего я насчитал в статье 59 сравнений). Кстати, странно, что не смотрели результаты отдельно для правого и левого глаза. Все-таки проф. Геппе пока вне конкуренции.
Вот такая прорывная “инновация”. Кстати, в отличие от США в России капли и правда зарегистрированы. Что по этому поводу говорит российский реестр клинических испытаний? Ничего, у нас его нет. Регистрационные досье закрыты. И никто не сможет наехать на МЗ за регистрацию очередного фуфла даже постом в бложике. Это еще один маленький штришок к вопросу замены импортных препаратов на “российские аналоги”.
Конечно, такие “научные” статьи, как процитированная выше, не предназначены для того, чтобы их читали и воспринимали всерьез. Это такая игра: “ученые” делают вид, что занимаются наукой; научный журнал делает вид, что рецензирует статью перед публикацией; российские журналисты (помимо RT победные пресс-релизы печатали ТАСС, РИА “Новости” и другие) делают вид, что понимает о чем речь; чиновники делают вид, что понимают, на что дают деньги. Господь бы с ними со всеми (здесь и далее смягчил стиль после критического замечания Михаила Батина), но последний пункт смущает: деньги то наши и их есть на что потратить, помимо всяких глупостей. Скулачевы работают на базе МГУ и в интервью идет речь о поддержке ректора. Очень надеюсь, что она выражается не в выделении бюджетных денег.
Конечно, можно предположить, что авторы просто непрофессиональны и типа “не ведают, что творят”. Только в это верится с трудом. Один из Скулачевых — аж целый академик РАН. Поэтому, как советовал Лев Ландау, разумно начать с рассмотрения самой просто гипотезы — что мы, вероятно (p < 0,05), имеем дело с обычным жульничеством.

arielf
09.08.2018 17:30И ещё немного:
МЗ РФ опубликовало клинические рекомендации по ведению больных с ишемическим инсультом. И все бы хорошо, если б не раздел, рекомендующий применение «нейропротекторов». Эти замечательные препараты (“Цитофлавин”, “Кортексин”, “Мексидол”, “Церебролизин” и иже с ними) в приличных странах не признают и не используют, так как доказательств эффективности нет. А раз нет, то и незачем лить в пациентов с инсультом, которым и так несладко, всякую дрянь вроде выжимки коры головного мозга свиней и крупного рогатого скота.
Понятное дело, не всем эта часть рекомендаций Минздрава понравилась, было много шума. И вот, внезапно, Минздрав их удалил. Хочется верить, что шум был не зря и КР убрали, чтобы очистить от злосчастных нейропротекторов и прочих постыдных антиоксидантов. Сейчас там висит предыдущая версия КР по инсульту от 2015 года, ставшая до появления нового обновления действующей. Впрочем, она не особо отличается от удаленных скандальных КР-2018 [1].
И в старой и в новой версиях особый восторг вызывают источники, на основе которых рекомендации созданы. Там много совершенно чудесного. Например, есть ссылка аж на пять зарубежных гайдлайнов, упоминающих нейропротекторы. “Разве это плохо – перенимать зарубежный опыт?”, – скажете вы. Это замечательно! Вот только во всех них до единого (!) упоминание сводится к тому, что оснований рекомендовать нейропротекторы к применению при инсульте нет.
Или вот еще, следите за руками. Среди источников есть систематический обзор Davalos et al. 2002 года [2]. Его авторы взяли существовавшие на тот момент небольшие исследования применения цитиколина при инсульте, сделали мета-анализ и получилось, что вроде как некоторый положительный эффект исключать нельзя. Что делают Davalos et al. дальше? Как нормальные ученые, проверяют предварительный результат. В течение пяти лет проводят большое (n=2298) многоцентровое рандомизированное исследование и в 2012 году публикуют результат: нет у цитиколина эффекта при инсульте [3], вообще нет. Испытание остановили за бессмысленностью. А что делают авторы рекомендаций МЗ РФ? Плюют на результат, типа не заметили это пятилетнее, большое и многоцентровое и ссылаются только на первый этап работы исследовательской группы – условно положительный мета-анализ 2002 года, выводы которого сами же авторы и опровергли.
А или вот еще. Чуваки десять лет ходили по конференциям и рассказывали, что вот-вот сделают для Cochrane обзор с “интересными” результатами использования предшественников холина. Так ничего и не сделали, видать результаты оказались не столь интересными или стандарты Cochrane collaboration жестковатыми. Но разве это может помешать Минздраву ссылаться в клинических рекомендациях на постер с тех самых конференций? [4][5]
В общем, там еще много всякого интересного. Клинические испытания с кривым дизайном: без рандомизации, открытые, с крохотными выборками. Исследования на крысах, исследования “в стекле” и другие вещи, которые никак не годятся для обоснования применения препарата у пациентов с серьезным заболеванием.
И ведь даже не скажешь “ну и что такого, что льют больным бесполезную выжимку из мозга свиней, ведь не вредят – и то хорошо”. А вот не факт. Взять исследование “Кортексина” из того же списка [6]. Его провели на трех группах, первые две (n= 136 и n=72) принимали кортексин, третья (n=64) – плацебо. Смертность в группах принимавших “Кортексин” составила 2,9% и 4,2% соответственно, в группе плацебо все остались живы. Во-первых, как они вообще пациентов отбирали если в третьей группе, не получавшей даже базисную терапию (про этичность молчу) все остались живы? Ведь вроде ожидается, что порядка 10% госпитализированных с ишемическим инсультом погибают. Во-вторых, раз уж они рандомизировали пациентов из какой-то особо живучей популяции, то может все-таки стоило обратить внимание на высокую смертность среди тех, кто получал “Кортексин”? Заставило ли это авторов проявить осторожность и не писать о безопасности препаратов? Неа, вот что пишут: “во всех случаях, по мнению исследователей, смертельные исходы не были связаны с приемом изучавшегося препарата.” Да с чего вы, блять, это взяли? Вы же сами там в причинах гибели участников эксперимента указали “внезапная смерть” и прочее, не вселяющее никакой уверенности в отсутствие связи смертей с «Кортексином»!
Осложнения вроде аритмии и повторного инсульта тоже чаще встречались у принимавших “Кортексин” (14.7% и 15.3% vs 10.9%) Но пишут типа, что разница статистически недостоверна. А что делать с тем, что это может быть вызвано как случайным характером различий, так и тем, что проблема реальна, но выборка маловата? В сочетании со смертями ни о чем не хочется задуматься?
Такие, в общем, доказательства эффективности и безопасности. “Какого хрена, Вероника Игоревна?”, – вероятно спрашиваете вы. Молчит Вероника Игоревна, не дает ответа.
PS: Да, кстати, шесть из указанных в КР источников (каждый десятый) – работы за авторством или под редакцией Вероники Игоревны Скворцовой. Нейропротекторы – тема, которой она занималась в прошлой жизни, будучи врачом-неврологом. Не у каждого есть яйца на то, чтобы как Davalos с коллегами признать направление, которое ты разрабатывал десять долбаных лет, тупиковым. Ну либо составители КР не могут “не уважить” начальство и выкинуть из рекомендаций всякую ерунду, которой это начальство когда-то занималось.
PPS: Надеюсь, мы с Kirill Skorobogatykh и Ярослав Ашихмин кое-что забавное в связи с этим в ближайшее время все-таки доделаем.
— [1] cr.rosminzdrav.ru/#!/schema/146
[2] www.ncbi.nlm.nih.gov/pubmed/12468781
[3] www.sciencedirect.com/science/article/pii/S0140673612608137
[4] www.cochrane.org/CD008401/STROKE_choline-precursors-for-acute-and-subacute-ischemic-and-hemorrhagic-stroke
[5] Saver J.,Wilterdink J. Предшественники холина в остром и подостром периоде инсульта: мета-анализ. XXVII международная конференция, посвященная инсульту. Сан Антонио. 24 февраля 2002.
[6] l.facebook.com/l.php?u=http%3A%2F%2Fdocplayer.ru%2F27616105-Klinicheskaya-effektivnost-i-farmakoekonomicheskie-harakteristiki-neyroprotekcii-nizkimi-dozami-korteksina-v-terapii-ostrogo-ishemicheskogo-insulta.html&h=AT2M8W62IHyZ4cPuWhaIbUNv4ubpHvepEGiCIkEoWxLJ4i0yRhyYVRCnrQJrNdWjgP7ou-FVnpBeOWEjvJNtrpEn8XA5vqyDE0FgUq2m_Eb-dxmjCf6-8usoVUULEJNTTtYe-HfqgW7YtS-O5wBqsmgLGQGSPTA

amarao
09.08.2018 17:38Вы так рассказываете про проверку медизделий, что я прям таки поверил, что медецинское изделие, магнитик с неонкой «Супер Турбо Плюс» помогает от паразитов, выводит шлаки и омолаживает организм.

elena_pastukhova Автор
09.08.2018 17:54А все дело в том, что этот чудо-прибор и не медизделие совсем. Во всяком случае, на сайте производителя нет указания РУ Минздрава.

amarao
09.08.2018 18:00+1Да, супер-турбо-плюс это был ионизатор из моего детства.
А вот вам медицинское издение. Найдено в сайте «Федеральной службы по надзору в сфере здравоохранения».
Если читать тяжко, вот главное: Аппликатор магнитный «ОЧКИ МОРФЕЯ» по ТУ 9444-021-11153066-2005 (http://www.roszdravnadzor.ru/services/misearch)
Параметр изделия Значение параметра изделия
Уникальный номер реестровой записи o10607
Регистрационный номер медицинского изделия ФСР 2010/07967 [Скачать РУ]
Дата государственной регистрации медицинского изделия 11.06.2010
Срок действия регистрационного удостоверения Бессрочно
Наименование медицинского изделия Аппликатор магнитный «ОЧКИ МОРФЕЯ» по ТУ 9444-021-11153066-2005
Наименование организации-заявителя медицинского изделия ООО НПФ «НЕВОТОН»
Место нахождения организации-заявителя медицинского
изделия 192012, Poccия, г. Санкт-Петербург, ул. Грибакиных, д.25, корп. 3
Юридический адрес организации-заявителя медицинского
изделия 192012, Россия, г. Санкт-Петербург, ул. Грибакиных, д.25, корп. 3
Наименование организации-производителя медицинского
изделия или организации-изготовителя медицинского изделия ООО НПФ «НЕВОТОН»
Место нахождения организации-производителя медицинского
изделия или организации — изготовителя медицинского изделия 192012, Poccия, г. Санкт-Петербург, ул. Грибакиных, д.25, корп. 3
Юридический адрес организации-производителя медицинского
изделия или организации — изготовителя медицинского изделия 192012, Россия, г. Санкт-Петербург, ул. Грибакиных, д.25, корп. 3
ОКП/ОКПД2 94 4490
Класс потенциального риска применения медицинского изделия
в соответствии с номенклатурной классификацией медицинских
изделий, утверждаемой Министерством здравоохранения
Российской Федерации 1
Назначение медицинского изделия, установленное
производителем (ПУСТО)
Вид медицинского изделия в соответствии с номенклатурной
классификацией медицинских изделий, утверждаемой
Министерством здравоохранения Российской Федерации —
Адрес места производства или изготовления
медицинского изделия ООО «НПФ „НЕВОТОН“, 192012, Санкт-Петербург, ул. Грибакиных, д. 25, корп. 3

USBLexus
09.08.2018 22:47+2но защита потребителя у нас одна из лучших в мире
Наверное поэтому самые продаваемые в РФ «лекарства» это Нурофен и Кагоцел
stamir
10.08.2018 09:23А что не так с Нурофеном (ну кроме цены)? Это же ибупрофен, который входит в World Health Organization's List of Essential Medicines, и т.п. Вроде в его эффективности никто не сомневается…

USBLexus
10.08.2018 19:44В качестве обезбаливающего или противовоспалительного он довольно эффективен, хотя и больно бьет по желудку и немного по сердцу. Вопросы начинаются когда его выписывают и покупают при гриппе и простуде

Porohovnik
09.08.2018 22:54Не скажите, Нурофен бывает разный.Например, то что с приставкой Нео прекрасен, если его принимать при 38-39°он в чуство хорошо приводит(часов на 8, я замерял).А вот насчёт обычного не знаю, не пробовал.

artoym
10.08.2018 09:15В случае с какой-нибудь уткой надо доказывать её гипоаллергенность и безопасность для пациента.
Ага, заплатите кучу денег, прождите пол года, чтобы доказать что горшок из нержавейки не опасен.
Регистрация медизделий занимает долгое время, бюракратизирована донельзя. Мы, например, пытаемся зарегистрировать обычный микроскоп как медизделие, а потому что иначе его нельзя в медлаборатории.

rtakyiv
Статья прикольная, интересно посмотреть как «машина» работает изнутри. Однако местами вы крепко преувеличиваете, непонятно зачем. «Его надо 4 грамма на мышь [её физически разрывает при этом, скорее всего]» В реале ЛД50 (доза при которой гибнет 50% животных — около 20г на кг(!) веса у мышей www.sciencelab.com/msds.php?msdsId=9927239 Так что никого там не разрывает, мышь весит грам 20, вы ошиблись на порядок. «По сравнению с нашими европейские нормы по медицинским изделиям — это просто филькина грамота.» — надеюсь сарказм? Про Европу знаю мало, но, для примера, кто работал с регистрацией для FDA, говорят что это _совсем_ не просто.
elena_pastukhova Автор
Мы очень плотно знакомы с европейской системой, потому что у нас для Европы сертифицирована вся линейка Медиагелей, Унимакс, Унипаста и еще ряд препаратов. Самое главное, что в Европе считают нашу систему достаточно строгой, а потому не просят никаких локальных подтверждений, а только переводы российских документов.
А вообще, основная разница между РФ и Европой в первичном доверии к производителю. Вот смотрите. У нас производитель говорит «хочу производить медизделие», регистрирующие органы отвечают «а докажи, что оно безопасное и эффективное будет» и пока не докажешь с литературой и исследованиями, а они не проверят каждую букву – не только продавать, производить не можешь. На Западе все иначе: производитель говорит «я произвел медизделие, вот документы по безопасности». Регистратор складывает досье в папочку и не трогает его, пока не долбанет. Т.е. у нас проверка проходит до наступления проблем, у них – после. Есть и другие отличия, например, европейские нормы допускают медизделия без указания состава (у нас это просто немыслимо). Все изменения в продукте означают, что ты сам просто добавляешь еще один документ в свое досье.
То есть, резюмируя, и в Европе декларативная система, которая строится на принципе доверия к производителю. В общем, принцип добросовестности – это отлично, конечно, но как мы все понимаем, в частном бизнесе работает далеко не всегда. Тем более, что у них есть понятие «представитель» для случаев, когда сам производитель находится далеко (в Китае, например). Этот представитель является ответственным лицом в случае, если что-то пойдет не так. Но только часто в роли представителя выступает крохотная компания почти без уставного капитала, и взять с нее совсем нечего.
Зато в Европе процесс регистрации занимает всего 2 месяца, что не может нас, как производителя, не радовать.
Kriminalist
Все не совсем так. В Европе medical devices должны проходить оценку соответствия директиве, а не просто принцип добросовестности. И если говорить о продукции Гельтек, то Блефарогель — это явно не medical device, а фармпрепарат со всеми вытекающими. И кстати, Европа полным ходом переходит на новую систему оценки соответствия, где упор как раз на клинические испытания. А что касается уполномоченных представителей — ну так они действуют по доверенности производителя, и несут ответственность наравне.
elena_pastukhova Автор
В Европе мы регистрировали Блефарогель вообще как косметику, внезапно. И с клиническими исследованиями там проблем никаких не было, хотя бы потому, что и по косметике, и по медизделиям Европа признает российские документы.
А вообще, если абстрагироваться от деталей, которых куча, важно, как мне кажется, вот что — в России регистрация, а в Европе — декларация. Второе, как ни крути, проще для производителя.
Kriminalist
Блефарогель косметика, это абсолютно логично. Относительно декларации и регистрации вы правы, разница в этом, но что проще, не так однозначно. Проще запустить, но сложнее поддерживать. Ну и не забываем, что проще только для первого класса безопасности, а оценка с привлечением нотифицированного органа — совсем другая песня.
ebragim
С лекарствами наоборот. Какие бы исследования тут не проводили, если хотите признания в европе — то обязательно GMP на производстве и GLP у клинических центров (а таких в России, на секундочку, всего несколько штук. И стоимость их работы на порядок выше).
Про получение МНН в европе вообще молчу — это около года занимает, с привлечением ВОЗ и подобных организаций.