То, как мы воспринимаем мир, по большей степени зависит от работы наших органов чувств, собирающих сенсорную информацию об окружающей среде. Мнение о том, какие из чувств важнее, часто основано на деятельности человека: повар скажет — вкус, музыкант — слух и т. д. Несмотря на разногласия, все же можно выделить ту сенсорную информацию, без которой жизнь человека может стать намного сложнее. Одной из них является визуальная информация, воспринимаемая зрением, т. е. глазами. Проблема в том, что глаза ввиду различных факторов (заболевания, возрастные изменения, травмы) могут частично или полностью терять свою способность видеть. Одной из самых распространенных причин ухудшения зрения является дегенерация сетчатки, которая сопровождается прогрессирующим ухудшением и потерей функции фоторецепторов. Основной метод борьбы с этим неизлечимым недугом заключается в применении электрической стимуляции выживших нейронов сетчатки с помощью имплантированных в глаз устройств. Также применяется оптогенетическая и соногенетическая терапии. Однако эти методы связаны со сложной операцией по имплантации и рискованной генной терапией. Ученые из университета Южной Калифорнии (США) предложили неинвазивный метод, основанный на ультразвуковой стимуляции. Как работает новая методика и насколько она эффективна? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Как уже было сказано ранее, дегенеративные заболевания сетчатки, вызванные прогрессирующей дегенерацией светочувствительных фоторецепторов, являются одной из основных причин потери зрения и слепоты во всем мире. Однако, несмотря на потерю чувствительности к свету, оставшийся зрительный путь в основном не поврежден и функционирует, что позволяет зрительным протезам выступать в качестве инструментов для восстановления зрения.
Первые микроэлектронные протезы сетчатки появились еще в далеком 1956 году ("Preliminary report on a retinal stimulator"), когда появилась идея восстановить зрение, минуя поврежденные фоторецепторы и напрямую стимулировать внутренние нейроны сетчатки. Технологический прогресс позволил некоторым из этих устройств перекочевать из лабораторий в клиники и помочь многим пациентам.
Но, несмотря на работоспособность данной методики, она все же не лишена проблем и сложностей. Одной из таких является инвазивность, т. е. необходимость в проведении оперативного вмешательства для имплантации устройства, что сопряжено с рисками как во время операции, так и в процессе послеоперационного восстановления. Для решения этих проблем в последнее время было предпринято много усилий, включая исследования в области оптогенетики, датчиков ближнего инфракрасного диапазона, соногенетики и генной терапии. Хотя сообщалось о положительных результатах, все эти методы по-прежнему требуют рискованных инвазивных процедур и комплексной генной инженерии. Как следствие, в данной области терапии до сих пор существует потребность в неинвазивном, безопасном, но вместе с тем эффективном методе восстановления утерянного зрения.
И тут на сцену выходит ультразвук (УЗ). Данная технология не является чем-то новым в медицине, так как уже давно используется и для диагностики, и для лечения различных заболеваний. В 1958 году ученые установили, что ультразвук способен модулировать центральную нервную систему. Несмотря на то, что механизм УЗ-нейромодуляции все еще находится в стадии изучения, были предприняты попытки использовать потенциал УЗ-нейромодуляции для лечения различных заболеваний, связанных с нервами. Работы со зрением также проводились, но они были лишь теоретическими.
Авторы рассматриваемого нами сегодня труда решили на практике применить УЗ-модуляцию, чтобы наглядно определить ее работоспособность и эффективность.
Подготовка к опытам
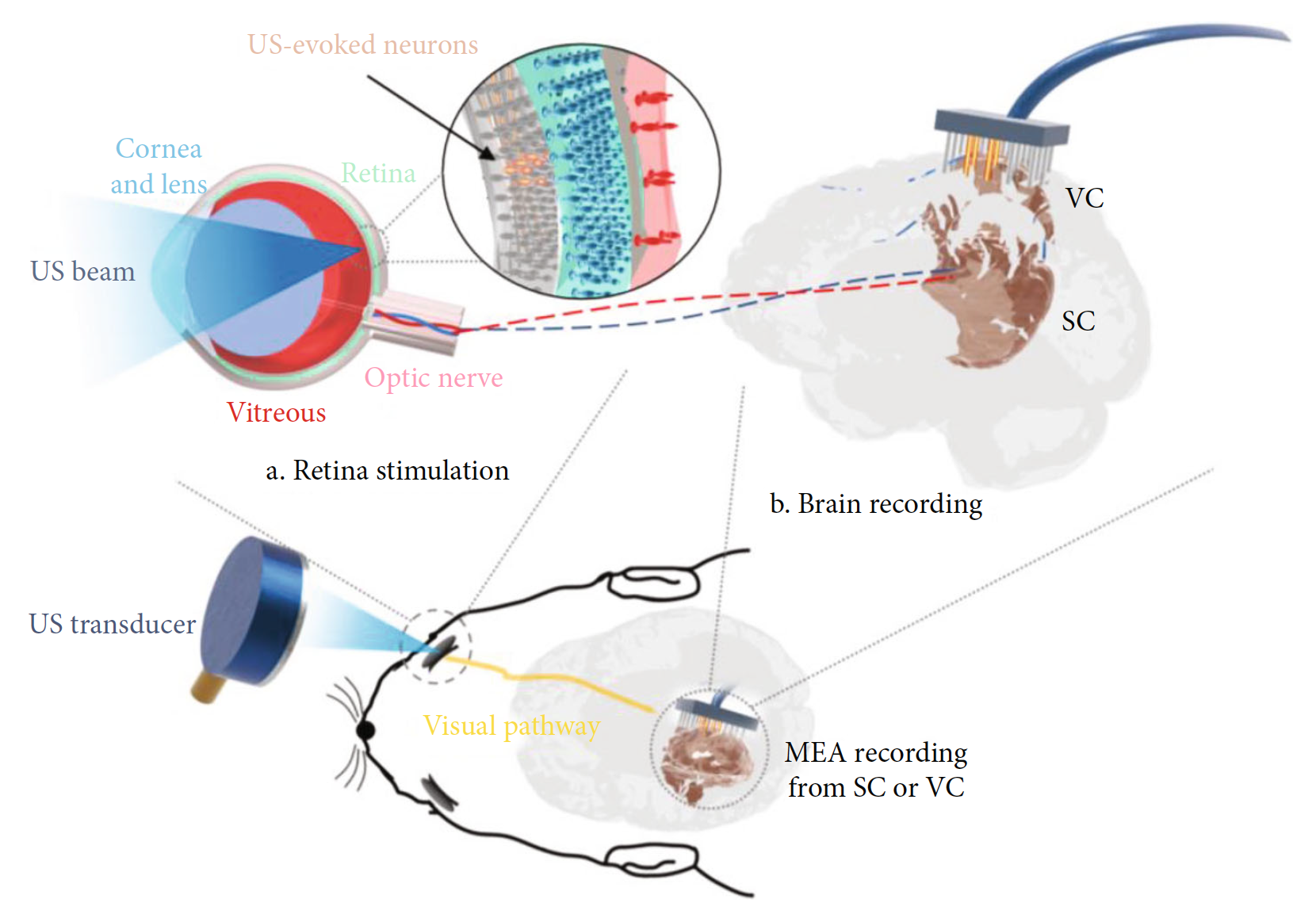
Изображение №1
Выше представлена схема УЗ-стимуляции. Специально изготовленный ультразвуковой преобразователь имел частоту 3.1 МГц и глубину фокуса 10 мм. Характеризация ультразвукового преобразователя была выполнена с использованием калиброванного гидрофона. В частности, полуширина (FWHM от full width at half maximum) луча и глубина резкости (DOF от depth of focus) ультразвукового датчика составляли 590 мкм и 4400 мкм соответственно. Для расчета соответствующего механического индекса (MI от mechanical index) было измерено отрицательное пиковое давление (NPP negative peak pressure) свободного поля в фокальной точке, которое линейно связано с управляющим напряжением ультразвукового датчика.
Для изучения влияния затухания ультразвука и индуцированного ультразвуком изменения температуры, вызванного структурой глаза, были проведены как анализ методом конечных элементов (FEA от finite element analysis), так и практические опыты испытания ex vivo (опыты на живой ткани, но вне организма). FEA анализ предполагал, что структура глаза создавала затухание -2.0 дБ, а вот опыты показали затухание на уровне -3.3 ± 0.4 дБ.
Что касается повышения температуры, вызванного УЗ, то при параметрах 2.83 МПа NPP и продолжительности в 200 мс наблюдалось изменение на 2 °C в моделировании и 1.8 °C в эксперименте.
Роль испытуемых в данном исследовании исполнили лабораторные крысы, которых предварительно проверяли, оценивая их зрение с помощью световой стимуляции. С целью электрофизиологической регистрации зрительных центров контралатеральную область черепа удаляли путем частичной краниотомии. Активность нейронов, вызванную световыми стимулами, регистрировали с помощью 32-канальной электродной решетки (MEA от multichannel electrode array), помещаемой либо на VC (зрительная кора; область V1), либо внутрь поверхностного слоя SC (верхнее двухолмие; глубина ~150 мкм) после удаления вышележащего VC.

Изображение №2
Результаты оценки испытуемых (2a и 2b) продемонстрировали устойчивую зрительную активность при световой стимуляции у крыс с нормальным зрением, в то время как у крыс RCS с дегенерацией сетчатки активности не было.
Для экспериментов по УЗ-стимуляции in vivo ультразвуковой преобразователь, приводимый в действие синусоидальным импульсным сигналом с усилением мощности, помещали перед глазом крысы и соединяли с дегазированным гелем.
Результаты наблюдений
Чтобы выяснить, является ли УЗ-воздействие эффективным методом стимуляции нейронов in vivo, была выполнена запись активности у 10 особей: у 8 крыс — в области SC мозга, и у 2 крыс — в области VC мозга (2b).
В отличие от вызванной светом спайковой активности, которая постоянно появлялась после короткой латентности для большинства каналов регистрации, спайковая активность, вызванная УЗ, наблюдалась лишь в сравнительно небольшом числе каналов. Это связано с тем, что световой стимулятор, использованный в этом исследовании, представлял собой стробоскопическую вспышку, т. е. световая стимуляция способна активировать всю сетчатку, что приводит к ответу нейронов почти со всех записывающих каналов. Напротив, стимулированная УЗ область интереса (ROI от region of interest), определяемая фокальной зоной УЗ датчика, относительно мала (на уровне нескольких сотен микрон).
Как следствие только несколько MEA каналов, которые предположительно соответствовали области сетчатки, стимулируемой УЗ, демонстрировали спайковую активность. Следует отметить, что, несмотря на различия в степени активности нейронов, вызванной УЗ, у всех крыс с нормальным зрением активность нейронов была сравнима с ответами при световой стимуляции.
Вышеописанные результаты четко говорят о том, что у здоровых крыс УЗ может быть использовано в качестве альтернативного метода стимуляции нейронов. Чтобы дополнительно подтвердить преимущество использования УЗ-стимуляции, необходимо было провести аналогичные наблюдения, но уже на слепых крысах с дегенерацией сетчатки.
Основываясь на результатах наблюдений за 16 слепыми крысами (14 крыс — SC и 2 крысы — VC), можно делать вывод, что УЗ способен стимулировать нейроны сетчатки, о чем свидетельствуют нейронные сигналы от SC (2d). Судя по амплитуде и продолжительности нейронного ответа, вызванного УЗ, активность нейронов у слепых крыс была, как правило, ниже, чем у крыс с нормальным зрением.

Изображение №3
Дополнительно ученые проверили влияние двух основных параметров УЗ-стимуляции, а именно интенсивности и продолжительности. Учитывая стандарты FDA (управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США), определяющие безопасный максимум для MI в 1.9 (соответствует NPP 3.35 МПа), ученые использовали напряжение ультразвукового датчика в пределах от 200 мВ (1.29 МПа) до 600 мВ (3.37 МПа) с интервалом в 50 мВ. На 3a показан нейронный ответ при различной интенсивности УЗ-стимуляции. Кроме того, была исследована продолжительность УЗИ от 1 мс до 200 мс (3b). На 3c–3f приведены статистические сравнения различных интенсивностей и продолжительности УЗ при возбуждении активности нейронов.
Количественные оценки активности нейронов характеризовались амплитудой ответа и его продолжительностью. Было замечено, что амплитуда ответа не менялась при продолжительности УЗ-стимуляции в 10 мс и более, но вот продолжительность ответа увеличивалась с увеличением продолжительности УЗ (3d). Амплитуда и продолжительность нейронного ответа увеличивались с увеличением интенсивности УЗ (3e и 3f).
Таким образом, общая акустическая энергия (которая представляет собой комбинацию интенсивности и продолжительности УЗ) определяет порог активации активности нейронов. Также было обнаружено, что слепые крысы имеют более высокий уровень порога стимуляции по сравнению с крысами с нормальным зрением (3g).
На следующем этапе исследования ученые проанализировали пространственно-временное разрешение активности нейронов, вызванной УЗ-стимуляцией, в области SC.

Изображение №4
Что касается пространственного разрешения, ученые реконструировали распределение нейронных ответов, вызванных УЗ, по поверхности SC на основе амплитуды ответа без изменения положения УЗ-датчика (4b). Затем они вручную изменили положение ультразвукового датчика, используя 5-осевой прецизионный столик, чтобы проверить способность активировать различные области SC путем смещения фокуса ультразвукового луча. На 4c показано, что в SC наблюдалась картина ответа в виде буквы «U». Это указывает на то, что ROI (область интереса) сетчатки, стимулированная УЗ, активировала соответствующую область SC. Активированные области SC варьировались в зависимости от пространственного разрешения в пределах от 161 мкм до 299 мкм. Такое изменение пространственного разрешения может быть связано с искривлением сетчатки. Несмотря на эти вариации, исследуемая система УЗ-стимуляции по-прежнему достигала хорошего пространственного разрешения на среднем уровне 250 мкм.
Временное разрешение УЗ-стимуляции (а именно, частота кадров), которое было определено как минимальный интервал кадров, способный вызывать стабильную активность нейронов, является еще одним важным фактором, который может влиять на функциональность потенциального устройства (зрительного протеза). Этот фактор может определить, способен ли зрительный протез обеспечить плавное видение динамических объектов или нет.
В рамках данного исследования ученые провели последовательную 20-секундную УЗ-стимуляцию с различной частотой кадров при определенных настройках параметров УЗ (продолжительность 10 мс и NPP 2.83 МПа).
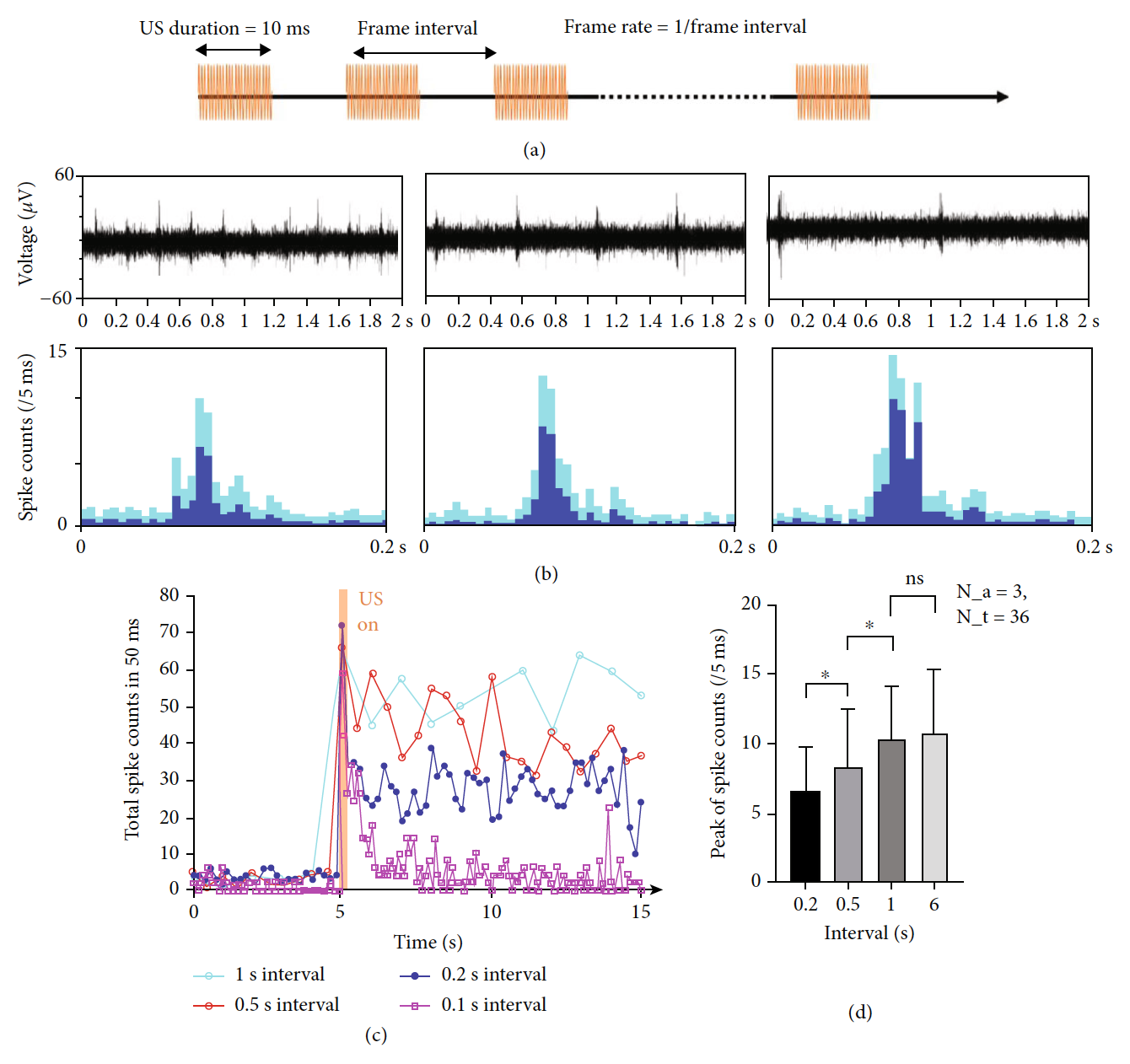
Изображение №5
На 5b показаны репрезентативные 2-секундные сигналы, которые были случайным образом вырезаны из 20-секундных необработанных данных. Анализ данных показал, что стабильная активность нейронов достигалась при частоте кадров до 5 Гц, в то время как более высокая частота кадров (т. е. 10 Гц) потенциально могла подавлять возбуждающие нейроны за короткое время (желтая линия на 5c).
Чтобы подтвердить, что такое подавление при более высокой частоте кадров было вызвано насыщением нейронов, а не повреждением нейронов, было проведено дополнительное исследование стимуляции при более низкой частоте кадров в той же области интереса прямо в конце предыдущей стимуляции с высокой частотой кадров. В результате снова наблюдались аналогичные уровни ответов нейронов (амплитуда и продолжительность), что указывает на безопасность УЗ-стимуляции с высокой частотой кадров.
Далее ученые создали новый спиральный преобразователь (в отличие от ранее использованного в наблюдениях сферически сфокусированного), чтобы генерировать специфическую диаграмму направленности в виде буквы «С» (6а).

Изображение №6
В отличие от ранее использовавшегося 32-канального MEA с интервалом 150 мкм для точного расчета пространственного разрешения вызванной УЗ активности нейронов, в этом варианте был использован 56-канальный MEA с интервалом 350 мкм (6b). Так можно было охватить всю область SC для лучшей визуализации формы «С». Наблюдаемая картина нейронной активности, вызванной УЗ-стимуляцией (6d), указывала на то, что статическая УЗ-стимуляция способна создавать такую же картину активности нейронов в SC.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
В рассмотренном нами сегодня труде ученые решили детально изучить свойства ультразвуковой стимуляции в рамках восстановления утраченного или поврежденного зрения. Подобная концепция существует уже много лет, но до этого момента не было никаких практических доказательств того, что УЗ-стимуляция может быть не только работоспособной, но и эффективной.
Опыты на слепых крысах показали, что ультразвук действительно вызывает повышение активности нейронов в области мозга, отвечающей за обработку визуальной информации. Следовательно, УЗ-стимуляция работает.
Ученые отмечают, что подобного рода методы лечения превосходят классические ввиду отсутствия необходимости в проведении сложных и рискованных операций или генной терапии.
На данный момент авторы исследования смогли лишь подтвердить возможности концепции УЗ-стимуляции. Однако для реализации полноценного ультразвукового зрительного протеза необходимо провести еще немало опытов и расчетов. В частности ученые намерены в будущем задействовать в своих наблюдениях приматов, а потом, если все будет идти по плану, и людей.
Наш мир, несмотря на все его недостатки, полнится множеством прекрасных, удивительных и непередаваемых словами вещей. Будь то архитектура, живопись или кинематограф, любой человек имеет право это увидеть и самостоятельно решить, нравится оно ему или нет. Конечно, различные недуги могут отобрать у него это право, но в руках научного сообщества есть сила, способная его вернуть.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?

iShrimp
Новый, неинвазивный метод стимуляции сетчатки - это хорошо. Не всем больным возможно имплантировать стимулятор хирургическим путём, например такой как Argus II.
Но проблема в том, что большинство случаев слепоты вызвано атрофией сетчатки (возрастная макулярная дегенерация) или зрительного нерва (глаукома), когда стимулировать уже нечего. Поэтому надо также развивать нейроинтерфейсы, которые предназначены для доставки информации прямо в мозг в обход поражённого глаза.
Dimsml
Компания которая делала эти устройства обанкротилась. Теперь вся надежда на генотерапию вроде Luxturna.
https://spectrum.ieee.org/bionic-eye-obsolete
iShrimp
Генотерапия имеет очень узкую нишу - она может исправить один конкретный дефект (в пока ещё живой клетке). Полностью восстановить погибший участок сетчатки или зрительного нерва пока ещё не реально.