
Одним из самых распространенных материалов, используемых практически в любой сфере деятельности человека, является пластик. Тот факт, что этот материал пагубно влияет на окружающую среду также не является секретом. В последние годы ученые обратили внимание на микропластик, накопление которого связано с химической природой пластиковых полимеров на основе нефти, которые обычно не поддаются биологической переработке. Замена пластика на более экологичный материал хоть и звучит логично, однако подобное решение является крайне невыгодным и тяжело реализуемым. Следовательно, дабы снизить пагубное влияние пластика на окружающую среду, необходимо создать пластик, который будет разлагаться, попадая в природную среду (например, в воду). Ученые из Калифорнийского университета в Сан-Диего (США) разработали частицы микропластика из биоразлагаемого термопластичного полиуретана (TPU-FC1), которые крайне быстро поддаются биоразложению. Что входит в состав нового экологичного пластика, каковы его характеристики, и может ли он стать альтернативой обычному пластику? Ответы на эти вопросы мы найдем в докладе ученых.
Основа исследования
Одним из основных последствий повсеместного использования людьми пластика является образование микропластика: крошечных пластиковых частиц, которые сохраняются в окружающей среде и, как теперь известно, распространяются по всем частям планеты. Размер частиц микропластика варьируется в пределах от 5 мм до 500 мкм. Источником микропластика могут быть пластиковые бутылки, шины, пакеты, синтетический текстиль и т. д. Микропластики обычно образуются в результате различных процессов, таких как физическая или химическая фрагментация, истирание, производственные процессы, разрушение под воздействием ультрафиолета и т. д. В настоящее время документально подтверждено, что микропластик накапливается во всех физических средах, таких как водоемы, почва, осадки и даже рассеивается в воздухе. Из-за своего повсеместного распространения микропластик в настоящее время является частью пищевой цепи, и собранные данные свидетельствуют о том, что эти материалы могут нанести значительный вред экосистемам, животным и людям.
Потенциальным решением для смягчения воздействия микропластика на окружающую среду является разработка пластиков, которые не образуют стойких микрочастиц. Ведь даже при правильной сортировке и переработке пластиковых отходов микрочастицы все равно попадают в окружающую среду еще на этапе использования того или иного пластикового предмета. Таким образом, чтобы предотвратить накопление микропластика, необходимо разработать новые пластиковые материалы, которые полностью биоразлагаемы, чтобы любые частицы, образующиеся из этих продуктов, быстро разлагались в окружающей среде.
Биодеградация (или биоразложение) — это процесс, при котором микробы расщепляют полимеры на более простые молекулы, которые можно использовать в качестве источника углерода для производства биомассы. Для этого необходимо, чтобы полимер содержал химические связи, особенно в основной структуре полимера, которые физически доступны для ферментов, которые естественным образом распознают эти связи в качестве субстратов, и чтобы лежащие в основе молекулы мономера, высвобождаемые в результате этого ферментативного расщепления, могли потребляться микроорганизмами.
В естественной среде этот процесс обычно выполняется консорциумами микробов, в том числе бактерий и грибов, секретирующих гидролитические ферменты, которые расщепляют полимер с высвобождением различных мономеров и олигомеров, которые затем могут быть использованы микробами в качестве источника углеродных питательных веществ. Катаболизм этих полимерных олигомеров и мономеров приводит к образованию биомассы организма и CO2 посредством дыхания. Многие материалы, изготовленные на основе биологических соединений, все равно высвобождают микрочастицы, невосприимчивые к биоразложению из-за химической обработки, как это происходит при вулканизации каучука.
Полиуретаны — это класс полимеров, которые широко используются в различных продуктах. Полиуретаны обладают многими полезными свойствами в зависимости от их состава, например, легкостью, прочностью и гибкостью. Полиуретановый полимер состоит из повторяющихся звеньев полиолов и изоцианатов. Уретановая связь, также известная как карбаматная связь, образуется, когда спирт в полиоле реагирует с изоцианатной группой. Карбаматы встречаются и метаболизируются в природе, в том числе в гемоглобине и RuBisCo, и, следовательно, подходят для производства биоразлагаемых полимеров. Полиолы могут быть составлены различными способами, которые влияют на их способность к биоразложению. Например, полиэфирполиолы образуются в результате реакционной конденсации двухосновных кислот и диолов с образованием сложноэфирных связей. Полимеры, содержащие сложноэфирные связи, обладают способностью к биоразложению из-за подверженности сложноэфирных связей гидролизу, который может происходить по абиотическим механизмам или ферментативным путем в результате эволюции различных эстераз в ответ на повсеместное распространение сложноэфирных связей, встречающихся в природе.
Напротив, полиэфирполиолы, чаще всего получаемые из нефти, широко используются в современной промышленности пластмасс, поскольку эфирные связи в полимере не подвержены биоразложению. Таким образом, полиэфирные полиуретаны, полученные из полиэфирполиолов, также могут быть источником микропластического загрязнения, когда они распадаются на мелкие частицы в результате процессов фрагментации. Однако полиэфир-полиуретановый полимер, содержащий сложноэфирные и уретановые связи, обладает потенциалом для быстрого и полного биоразложения, когда на полимере действует гидролитическая ферментативная активность.
Процесс и скорость биоразложения зависят как от химических и физических свойств полимера, так и от условий окружающей среды, которым подвергается полимер, поэтому биоразложение или абиотический гидролиз могут происходить только при определенных условиях. Например, полимолочная кислота (PLA от polylactic acid) имеет сложноэфирные связи, которые подвержены гидролизу при повышенных температурах, присутствующих на промышленных предприятиях по производству композитов, но не в морской среде. Ученые пришли к выводу, что микропластик, полученный из экологически биоразлагаемых полиэфирных полиуретанов, может быстро разлагаться в окружающей среде.

Изображение №1
Чтобы проверить эту гипотезу, ученые физически измельчили термопластичный полиуретан на биологической основе (TPU-FC1) для образования микропластика и использовали несколько методов для подтверждения быстрого биоразложения и исчезновения этого микропластика в условиях домашнего компостирования (схема выше).
Экстракция и количественный анализ частиц микропластика показали, что частицы TPU-FC1 полностью разложились в течение 200 дней, в то время как аналогичные частицы, полученные из небиоразлагаемого полимера, этилвинилацетата (EVA от ethyl vinyl acetate), не показали уменьшения количества частиц за тот же период времени. Отслеживание производства CO2 с помощью респирометрии в идентичных условиях компостирования дополнительно подтвердило биоразложение и минерализацию частиц TPU-FC1.
Чтобы идентифицировать организмы, ответственные за это биоразложение, было проведено микробное обогащение с использованием TPU-FC1 в качестве единственного источника углерода и энергии. В результате был выделен бактериальный штамм, принадлежащий к роду Rhodococcus, который быстро растет только на TPU-FC1.
Подготовка к исследованию
Материал этиленвинилацетата (EVA от ethylene vinyl acetate) был приобретен в виде твердых листов размером 12 × 12 × 0.375 дюйма. Материалы из термопластичного полиуретана (TPU от thermoplastic polyurethane) были приготовлены путем реакции линейного алифатического полиэфирного полиола, состоящего исключительно из алифатического диола биологического происхождения и двух алифатических двухкислот биологического происхождения, либо с линейным алифатическим диизоцианатом (TPU-FC1), либо с ароматическим диизоцианатом (чехол для смартфона). Микропластик из различных материалов был получен путем шлифования наждачной бумагой с зернистостью 80. Чтобы предотвратить перекрестное загрязнение различных материалов, для каждого материала использовались разные шлифовальные ленты. Материалы неоднократно погружались в жидкий азот, чтобы минимизировать нагрев и плавление во время процедуры измельчения. Отшлифованный микропластик дополнительно отбирался по размеру с использованием набора сит, а микропластик размером менее 5 мм и более 350 мкм оставлялся для дальнейших экспериментов.
Биодеградацию TPU микропластика проводили в контролируемых условиях компостирования, отслеживая выделение CO2. Целлюлоза служила положительным контролем, образцы этилен-винилацетата (EVA) и только компоста служили отрицательным и чистым (пустым) контролем соответственно. Эксперимент был остановлен через 200 дней инкубации, когда для большинства образцов было достигнуто плато минерализации. В камерах для образцов поддерживалась температура 45 °C и относительная влажность ~ 58% на протяжении всего эксперимента. Камеры для проб открывали раз в две недели для смешивания компоста и добавления воды по мере необходимости. Процент биоразложения, а также биоразложение по отношению к целлюлозе рассчитывались по формуле:

Образцы компоста, предназначенные для извлечения микропластика, сначала сушили в открытых стеклянных емкостях в сушильном шкафу при температуре 70 °C в течение не менее 24 часов перед экстракцией. 0.5 грамма высушенного образца компоста обрабатывали ультразвуком (50% амплитуда, 2 × 30 с) в дистиллированной воде и полученную суспензию пропускали через несколько металлических сит. Оставшиеся на сетчатых фильтрах 0.5 и 0.35 мм твердые вещества переносили в делительную воронку с использованием насыщенного раствора CaCl2 (плотность = 1.55 г/см3). После перемешивания твердым веществам давали возможность разделиться в зависимости от плотности в течение 2 часов при комнатной температуре. Примерно 75% нижней фазы слили, а оставшийся верхний слой, содержащий микропластик, отфильтровали под вакуумом. Фильтр, содержащий микропластик, переносили в стеклянную чашку Петри с 30 мл красящего раствора Nile Red и осторожно перемешивали в течение 15 минут. Окрашенные частицы затем фильтровали в вакууме на фильтре GF/A, освещали трансиллюминатором с синим светодиодом и фотографировали цифровой камерой Canon. Флуоресцентные частицы микропластика на фильтрах были количественно определены с помощью ImageJ.
Минимальной средой для обогащения и роста различных штаммов на TPU-FC1 была среда Бруннера 457. Для выделения различных штаммов в качестве богатой среды использовали среду LB (от Luria–Bertani) или R2A (от Reasoner’s 2A). Для твердых сред к соответствующим жидким средам добавляли 15 г/л агара. TPU материалы были отшлифованы и просеяны в мелкий порошок (размер частиц < 5 мм и > 350 мкм) и подвергнуты сухому автоклавированию в колбах из боросиликатного стекла для всех экспериментов по выращиванию микробов. Рост микробов определяли количественно по OD600 с использованием спектрофотометра.
Образцы компоста (~0.5 г) объединяли с 5 мл стерильного PBS и смешивали в течение 1 часа при комнатной температуре. Аликвоту этой суспензии инокулировали в 50 мл минимальной среды Бруннера, содержащей измельченный 1% TPU-FC1 в качестве единственного источника углерода и энергии. Культуры поддерживали при комнатной температуре (~ 22 °C) при встряхивании. Обогатительные культуры пассировали один раз в неделю путем 100-кратных разведений в свежей среде, содержащей TPU-FC1. Данную процедуру пассирования повторяли 5 раз. После пятого раза аликвоты культуры разбавляли и высевали на твердую среду LB или R2A, а планшеты инкубировали при комнатной температуре. Колонии, представляющие интерес, трижды пересевали для очистки штамма и впоследствии выращивали в среде LB или R2A по мере необходимости. Изолированные штаммы повторно проверяли на их способность катаболизировать TPU-FC1 в качестве единственного источника углерода и энергии в минимальной среде.
Представляющие интерес штаммы выращивали в жидкости R2A или LB по мере необходимости, а геномную ДНК экстрагировали. Для филогенетической идентификации штамма ген 16S рРНК амплифицировали с помощью ПЦР из очищенной геномной ДНК с использованием универсального набора прокариотических праймеров с использованием полимеразы Q5. Продукты ПЦР очищали с использованием набора для очистки Promega SV Gel PCR и отправляли в лаборатории Primordium для секвенирования ДНК.
Представляющие интерес изоляты выращивали с использованием TPU-FC1 в качестве единственного источника углерода, как описано выше. В указанные моменты времени 1 мл культуры удаляли и центрифугировали для удаления растущих клеток. Бесклеточный супернатант фильтровали через фильтр 0.2 мкм (PES) и хранили при -20 °C до дальнейшего анализа. Образцы быстро вакуумировали при температуре 45 °C в течение 200 минут для испарения среды. Затем добавляли 5 мкл 1 М NaOH и 50 мкл внутреннего стандарта (1 мкл/мл диэтилсукцината в этилацетате). Образцы трижды экстрагировали 100 мкл этилацетата, который затем продували газообразным азотом. К каждому образцу добавляли 50 мкл этилацетата, 2 мкл воды MilliQ и 20 мкл хлороформа. 25 мкл силилировали 25 мкл N-метил-N-триметилсилилтрифторацетамида (MSTFA) и реагировали в течение 20 минут. Пробы анализировались с помощью анализатора 7820A GC/5975 MS. Образцы вводили со скоростью 2 мл/мин в соотношении 10:1. Температура на входе составляла 250 °С. Печь находилась при температуре 50 °С в течение 5.35 минуты, затем температура повышалась до 120 °С со скоростью 10 °С/мин, затем повышалась до 280 °С со скоростью 50 °С/мин и выдерживалась в течение 10 минут.
Образцы, представляющие интерес, были зафиксированы для визуализации с использованием протокола фиксации формальдегидом. Образцы погружали в фосфатный буфер, содержащий 4% формалина, и инкубировали в течение 2 часов при комнатной температуре для фиксации. Фиксирующий раствор удаляли, образцы один раз промывали равным объемом фосфатного буфера, а затем последовательно подвергали воздействию градиента этанола (50, 65, 80, 95%) для обезвоживания образцов. Затем образцы сушили и прикрепляли к алюминиевым заглушкам с помощью углеродной ленты, после чего использовали распылитель для нанесения слоя иридия, а излишки покрытия удаляли сжатым воздухом перед визуализацией. Все образцы были визуализированы в высоком вакууме с использованием сканирующего электронного микроскопа при увеличении в диапазоне от 100× до 8000× и визуально проверены на предмет структурных модификаций и наличия микробных биопленок.
Результаты исследования
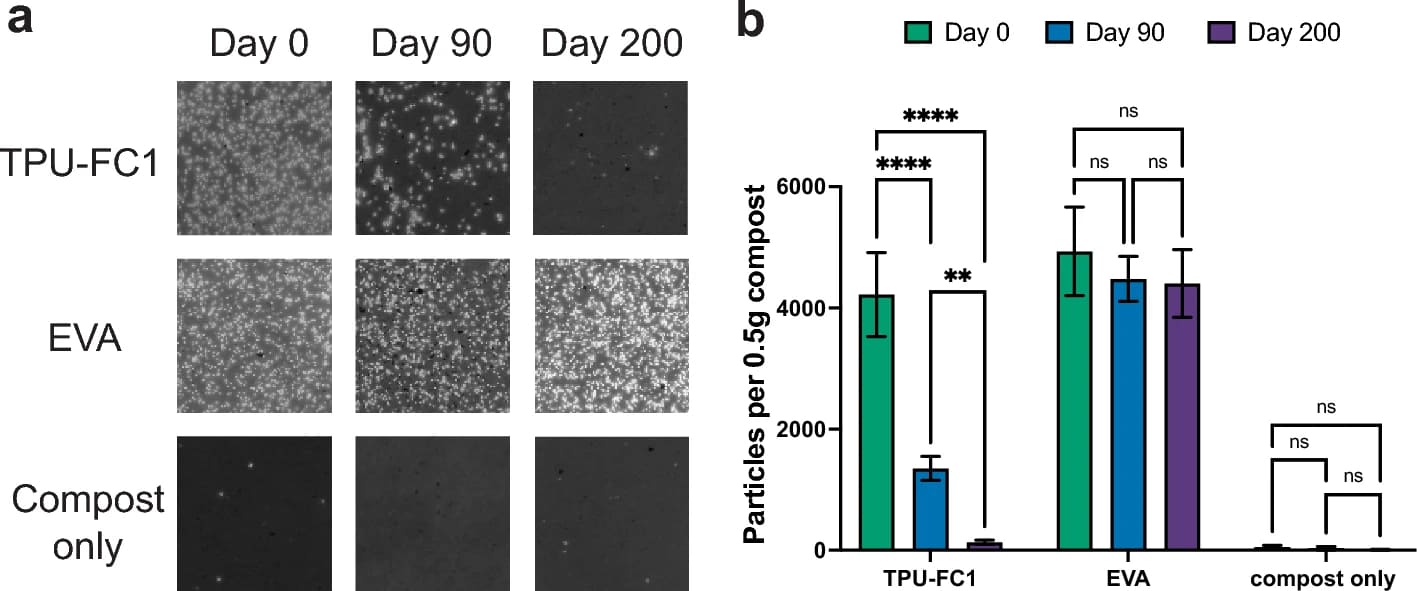
Изображение №2
Частицы микропластика, полученные из полиэфирного термопластичного полиуретана (TPU-FC1) биологического происхождения и термопластичного этилвинилацетата (EVA) на основе нефти, смешивали со свежесобранным компостом в определенном массовом соотношении 1:12 и инкубировали в стеклянных чашках Петри при 45 °С. Образцы компоста, содержащие микропластик, удаляли через 0, 90 и 200 дней, и проводили процедуру экстракции на основе дифференциальной плотности для отделения частиц микропластика от компоста. Частицы микропластика, визуализированные с помощью флуоресцентного окрашивания, были в большом количестве в момент нулевого дня в обоих образцах, содержащих пластик, тогда как в контрольной группе, как и ожидалось, наблюдалось небольшое количество частиц (изображение выше). Исследование образцов после 90 дней аэробного компостирования показало снижение количества частиц TPU-FC1 на 68%: с 4221 ± 694.7 до 1352 ± 195.9 частиц на полграмма компоста (2b). Напротив, количество частиц EVA, оставшихся через 90 дней, существенно не отличалось от исходного. После 200 дней аэробного компостирования количество частиц микропластика в образце TPU-FC1 упало до 135 ± 34 частиц на полграмма компоста, что на 97% меньше исходного значения. Напротив, количество частиц микропластика EVA, небиоразлагаемого полимера, оставалось неизменным через 200 дней (2b).
Снижение количества частиц микропластика TPU-FC1 указывает на биоразложение и на то, что микропластик, образующийся из этого материала, является временным и непостоянным. А вот картина разложения микропластика EVA показала, что он является чрезвычайно стойким, т. е. не поддающимся биоразложению.

Изображение №3
Чтобы проверить биоразложение этих материалов в виде частиц микропластика и их прогнозируемое состояние из-за полной минерализации, параллельный набор образцов с идентичным набором микропластика и компоста был инкубирован при 45 °C в камерах для респирометрии, предназначенных для отслеживания выделения CO2 в аэробных условиях. Дополнительные образцы только компоста и целлюлозы были также включены в качестве внутреннего контроля для мониторинга фонового выделения CO2 и биологической активности компоста на контрольном субстрате соответственно.
Как показано на графике выше, положительный контроль с целлюлозой достиг 75% выделения CO2 в течение 45 дней. Это указывает на то, что инокулят компоста был достаточно активным. Как и ожидалось для небиоразлагаемого материала, частицы микропластика EVA не показали выделения CO2 в течение 200-дневного эксперимента. Вместо этого были рассчитаны отрицательные значения биоразложения как следствие вычитания выделения CO2 из чистого компоста, что указывает на то, что EVA либо поглощает CO2 из метаболически активного компоста, либо микропластики EVA убивают метаболическую активность микробиома компоста.
В точном соответствии с данными экстракции и визуализации по подсчету частиц, TPU-FC1 микропластик на биологической основе продемонстрировал значительную биоразлагаемость, достигнув 76% выделения CO2 за 200-дневный период времени. Таким образом, респирометрия подтверждает биоразлагаемость материала TPU-FC1 на биологической основе и демонстрирует, что одним из результатов этого биоразложения является преобразование углерода из микропластика в CO2.
Далее было проведено микробиологическое обогащение образцов TPU-FC1 для идентификации видов микроорганизмов, способных разлагать TPU-FC1, и идентификации промежуточных продуктов деполимеризации. Минимальную среду, содержащую измельченный TPU-FC1 в качестве единственного источника углерода, инокулировали образцами компоста, который проявлял выраженную биоразлагаемую активность. Культуры разбавляли в 100 раз каждую неделю в течение пяти недель и разведения высевали на чашки с твердым агаром LB или R2A. Колонии отбирали на основе уникальных морфологических характеристик и многократно пересевали для клональной изоляции. Изоляты чистых культур, полученные через 5 недель, были проверены на их способность использовать TPU-FC1 в качестве единственного источника углерода для роста.
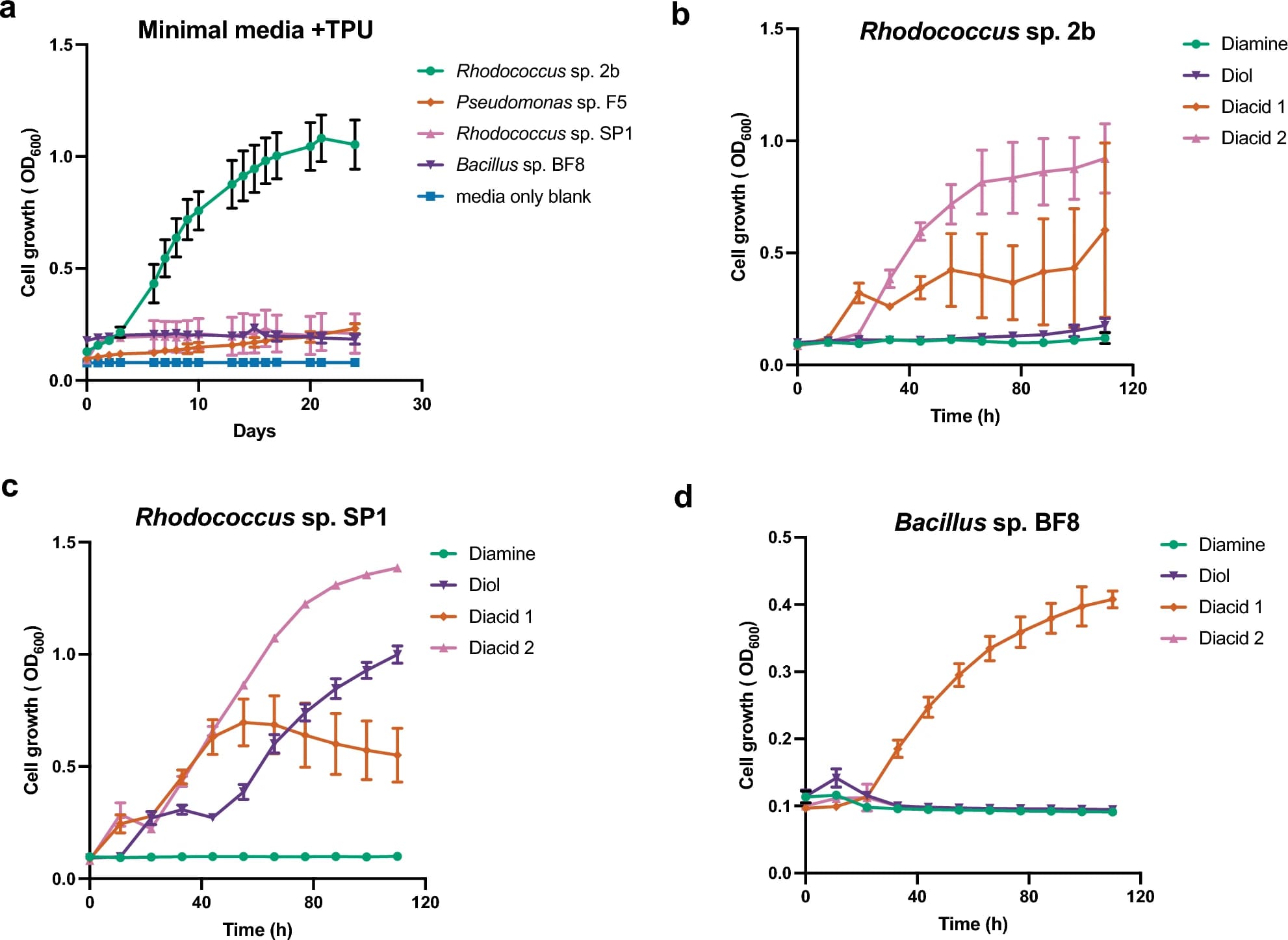
Изображение №4
В ходе этой серии экспериментов по обогащению были выделены два новых штамма бактерий, способных использовать TPU-FC1 в качестве единственного источника углерода (4a). Штамм с лучшими показателями, обозначенный как 2b, был идентифицирован как представитель рода Rhodococcus на основании последовательности 16S рРНК. Другой штамм (BF8) был идентифицирован как представитель рода Bacillus. Еще два штамма (Rhodococcus sp. SP1 и Pseudomonas sp. F5) также продемонстрировал некоторую способность катаболизировать TPU-FC1 в экспериментальных условиях (4a).
Ранее было показано, что бактерии, принадлежащие к родам Rhodococcus, Pseudomonas и Bacillus, участвуют в разложении полиуретана. Их относительное повсеместное распространение в почве и других наземных средах с высокой активностью биоразложения убедительно свидетельствует о том, что TPU-FC1 с высокой долей вероятности будет биоразлагаться в других средах, помимо компоста.
Основываясь на мономерном составе TPU-FC1, полученном из двух двухосновных кислот, одного диола и линейного алифатического диизоцианата, который будет высвобождаться в виде диамина в процессе биодеградации, эти изолированные штаммы были проанализированы на их способность использовать каждый мономерный компонент в качестве единственного источника углерода в минимальных средах.
Рост с использованием любой из двухосновных кислот TPU-FC1 в качестве единственного источника углерода был относительно устойчивым для всех трех штаммов. Хотя Rhodococcus sp. 2b хорошо рос на TPU-FC1 в качестве единственного источника углерода, он рос относительно скромно и с высокой вариабельностью на различных мономерах, за исключением двухосновной кислоты 2 (4b). Напротив, хотя рост Rhodococcus sp. SP1 на полимере TPU-FC1 был относительно скромным (4a), рост как на двухкислотных, так и на диольных компонентах был более устойчивым по сравнению с другими штаммами (4c).
Эти наблюдения показывают, что некоторые штаммы более способны расщеплять TPU-FC1 на мономеры, в то время как другие более приспособлены к улавливанию высвободившихся мономеров. Это подтверждает идею о том, что сообщество организмов, а не отдельный организм, обеспечивает эффективное биоразложение в естественной среде.
Учитывая активный рост Rhodococcus sp. 2b, используя TPU-FC1 в качестве единственного источника углерода, был проведен дальнейший анализ культуральных супернатантов для идентификации промежуточных продуктов деполимеризации. Культуральные супернатанты, взятые после 5 дней роста, не показали присутствия каких-либо прогнозируемых мономеров, в отличие от обнаруживаемого присутствия мономеров в бесклеточном контрольном образце минимальной среды с TPU-FC1. Это указывало на то, что родококки эффективно потребляют высвободившиеся мономеры и что для захвата промежуточных продуктов деполимеризации требуется более ранний момент времени.
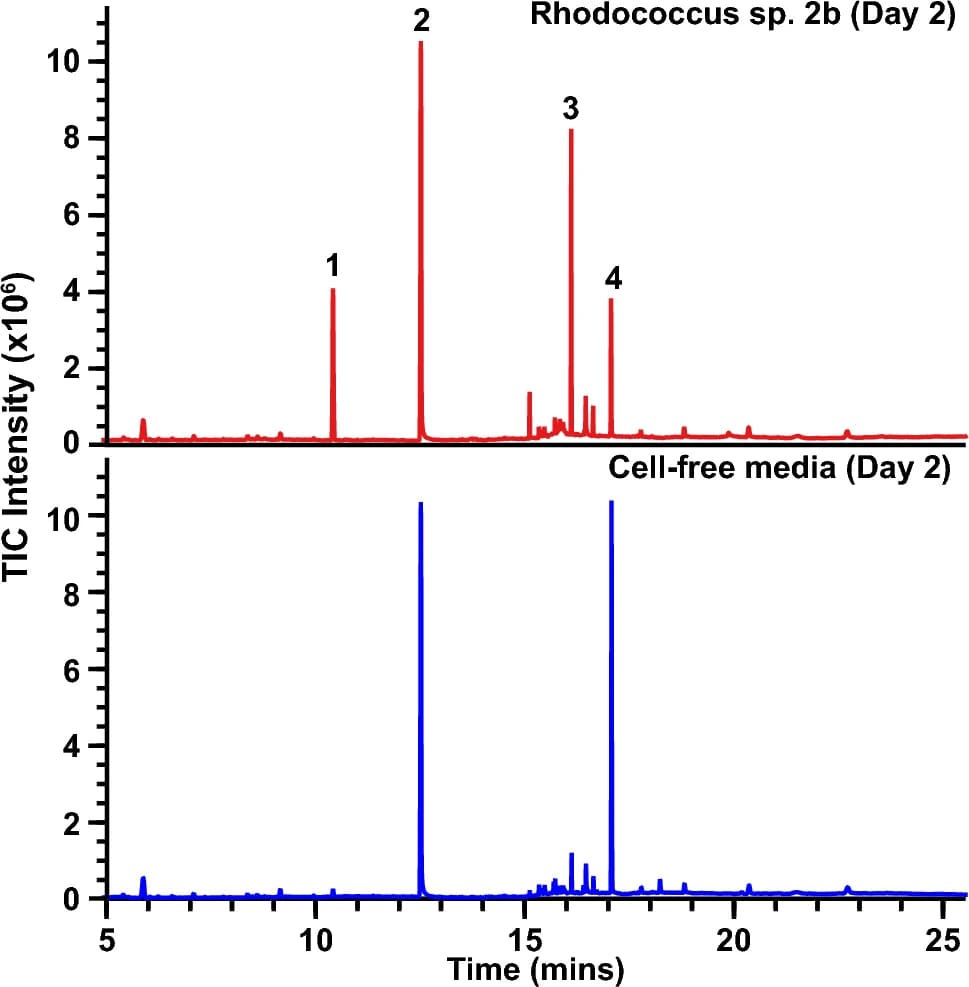
Изображение №5
GC–MS анализ супернатантов Rhodococcus sp. 2b, взятых всего лишь через два дня роста на TPU-FC1 в качестве единственного источника углерода, показал значительное накопление мономера диола (пик 1) и олигомера TPU (пик 3) в культуральном супернатанте, ни один из которых не присутствовал в клеточных культурах контрольной группы (графики выше).
Эти результаты согласуются с деполимеризацией полимера TPU-FC1 и ферментативным расщеплением уретановых и/или сложноэфирных связей, обнаруженных в нем. В то время как недавно выделенный Rhodococcus sp. 2b не способен полностью катаболизировать весь набор мономеров, полученных из этого полимера в качестве единственного источника углерода, ожидается, что другие члены данного микробного сообщества в окружающей среде могут катаболизировать оставшиеся мономерные и/или олигомерные компоненты. Интересно, что TPU олигомер, обнаруженный в супернатанте культуры через два дня, больше не обнаруживался в более поздние моменты времени, особенно при более высоких плотностях клеток.
Учитывая вывод о том, что TPU-FC1 на биологической основе полностью биоразлагаем, ученые изучили возможные применения этого материала и исследовали, происходит ли биоразложение этих продуктов аналогично образующемуся микропластику. Чтобы проверить биоразложение этих TPU в реальных условиях, ученые создали хлопчатобумажные ткани с TPUFC покрытием и отлитый под давлением чехол для телефона, используя аналогичную рецептуру TPU, в которой используется тот же полиол, но ароматический изоцианат вместо алифатического изоцианата TPU-FC1. Полученные образцы инкубировали в компосте в тех же условиях, что и при анализе микропластика, описанном выше.
Спустя время деградация этих образцов была очевидна в макромасштабе по сравнению с контрольной группой, где не использовался компост. Ткани с TPUFC покрытием быстро разлагались, оставляя после себя ткань, которая легко фрагментировалась при извлечении из компоста всего через две недели пребывания в нем. Напротив, ткани с TPU покрытием из контрольной группы, которые не подвергались компостированию, остались неповрежденными и устойчивыми к разрывам. После года инкубации в компосте чехол телефона, отлитый под давлением, стал хрупким и показал признаки обесцвечивания, развития биопленки, растрескивания и структурной деградации по сравнению с чехлом телефона до инкубации в компосте.

Изображение №6
Сканирующая электронная микроскопия дополнительно подтвердила биоразложение и общие структурные изменения в исследуемых образцах. В то время как ткани с TPU покрытием из контрольной группы, которые не подвергались компостированию, демонстрируют наличие TPU покрытия, маскирующего основной волокнистый хлопковый материал (6c), ткани с TPU покрытием, подвергавшиеся компостированию в течение двух недель, показали явную потерю TPU покрытия, оголяя лежащий в основе тканевый материал (6a). Оставшееся покрытие также демонстрировало значительное растрескивание и деградацию, а также накопление микробных биопленок (6b).
Аналогичные результаты были отмечены для чехла телефона, демонстрирующий признаки структурной деградации (6d) после 12 месяцев пребывания в компосте, которых не было на поверхности материала до инкубации в компосте(6f). Как и в случае с тканями, на поверхности наблюдались микробные биопленки (6e).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые показали, что частицы микропластика из термопластичного полиуретана биологического происхождения могут быстро разлагаться в окружающей среде. Напротив, частицы микропластика из широко используемого коммерческого термопластика (этилвинилацетата) сохраняются в окружающей среде крайне долго.
Вредоносное влияние пластика на окружающую среду уже не является секретом. Но лишь недавно ученые начали уделять внимание микроскопическим частицам пластика, которые могут находиться практически везде, от морей и океанов до почвы и атмосферы.
Несколько лет назад ученые создали полимер на основе водорослей. И до сего момента они пытались сделать его полностью биоразлагаемым. В ходе данного исследования ученые измельчили этот материал и проверили, какие микроорганизмы и как влияют на его разложение.
Во время респирометрии в качестве контрольной группы использовались показатели выделения CO2 целлюлозой, так как это считается «золотым стандартом» 100% биоразлагаемости для промышленности. Исследуемый полимер растительного происхождения соответствовал целлюлозе почти на сто процентов.
На следующем этапе опытов была применена водная флотация. Поскольку пластик не растворяется в воде, его частички будут всплывать на поверхность. Спустя 90 и 200 дней наблюдений за обычным пластиком было видно, что он совершенно не подвергся биологическому разложению. С биологическим пластиком картина была намного лучше: спустя 90 дней наблюдалось около 32% микропластика, а спустя 200 дней — только 3%. Это говорит о том, что фактически 97% пластика разлагалось.
Последнее измерение включало химический анализ с помощью газовой хроматографии/масс-спектрометрии (GCMS), который обнаружил присутствие мономеров, используемых для изготовления пластика, что указывает на то, что полимер расщепляется до исходных растительных материалов. Сканирующая электронная микроскопия также показала, как микроорганизмы колонизируют биоразлагаемый микропластик во время компостирования.
Как отмечают авторы исследования, создать в лабораторных условиях новый экологичный пластик — это лишь часть решения проблемы загрязнений окружающей среды. Второй составляющей является возможность использовать уже имеющиеся производственные мощности для изготовления эко-пластика. Ученые преуспели и в этом начинании, установив партнерские отношения с различными компаниями по производству пищевых упаковок, тканей и чехлов для смартфонов. Ученые убеждены в том, что их творение может иметь существенное положительное влияние на экологическую картину мира. Остается дело за малым — убедить крупные компании начать использовать подобные материалы. Задача хоть и выполнимая, но сложная.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
