
Совсем недавно коллективу исследователей удалось получить первое соединение гелия – вещества, атомы которого, как долго полагали химики, никогда не смогут образовывать
связи с другими.
Немного истории.
Спектральный анализ позволил в конце 19 века открыть группу элементов, простые вещества которых являются газами при обычных условиях. Вначале места для этих элементов в Периодической системе не находилось, однако вскоре для них всё же выделили нулевую группу, впоследствии ставшую восьмой, а потом – восемнадцатой.
Долгое время, более полувека, химия этих элементов оставалась пустым множеством, так как образованные ими простые вещества ни с чем не реагировали. По этой причине элементы, помещённые в нулевую группу, называли инертными, или благородными, газами.

Причин крайне низкой реакционной способности атомов этих элементов несколько. Разберёмся в них чуть детальнее.
При образовании связи атом может как отдавать электрон(ы), так и присоединять.
Атомы благородных газов очень неохотно присоединяют электрон, так как их электронные оболочки полностью заполнены и имею конфигурацию ns2np6 при n?2, где n – номер периода (электронная конфигурация гелия – 1s2). Таким образом, энергия орбитали, куда мог бы попасть электрон, т.е. орбитали (n +1)s1, насколько высока, что энергетический выигрыш от его присоединения не просто ничтожен, но даже и отрицателен. Иными словами, чтобы присоединить электрон к атомам благородных газов, надо затратить энергию, поэтому отрицательна их энергия сродства к электрону.
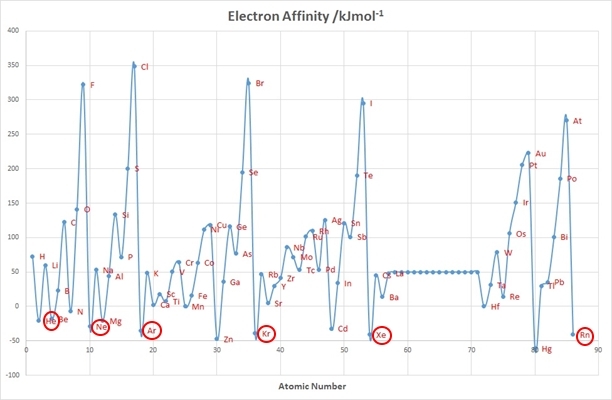
Зависимость энергии сродства к электрону от атомного номера.
В то же самое время атомы благородных газов очень неохотно отдают свои электроны, то есть имеют крайне высокие значения энергии ионизации. Это связано с тем, что малы радиусы их атомов, из-за чего электроны сильно притягиваются к ядрам.

Зависимость первой энергии ионизации от атомного номера.
Прорыв в химии благородных газов случился в 1962 г, когда канадский исследователь британского происхождения Нил Бартлетт получил первое соединение благородного газа ксенона с формулой Xe[PtF6] (на самом деле его формулу правильно записывать в виде [XeF][PtF5]). С тех пор химия благородных газов интенсивно развивалась: получены соединения радона, ксенона и криптона.
Ещё около десятка лет тому назад на вопрос о перспективности получения соединений так называемых лёгких благородных газов, аргона, неона и гелия, наш профессор, преподававший общую и неорганическую химию, давал такой ответ: «Наиболее вероятно, что скоро будут получены соединения аргона, крайне маловероятно такое для неона, а гелий, по всей видимости, навсегда останется благородным».
Уже в 2014 году получено первое соединение аргона, гидрофторид H-Ar-F, которое, правда, устойчиво лишь при крайне низких температурах (десятки кельвинов) в отличие от
соединений тяжёлых благородных газов, которые вполне стабильны, и их, как говорят мои коллеги, «можно держать в руках». Конечно, в прямом смысле держать их в руках я не советую, так как они обладают высокой окислительной способностью, и некоторые из них могут вызывать ожоги и отравления, а некоторые разлагаются со взрывом.
В 2017 году беда пришла, откуда не ждали: химической связи, как предполагается, поддался самый лёгкий благородный газ – гелий. Что интересно, получено его соединение отнюдь не с более электроотрицательным элементом, например, со фтором, а, кто бы мог подумать, с натрием!
Получение соединения гелия, Na2He, осуществлено при использовании сверхвысокого давления, около 160 ГПа, в матрице алмаза. Несмотря на то, что существование соединения подтверждено рентгенограммой, работа была принята в печать только спустя 3 года после первой подачи статьи. Учитывая, что химией сверхвысоких давлений занимается очень небольшое число исследовательских групп, и синтез такого соединения, неустойчивого при обычных условиях, представляет (пока, во всяком случае) исключительно теоретический интерес, повторён этот эксперимент ещё не был.
Итак, что же представляет собой полученное соединение в структурном плане?
Если описывать его в кристаллохимических терминах, то говорят, что Na2He кристаллизуется в решётке флюорита. Атомы гелия образуют плотнейшую упаковку и расположены в узлах гранецентрированной кубической примитивной ячейки. Атомы натрия находятся в тетраэдрических пустотах.
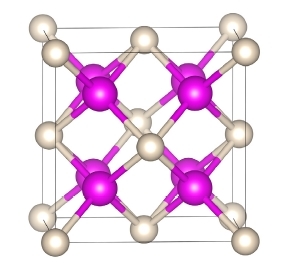
Структура Na2He. Розовым цветом обозначены атомы натрия, а серым – атомы гелия.
Однако известно, что структура флюорита нестабильна при высоких давлениях, так как не является плотнейшей в виду наличия октаэдрических пустот. Каким же образом Na2He может существовать в решётке флюорита при столь высоких давлениях, не претерпевая фазового перехода из-за сжатия?
Оказывается, Na2He представляет собой электрид, т.е. соединение, в узлах кристаллической решётки которого находятся электроны. Именно они и занимают октаэдрические пустоты флюоритовой решётки, тем самым, судя по всему, придавая ей несжимаемость при сверхвысоких давлениях. Но в отличие от классических электридов, в октаэдрических пустотах Na2He обитают не единичные, а спаренные электроны.
Описание химической связи вообще, а в таких «сложных» соединениях, как Na2He, и подавно, представляет серьёзную проблему даже для специалистов, но я попытаюсь упрощённо описать то, что происходит при образовании такого экзотического соединения.
Весьма и весьма условно структуру Na2He можно представить себе включающей положительно заряженный остов из ионов натрия, как в металлическом натрии, но с той разницей, что валентные электроны не шарятся по всему кристаллу, а локализованы, как было сказано, в октаэдрических пустотах, уравновешивая положительный заряд остова. Препятствуют объединению электронов в электронный газ атомы гелия, которые «вбиты» в данную структуру под огромным давлением и заставляют электроны сидеть по своим местам, не рыпаясь.
К сожалению, при понижении давления соединение распадается, что затрудняет его более подробное изучение. Здравый химический смысл заставляет думать, что стабилизировать электронную пару в решётке Na2He могут атомы, легко принимающие электроны, например атомы кислорода. Расчёт подтверждает возможность существование соединения Na2HeO в диапазоне давлений 10-100 ГПа, поэтому будем продолжать следить за развитием событий в области химии лёгких благородных газов.
Оставайтесь на связи.
> Ссылка на исследование
Комментарии (56)

vanxant
18.02.2017 21:48+5Популярная лекция по теме Артёма Оганова, одного из ключевых авторов исследования химии гелия:
https://www.youtube.com/watch?v=R0zwwbcWcNY

Aquahawk
19.02.2017 00:14+10Блин, графики с пиками являются лучшими картинками показывающими почему периодическая таблица элементов Менделеева выглядит именно так, и откуда взялся вынос актиноидов с лантаноидами. Почему этого в школе не могли показать?

superhimik
19.02.2017 00:18+2не знаю, спросите в Министерстве образования. В принципе, это можно показать и без свойств элементов, на основе заполнения электронных оболочек, но это слишком абстрактно для школьников. Другое дело, что эту абстракцию надо очень хорошо знать в вузе, если учишься на химика

vvzvlad
19.02.2017 04:04+1А почему в лампах используют аргон, ксеон, неон, если у них энергия ионизации, наоборот, высокая?

superhimik
19.02.2017 06:36+6Я не специалист по лампам. Рискну предположить, что потому, что они не реагируют с материалом оболочки лампы (колбой).
Высокая энергия ионизации в химии рассматривается главным образом с точки зрения возможности ионизации одного атома другим, т.е. её высокая величина относительна. В газосветовых лампах создание условий для ионизации не является лимитирующим фактором их эксплуатационных/потребительских характеристик и цены, я полагаю.
vvzvlad
19.02.2017 10:50О, хорошее объяснение. Видимо да, напряжение в 3 киловольта не является чем-то страшным, а больше, как я понимаю, для ионизации и не надо.

killik
19.02.2017 11:22Неонка в индикаторной отвертке и от 220в зажигается, как и в стартерах ламп дневного света, и в выключателях с подсветкой.
Wizard_of_light
19.02.2017 11:33+2Это тот случай, когда размер имеет значение, есть такая кривая Пашена — график зависимости напряжения пробоя от давления и расстояния между электродами.

black_semargl
19.02.2017 18:21да — энергия ионизации неона — 21.56 эВ. Т.е. менее процента от этих 3 кВ.

vvzvlad
19.02.2017 19:30А зачем там тогда высокое напряжение? Из-за большого промежутка?

black_semargl
20.02.2017 12:23+1Ну надо чтобы электрон успел разогнаться до столкновения.
Т.е. чем выше давление — тем выше и напряжение должно быть.

Mad__Max
23.02.2017 01:10+1Само же напряжение (электрическое поле) электроны с атомов не срывает.
Электрическое поле лишь разгоняет свободные электроны и ионы (уже ионизированные атомы) как и любые другие заряженные частицы попавшие в него.
Дальше они сталкиваясь с нейтральными атомами могут ионизировать их отдавая часть своей энергии — полученной перед этим за счет разгона в электрическом поле.
Поэтому чтобы процесс нормально шел зараженная частица должна получать достаточно энергии между такими столкновениями, чтобы ионизировать следующую. Иначе вместо ионизации мы будем иметь простой нагрев газа — поле разгоняет ионы и электроны, они сталкиваются и разгоняют нейтральные атомы. Причем очень слабый нагрев — раз ударная ионизация не происходит, то в процессе участвуют только заряженные частицы появившиеся за счет других процессов ну или благодаря вероятностному характеру этого процесса (какие-то частицы могут успеть набрать нужную энергию если пролетят в поле достаточно долго без столкновений).
В результате нам важно не общее напряжение между электродами как таковое, а напряженность электрического поля между ними. От него как раз зависит сколько энергии получает заряженная частица пройдя единицу расстояния в поле.
А количество столкновений на единицу пройденного расстояния при прочих равных зависит от давления газа — чем выше давление, тем чаще происходят столкновения, тем выше нужна напряженность поля, чтобы поддерживать ионизацию.

NetBUG
19.02.2017 11:50+1Да, Вы правы.
Лампы с наполнением парами металлов (ртуть, натрий, соединения цинка) зажигают дугу при сотне вольт, а рабочее напряжение на ней при постоянном токе может составлять 18..40В, тогда как для смеси Пеннинга (аргон-неон) напряжение зажигания при схожем расстоянии между электродами будет составлять более 100В, и напряжение на разряде стабилизируется на 70В и выше.
Для чистого ксенона напряжение зажигания может составлять до нескольких десятков кВ, в зависимости от давления в лампе — но это, действительно, не проблема, если таким образом можно достичь более высокого КПД, меньшего размера светящегося тела или большего срока жизни лампы.
Wizard_of_light
19.02.2017 11:22+1Там в основном светотехнические и эксплуатационные характеристики решают, а энергия, затраченная на ионизацию, всё равно высветится обратно. Только напряжение побольше нужно. Но вообще есть и лампы на парах натрия и ртути. Аргоново-ртутная смесь, кстати, наверное самая распространённая — все люминесцентные лампы на этом коктейле.

lrsi
19.02.2017 07:03-2В то же самое время атомы благородных газов очень неохотно отдают свои электроны, то есть имеют крайне высокие значения энергии ионизации. Это связано с тем, что малы радиусы их атомов, из-за чего электроны сильно притягиваются к ядрам.
Аж зубы заболели…
Атомарный радиус водорода — 53 пм, аргона — 71 пм
То есть вся это теория про «малы радиусы атомов» — бред сивой кобылы.
Читать про строение электронных оболочек атомов, что такое незавершенные орбитали и как это связано с понятием валентности.
superhimik
19.02.2017 07:17+8Я понял суть вашей претензии, но мне категорически не нравится форма, в которой она выражена.
Радиус атома есть периодическая функция атомного номера. Почему вы сравниваете радиусы атомов, элементы которых расположены в разных периодах? Вы бы ещё водород с радоном сравнили.
Потенциал ионизации, безусловно, зависит от электронной конфигурации. Но я не стал об этом говорить, чтобы не увеличивать размер статьи.
lrsi
19.02.2017 18:52-2Извините, но все равно звучит это… ну я говорю — аж зубы ломит. Соотношение атомного радиуса и химической активности — не так однозначно как вы написали, более того что вы написали — в корне неверно. В в ряду окислителей его уменьшение ведет к увеличению хим. активности, а в ряду восстановителей — наоборот. Если понимать как образуется хим. связь — очевидно почему так.
Неужели на уроках химии в школе перестали рассказывать что такое валентность и как она связана с электронной конфигурацией атома?! Неужто на уроках химии перестали рассказывать про s-, p-, d- и f-орбитали? Неужели непонятно что благородные газы это элементы у которых все имеющиеся орбитали являются завершенными, чем собственно и объясняется их инертность.
Я серьезно не понимаю — это же школьный курс химии, неужто это вообще надо разжевывать и объяснять?
P.S. Вспоминать уравнение Шредингера я аж боюсь… Боюсь что такой матан окажется непосилен для большинства читателей гиктаймса. :)
superhimik
19.02.2017 18:58+2Если вы хотите получить от меня какой-то ответ, переходя на личности, то вы его не получите. Если вам не нравится написанное мною — напишите отдельный пост с лекцией на тему реакционной способности инертных газов, у меня же такой цели не было.

alex73
19.02.2017 20:41+3Извините но в таком тоне не стоит совершать грубых ошибок, Нет у Инертных газов как вы выразились " все имеющиеся орбитали являются завершенными" d- и f- и даже не поверите g- орбитали у них вполне свободны, и как пример вам XeO3.

JTG
19.02.2017 13:54+1А что же всё-таки значат числа по оси Y на этой диаграмме?

Почему инертное золото с платиной так близко к галогенам, а натрий болтается внизу?
superhimik
19.02.2017 14:56что касается платины и натрия, я отвечу, если вы сформулируете, конкретно что с чем вы хотите сравнить.

vvzvlad
19.02.2017 19:38Натрий известен своей реакционной способностью, а золото ни с чем не взаимодействует. Если мы рассматриваем график как объяснения того, почему благородные газы не реакционно активны, почему тогда золото вверху, а не внизу, хотя оно мало с кем взаимодействует, а натрий рядом с неоном и аргоном, хотя гораздо более активнее этих газов. Мне кажется. JTG имел ввиду это.
Я предполагаю, что график стоит рассматривать только вместе с вторым, где натрий вполне себе в самом низу, а значит, легко отдает электроны, чем и объясняется его реакционная способность. Но это так, предположение, по химии у меня тройка была.
superhimik
19.02.2017 19:57+3Этот график нельзя рассматривать для объяснения реакционной способности в _общем случае_ (и даже в совокупности с графиком энергии ионизации) по одной причине, которая не очень очевидна (я уже не говорю о том, что энергия сродства к электрону измеряется с большой погрешностью, но это сугубо технические детали). Они отражают свойства АТОМОВ, но в реакцию вступают не свободные атомы. В случае натрия, золота и платины — это «куски» металла, а энергия кристаллической решётки очень немаленькая, чтобы ей пренебречь. Для объяснения поведения благородных газов их в то же время можно использовать, так как простые вещества их одноатомны.
Второй очень важный момент.
Если говорить о сравнении тех или иных химических свойств, то абсолютное значение той или иной величины, по сути, не представляет особого значения — важны тенденции, например, в ряду однотипных соединений (как правило, по группе) или в ряду увеличения заряда ядра, т.е. по периоду. Поэтому нет смысла, к примеру, сравнивать водород и аргон, как предлагает выше один умник. Во-первых, они не просто принадлежат к разным периодам и группам — у них разная СТРУКТУРА электронной оболочки (d-орбитали у аргона). Именно поэтому я и прошу уточнить, что с чем надо сравнить.
vvzvlad
19.02.2017 20:00+2А, ну я же говорил, тройка по химии :)
Спасибо, твои объяснения и статьи, как всегда, замечательны.
superhimik
19.02.2017 20:03+1На здоровье!
Дело не в школьной оценке — просто в школе таких вещей не проходят, это другой уровень.

coturnix19
19.02.2017 20:17Золото и платина не только «близки» к галогенам, но еще и формируют ионные соединения с цезием и отчасти рубидием, в которых золото и платина образуют отрицательные ионы Au(-) и Pt(2-). См например тут нагуглил. И еще в квикипедии есть

Tiberius
20.02.2017 21:41+1Ну что, вдавливание электронных оболочек теперь продемонстрировали на практике?;)

amarao
Это точно химическое соединение, а не механическое? Под гигантским давлением прижали друг к другу два атома, которые совсем не хотят прижиматься, и держат. Как только отпускают, всё рассыпается.
Напоминает две пружинки, которые могут образовывать «химическое соединение» в закрытом со всех сторон цилиндре.
superhimik
Вопрос хороший, спасибо, но это химическое соединение. Если бы это была механическая смесь, то её структура не была бы упорядоченной, то есть была бы не структура флюорита, а так называемый твёрдый раствор замещения, к примеру, когда в атомы в узлах решётки чередуются не строго, а хаотично.
amarao
То есть если мы с помощью атомного микроскопа расположим атомы в регулярном порядке, то это будет химическое соединение?
Для меня химическое соединение — это когда атомы удерживаются относительно друг друга энергетической выгодностью (общие орбитали, водородные, т.е. дипольные связи и т.д.). Если веществам выгоднее не быть вместе, а их «заставили», то это всё-таки механическая структура.
Я бы даже сказал, это это мета-материал, доведённый до логического финала по миниатюризации.
Собственно, у меня такой же вопрос в отношении, например, атомов вещества внутри фуллереновых шариков. Это химия или механика?
superhimik
Если расположим, то смотря какие атомы. Если атомы меди и цинка — не будет. А если иода и калия — будет.
Но вы же меня спрашивали о конкретике, а не о химическом соединении вообще, правда? И я вам ответил: признаком образования соединения в данном случае служит рентгенографически подтверждённое образование новой структуры. Я бы мог ответить, что показал расчёт электронной плотности, но не стал этого говорить, так как расчёт — это не доказательство.
В самом общем случае вопрос того, что является химическим соединением, очень сложен. И даже не в том аспекте, в котором вы спрашиваете. Границы между соединением и смесью не всегда чёткие.
Что касается вашего примера, то такие «штуки» могут относится к двум разновидностям (может, их есть больше, но не приходит на ум). Во-первых, соединения включения (или клатраты) — атомы внутри фуллереновых шариков. Во-вторых, катенаны, ротаксаны и т.п. Говорят, что в таких структурах есть топологическая связь, но это условное понятие.
Граница тут, ИМХО, идёт не через определение химического вещества, а по признакам его образования — то есть выделения из реакционной смеси субстанции, отличной от исходных реагентов по физико-химическим параметрам. В любом случае, и первые и вторые изучает химия, хотя классических химических связей в них нет.
Erynnis
В школьной химии говорят о том, что химическая связь подразумевает наличие «общего» электрона у связанных атомов (конечно школьная химия весьма приблизительна, но т.к. продвинутой химией я не владею, придется ограничиться такими представлениями, и интуитивно догадываться, что и в случаях, школьными учителями старательно упущенных рассуждения продолжат работать).
С точки зрения физики это означает, что у такого «общего» электрона есть набор возможных энергетических состояний, отличный от наборов энергетических состояний электронов в несвязанных атомах. Поэтому для определения наличия химической связи можно использовать спектроскопию.
Другое дело, что многие молекулы всегда поляризованы, и их электрические поля в некоторой мере влияют на энергетические уровни во всех близлежащих атомах/молекулах. Вплоть до разрушения существующей связи (диссоциация). Впрочем в этом случае снова имеет место химическая реакция.
В конечном счете играет роль количественный параметр смещения уровней — если смещенный уровень ниже каждого из несмещенных — соединение образуется.
Конечно для металлов, к примеру, все немного сложнее — там образуется химическая связь каждого атома со всеми другими, но это опять же выражается в изменении возможного спектра энергий электронов — на непрерывный (связь всех со всему означает, что внешние электроны каждого атома являются «общими» для всех атомов. Эдакий атомный коммунизм!)
В статье по ссылке есть картинки, которые судя по всему построены на основе спектроскопических измерений, и судя по ним — это действительно похоже на химическое соединение. Впрочем не уверен, что правильно интерпретировал эти картинки, но верю, что авторы статьи и рецензенты знают что публикуют.
Еще хочу отметить, что соединения гелия были известны и раньше. А именно HeCl, HeF И LiHe (на википедии дана ссылка на источник, датированный аж 1985 годом). Но эти соединения являются т.н. эксимерами — соединениями, в которых один из компонентов находится в возбужденном состоянии. Но т.к. в возбужденном состоянии атомы (и молекулы) долго находиться не могут — эксимеры весьма не стабильно.
Судя по заголовку статьи — впервые удалось создать стабильное соединение гелия. Хотя хлорид гелия мне встречался в составе каких-то витаминок в детстве, но надеюсь это была опечатка=)
superhimik
В высшей химии определение химической связи такое же — обобществление электронов. Теперь что касается спектров. С ними не всё просто. В статье НИКАКИХ спектров не снимали, записывали рентгенограммы. Но получение рентгенограмм использует рассеяние рентгеновского излучения на ядрах атомов, а не на электронах, поэтому прямой информации о состоянии электронов оно не даёт. Конечно, если образующая дифракционная картинка говорит о получении упорядоченной структуры, то это служит косвенным указанием на получение нового соединения, что и было сделано в данном случае.
О стабильности.
В принципе, соглашусь. Впервые удалось получить стабильное при > 100 ГПа соединение гелия. Естественно, при снижении давления соединение разваливается.
Erynnis
Кажется я принял желаемое за действительное. Рисунки 9 и 12 похожи на то, что можно было бы получить из спектроскопических измерений (они как раз относятся к состояниям электронов). Но судя по всему это все-таки результаты численного моделирования?
К слову наличие периодической структуры действительно выглядит (на первый взгляд) недостаточным обоснованием наличия связи. Дело в том, что гелий прекрасно проникает в зазоры между атомами (во всяком случае в некоторые материалы — например сталь). Обычно это приводит к серьёзной деградации материала — в зазоре без проблем помещается один атом гелия, а вот два уже создают значительные напряжения. Более того, по мере накопления гелия в таком кармане, попадающим туда новым атомам оказывается все проще осесть в том же месте. В итоге образуется пузырек, который сильно уменьшает прочность.
Собственно в рассматриваемом случае периодическая структура могла бы формироваться исключительно за счет кристаллической решетки натрия, а гелий мог бы оказаться просто втиснут между атомами. Как я понял — amarao писал именно о такой возможности. Хотя, конечно, строго один атом на одну ячейку — это несколько невероятно. Однако насколько структура материала однородна из имеющихся данных не ясно.
Но наличие вычислений, которые, с одной стороны демонстрируют наличие химической связи, а с другой предсказывают такую же периодическую структуру, как и полученная в эксперименте (причем не для единственного давления, а для некоторого диапазона), уже вполне может выступать доказательством. Хотя конечно расчет в отрыве от эксперимента таковым являться не может.
Собственно на этом и строится современная наука:
предположение => проверка => анализ => вывод.
superhimik
Да, там результаты РАСЧЁТА электронной плотности. Они, по мнению авторов исследования, хорошо укладываются в теорию.
В принципе, я согласен, что представленных характеристик полученного соединения мало, хотя ясно, что это обусловлено сложность условий эксперимента.
Теперь что касается диффузии.
Честно сказать, я не специалист в химии твёрдого тела, но общие представления, конечно имею. Если бы полученное соединение было твёрдым раствором внедрения (именно так называется то, что вы предлагаете), то мы бы получили много противоречий с экспериментом:
— твёрдые растворы внедрения — это всё фазы переменного состава, а у нас — строгая стехиометрия. Причём если предполагать структуру электрида, то она не может быть сколько-нибудь серьёзно нестехиометричной, ведь должен соблюдаться принцип электронейтральности;
— в твёрдых растворах внедрения не происходит принципиальной перестройки решётки, лишь увеличивается её объём. У натрия I-решётка, а у Na2He — F-решётка.
telobezumnoe
дело в том что химические связи это не только пересечения орбиталей электронов, ( принцип паули и наличие валентных электронов и тд) на пример правило Морковникова, когда менее гидрированный атом притягивает соседний более гидрированный так же влияет на состояние вещества и на его химические свойства, если посмотреть на белки, то же электростатические свойства, могут изгинать структуру белка создавая различные изомеры, в том числе и хиральные, делая его “подходимым или неподходимым“ к другим таким белкам, позволяя создать механизмы (химические свойства) с уникальными последовательностями на пример как молекула днк и механизмом репликации. все это так же химия, потому и весь спектр взаимодействий не заканчивается просто наличием свободных электронов и формой пересекающихся орбиталей
superhimik
Ну, во-первых, всегда. Особенно если учесть, что орбиталь — это волновая функция, и где её значение увеличивается, там и связь. А будет это электростатика или так называемое невалентное взаимодействие — это дело вторичное.
Во-вторых, я вам не советую всё-таки лезть в дебри. Правило Марконикова — эмпирическое, никаким «притягиванием» его результат не объясняется, объяснение лежит в плоскости стабильности образующихся карбокатионов.
Rusheff
Является ли таким образом интеркалированный графит химическим соединением графита с азотной или серной кислотой, например?
superhimik
Моё мнение — да. Более подробно об их химии здесь: http://popovgeo.sfedu.ru/sites/default/files/library/%D0%94%D1%8F%D0%B4%D0%B8%D0%BD%202000_10_1.pdf
Rusheff
Ссылка что-то не айс.
Но как по мне, так это физхимия кристаллов. Ну или химия, но не нашей вселенной.
pewpew
И в химии и в механике давление имеет значение. В таком случае, есть смысл разделять механику и химию?
Выгодность в случае больших давлений обеспечивается стабильностью в созданных условиях.
Атомам выгоднее быть вместе, удерживаемыми чудовищным давлением, превозмогающим силы отталкивания. На этом балансе сил и выезжает такое мета-вещество.
Химия же не только в привычных нам условиях бывает. Сверхвысокие температура и давление есть только в лабораторных условиях, но и они имеют пределы.
А, скажем в первые доли секунды после большого взрыва, условия были ещё экстремальнее. И не всё ли равно, как назвать науку, которая пытается разобраться в протекающих в этих условиях процессах?
vanxant
Вот как раз насчёт давлений — это мы с вами в некотором смысле экстремалы.
Практически всё вещество во Вселенной находится либо при очень высоких давлениях (внутренности звёзд и планет), либо, наоборот, рассеяно в вакууме при давлении 0 (межзвёздный газ, пыль, всякие астероиды, кометы и булыжники). Привычные нам 100 кПа это явление очень редкое, обладающее уникальными свойствами. При нашем давлении, например, возможно существование жидкой воды и всей химии растворов, в т.ч. биохимии — а в вакууме вообще очень мало веществ способны иметь жидкую фазу.
telobezumnoe
под нормальным атмосферным давлением тоже существует множество соединений, которые не возможны были бы в глубоком вакууме, значит ли это что и существующие связи так же как вы выразились "их заставили' и "механические"
amarao
А можно примеры таких соединений? Насколько я знаю из своего наивного профанского багажа знаний, давление не влияет на химические соединения, хотя и может смещать эквилибриум во время реакции. Разумеется, давление влияет на форму вещества (газ/пар/твёрдое), но чтобы у нас было химическое вещество, распадающееся при снижении давления…
Я могу поверить в то, что при снижении давления вещество, например, начинает реагировать с соседями. Но вот распадаться…
coturnix19
То же можно сказать о веществах, составляющий большую часть земной массы: ведь они тоже держатся вместе под большим давления, и при снятии давления большая их часть просто бы тут же расплавилась — но кмк «механическими соединениями» они от этого не становятся. Давление тут рассматривают как некий внешний параметр, свойства среды а не соединения.
amarao
Насколько меня учили в седьмом классе, и насколько я помню, смена аггрегатного состояния вещества (например, расплавление) не является химической реакцией. Застывшая вода и парообразная вода является водой в обоих случаях.
coturnix19
Не понял при чем тут это, для молекулярных веществ это наверное так, но камень — не молекулярное вещество а ионное и в то же время немного полимерное, и например при расплавлении горной породы, состоящей их нескольких отдельных минералов вы получаете равномерно перемешанную жижу в которой «индивидуальность» исходных минералов не сохраняется — только усредненный количественный состав. Хз, это вроде и правда не совсем химическая реакция, но ни расплавленный, ни тем более испаренный гранит уже не является гранитом.
insafonov
Тогда на поверхности звезды вода не является химическим соединением =)
superhimik
Вода существовать на поверхности звезды не может, равно как и все остальные химические соединения.
alex73
не верно, очень сильно зависит от того, что это за звезда. По крайней мере Гринвуд утверждает что можно оксиды холодных звездах найти.
superhimik
Формально вы правы. Если температура объекта 1000-3000 K, то химические соединения, в частности, тугоплавкие оксиды металлов (и не только), там вполне могут быть. Но вот являются ли такие объекты настоящими звёздами?.. Фиг его знает…
coturnix19
Являются, настоящесть звезды определяется тем происходят ли в ее недрах ядерные реакции или нет, а не температурой поверхности самой по себе.
superhimik
а при таких низких температурах они могут проходить?
coturnix19
Насколько известно, красные карлики (а также сверхгиганты) с температурой поверхности от 2400К вполне существуют и считаются звездами т.к. в них идут ядерные реакции, но это уже на самом пределе, будь они (карлики) заметно меньше — реакции бы уже не шли.
Avior133
Не могут
Ядерные реакции идут в ядре, где температура достигает миллионов кельвинов
А под температурой звезды подразумевают температуру поверхностного слоя, фотосферы, если я не ошибаюсь. И она как раз имеет порядок тысяч — десятков тысяч кельвинов.
У красных звёзд она как раз находится в пределах 3000 К, и те нехило так коптят в окружающее пространство частичками сажи и оксидов.
Но если говорить о звезде типа Солнца — температура фотосферы будет составлять около 6000 К, и ни о каких химических соединениях говорить в таких условиях не приходится.