Зрительный анализатор – это основной инструмент получения информации об окружающей среде. Зрение для животных – детектор опасности, сигнал о наличии добычи, средство ориентации в пространстве, а для человека – главный способ коммуникации и обучения. Тем страшнее современному человеку утратить зрение.
Но мы живем в век обширных познаний в биологии и медицине и развитых технологий в области микроэлектроники. Почему бы не совместить все это? Возможно ли помочь людям, лишившимся зрения, с помощью передачи видеосигнала прямо в мозг? И существуют ли уже сейчас подобные технологии, вышедшие за рамки опытных образцов и экспериментов?
Слепота
Существуют различные критерии слепоты, к примеру, в США это понятие применяется к людям с остротой зрения хуже, чем 20/200. Это означает, что человек с таким зрением вынужден подойти на расстояние 20 футов (6,1 м) к предмету, который человек с нормальным зрением видит с расстояния 200 футов (61 м). ВОЗ определяет эту границу в 20/400. Качество зрения хуже этого приравнивается к полной слепоте – отсутствию световосприятия как такового.
Для того чтобы понять, как помочь человеку, нужно знать, как именно он ослеп. В современном мире большинство случаев является результатом возрастных дегенеративных заболеваний тканей глаза: катаракты (около половины случаев), глаукомы (менее 10%), макулодистрофии (5%). Но если рассматривать только людей трудоспособного возраста, то на первый план выходят патологии, которые не на слуху у обывателя: врожденные (до 20% случаев) и диабетические (15%) ретинопатии.
Диабетическая ретинопатия, как ясно из названия, является одним из осложнений сахарного диабета сосудистого происхождения. Из-за хронического повреждения эндотелия, атеросклеротических изменений, потери эластичности и нарушения проницаемости сосудов нарушается функция всех васкуляризованных тканей. Но данный вид ретинопатии управляется – обычно настолько успешно, насколько тщательно у конкретного пациента проводится инсулинотерапия диабета.
Совсем по-другому обстоит дело с больными т.н. пигментным ретинитом. Это – общий термин для группы наследственных заболеваний с различными вариантами наследования, которым соответствует более 250 обнаруженных на данный момент генетических мутаций. Патогенез заболевания заключается в том, что, начиная уже с молодого возраста, у людей возникает постепенная дегенерация клеток пигментного эпителия или других слоев сетчатки. Дегенерация может развиваться на периферии, концентрически сужая поле зрения, либо наоборот, затрагивать центральную зону, заставляя больного смотреть боковым зрением. В конечном итоге дегенерации подвергаются все фоторецепторные клетки зрительного поля. В отличие от помутнения и травм хрусталика, роговицы, где можно повысить прозрачность или заменить ткань хирургически, при пигментном ретините страдает не «оптика», а «матрица», и остановить этот процесс невозможно. Этому состоянию в мире подвержено более 1,5 млн человек.
Протезирование
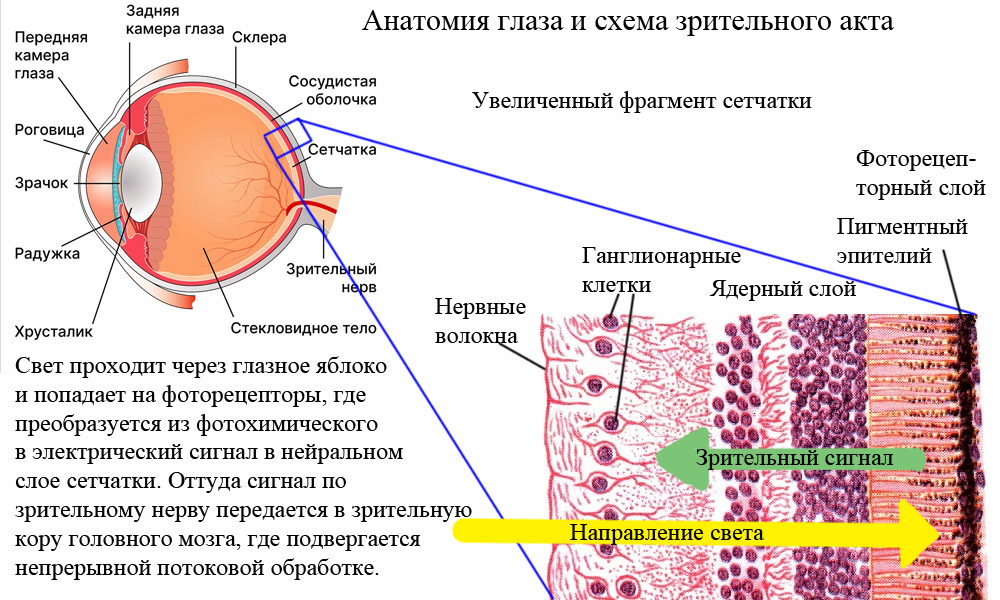
Таким образом, именно люди с пигментным ретинитом являются субъектами для внедрения экспериментальных технологий протезирования зрения. Необратимость слепоты, наступающей не к старости, а в наиболее социально активном и трудоспособном возрасте, создает сильный запрос на такие технологии. Кроме того, во многих случаях пигментный ретинит является сбоем только системы пигментного и фоторецепторного слоев, когда возникают мутации зрительного пигмента родопсина, либо нарушается система фагоцитирования его отработавших фрагментов. При этом остальные слои сетчатки, участвующие в превращении фоторецепторного сигнала в нервные импульсы, остаются слабо или практически не затронуты (до 30% ганглионарных клеток и до 80% клеток внутреннего ядерного слоя остается даже в тяжело пораженной сетчатке), что дает возможность создать «первый эшелон» протезирования – специальные ретинальные импланты.
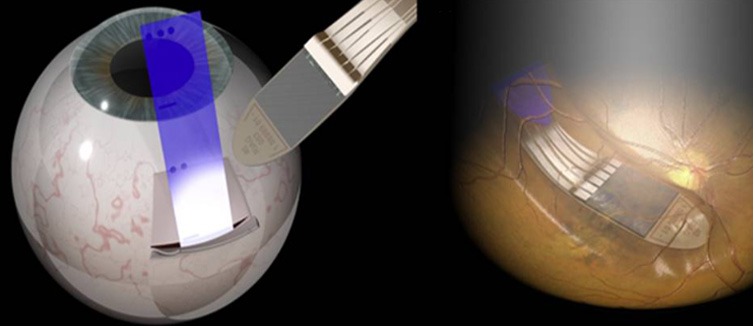
Идея ретинального протезирования заключается в том, чтобы в обход механизма фоторецепции возбуждать нейрональные клетки сетчатки, воздействуя на мембранный потенциал нейронов электрическими импульсами. Такой подход имеет ряд ограничений технического, хирургического и физиологического характера, но вполне осуществим. Результатом операции является внедрение в сетчатку небольшой матрицы из стимулирующих электродов, фактически возвращающей глаз к состоянию примитивной фоторецепторной системы. Из минусов – необходимость серьезного оперативного вмешательства в глазное яблоко, в том числе, удаление стекловидного тела.
Раздражение практически всех участков зрительной системы приводит к возникновению так называемых фосфенов – вспышек, зрительных артефактов, которые случаются и при попадании высокоэнергетических частиц на сетчатку космонавтов, и при внешней электрической стимуляции зрительной коры, и при обычном трении закрытых глаз. Это свойство можно использовать для тонкого местного раздражения отдельных зон нейрональных клеток на сетчатке, а затем откалибровать получаемую картинку.
Ретинальные протезы
Несколько моделей ретинальных имплантов на сегодняшний день прошли клинические испытания и одобрены для пациентов. Это Argus II от компании Second Sight Medical Products (США), Alpha AMS от Retina Implants AG (Германия) и IRIS от Pixium Vision (Франция).
Argus II является эпиретинальным (расположенным на поверхности сетчатки со стороны центра глазного яблока) имплантом. Он является развитием прототипа Argus I, который, в свою очередь, был сделан на основе кохлеарного (слухового) импланта, состоящего из всего лишь 16 электродов. Квадрат из 4х4 электродов диаметром 250 и 500 микрометров с расстоянием 800 мкм между ними после вживления людям дал ценную информацию о работоспособности и возможностях оптимизации такой технологии. В результате одобренный FDA в 2011 году имплант второго поколения имеет уже 60 электродов диаметром 225 мкм и расположенных прямоугольником 6х10 штук на расстоянии 525 мкм друг от друга, что позволяет охватить поле зрения в 11°х19°.
Сборка стимулирующих электродов соединена шлейфом с внешним чипом, закрепленным снаружи на поверхности склеры с верхне-наружного квадранта глазного яблока. Там же расположена приемная индукционная катушка, которая получает сигнал от внешнего модуля. Внешним модулем являются очки – второй элемент системы, на их переносице расположена камера, передающая сигнал в видеорегистратор, крепящийся к поясу. Видеосигнал затем преобразуется в беспроводной сигнал, который расшифровывается чипом на склере и передается электродной матрице внутрь глаза.
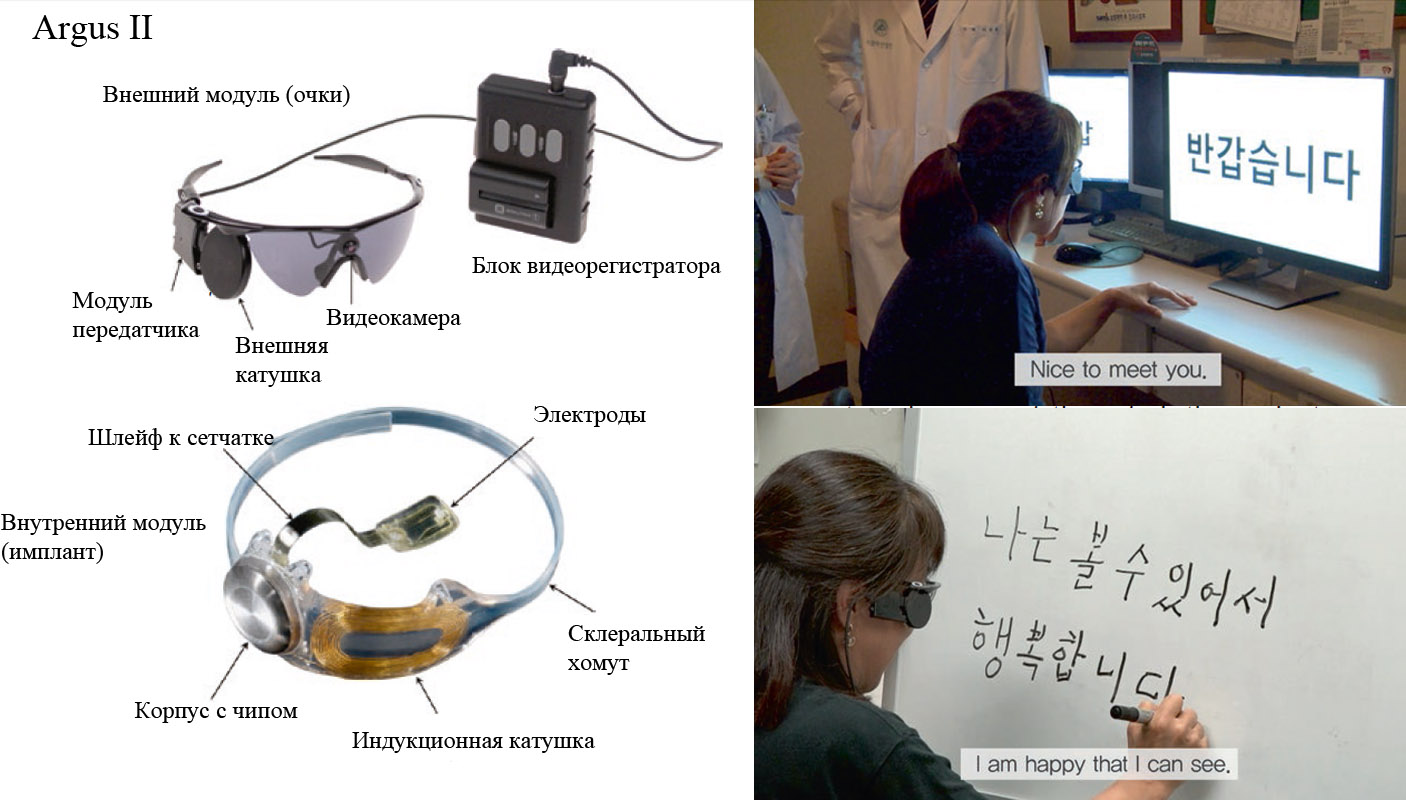
Что можно увидеть с помощью Argus II? С одной стороны, наилучший из всех пациентов с данным имплантом результат остроты зрения составил мало впечатляющие 20/1260. С другой стороны, от 60 рабочих «пикселей» сложно ожидать вообще какого-то качества зрения, это некий вспомогательный способ перцепции, призванный ориентироваться в пространстве по силуэтам, границам освещенности, цветовым контрастам. В определенных случаях пациент может следовать по нарисованной на полу линии, или различать крупные фигуры или буквы на контрастном фоне.
В исследовании качества зрения, проведенном у пациентов с вживленной системой Argus II, наиболее интересными являются результаты теста FLORA, менее сухого и стандартизованного по сравнению с лабораторными, но все же статистически валидного. FLORA (сокращение от «functional visual abilities in and around a residential setting» – «зрительная функция в околодомашних условиях») – это тест на выполнение пациентами 35 повседневных дел с активированным и дезактивированным имплантом. С активным Argus II пациентам было значительно проще находить дверные проемы, ориентироваться по комнатному освещению, свету из окон, сортировать белое и темное белье, замечать прохожих, различать бордюры и разметку пешеходных переходов. Правда, были задачи, где включенный имплант наоборот сбивал с толку по сравнению с отсутствием зрения – например, перемещение внутри дома и по лестницам.
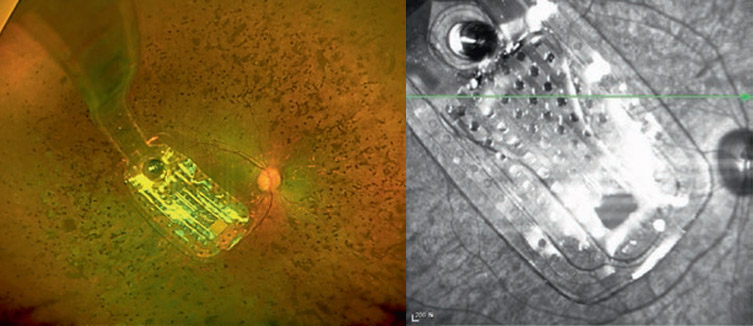
Демонстрация вживления импланта IRIS. Зеленым на схеме сетчатки выделен нейральный слой, с которого далее получает сигнал вживляемый имплант. Далее показана передача информации от внешнего модуля к импланту ИК-лучом.
Другой протез, IRIS, представляет собой аналогичный Argus эпиретинальный имплант с внешним модулем и 150 активными электродами. Разработчики сделали передачу сигнала на имплант внутри глаза при помощи инфракрасного луча, что позволило увеличить скорость передачи, а также дало возможность непрерывно изменять и координаты, и интенсивность фосфенов, более точно имитируя зрительный процесс. В остальном схема очень похожа на Argus.

Принципиально иную схему стимуляции предлагает Alpha AMS. Это субретинальный, то есть, помещаемый под поверхность сетчатки имплант. Он содержит 1500 функциональных элементов, состоящих из фотодиода, связанного со стимулирующим электродом. Эта фоточувствительная и одновременно стимулирующая клетки сетчатки матрица не имеет управляющего электронного чипа, вместо этого она получает свет из глаза пациента, а питание – с индукционной катушки, которой управляет с пульта сам пациент. С помощью внешней индукционной катушки, крепящейся к голове магнитом, пациент может амплифицировать сигнал на импланте, регулируя его в зависимости от освещенности. Питается система от обычных батареек АА, не имеет прикрепляемых к глазу дополнительных электронных модулей, не использует видеосигнал и внешний модуль с очками и видеорегистратором, а главное, направление зрения пациент задает привычными движениями глаз, а не направляя движениями головы объектив камеры. Alpha AMS показал максимальный результат остроты зрения в 20/546. Исследования показали, что пациенты с этой системой заметно комфортнее выполняют такие действия, как ходьба по освещенным территориям, избегание препятствий, а также видят некоторые очертания и предметы, от домов и линии горизонта до тарелок и бильярдных шаров.
Ограничения
Увы, у самых продвинутых технологий имеются свои ограничения. И в случае такого сложного органа, как глаз, создателям имплантов приходится работать на грани физических и физиологических возможностей.
В первую очередь, казалось бы, можно увеличить площадь импланта. Но против этого работают хирургические ограничения. Разрез, через который производится витректомия (удаление стекловидного тела), а затем введение импланта, не должен превышать 5 мм в длину из-за риска осложнений, что сразу ограничивает одно из измерений имплантируемой сборки электродов по размеру. В принципе, это не особенно нужно: все точное цветное зрение создается в области центральной ямки (fovea) сетчатки диаметром до 0,5 мм. Остальная площадь содержит в основном палочки и служит для периферического зрения. Теоретически, можно было бы «добрать» поле зрения составным или складным имплантом, охватывающим большую площадь. Согласно психофизиологическим экспериментам, людям с нормальным зрением для комфортной ориентации в пространстве необходимо хотя бы 27°–30° поля зрения, в то время как Argus II дает менее 20°. Но прежде всего, хоть какой-то значимой остроты зрения он тоже не обеспечивает.
Тогда логично повысить плотность электродов? Для чисто стимулирующих электродов это сложно ввиду наличия проводки к каждому электроду. В случае с Alpha AMS – это возможно, поскольку сигнал на нейрональный слой сетчатки не подается по шлейфу извне, а идет от фотоэлементов, расположенных на той же подложке, а к импланту идет лишь питание. Но здесь начинает работать другой предел, в основе которого – сложная физико-химия поверхностных явлений.
Нейрон – это не провод, а живая клетка, которая электрически возбуждается, меняя ионный состав внутри работой сложных молекулярных структур – ионных каналов и насосов, и за счет этого меняет величину заряда на поверхности своей мембраны снаружи и изнутри. Для правильной стимуляции мембраны нейрона нужно аккуратно и обратимо воздействовать на двойной электрической слой на её поверхности. При превышении необходимого потенциала на электроде может пойти фарадеевский ток. Это значит, что электрод будет подвергаться коррозии из-за химической реакции с окружающими веществами – ионами солей и органическими молекулами в составе клеточных мембран. Помимо порчи электрода, продукты таких реакций тоже могут быть вредны для клеток. А с уменьшением размера электродов резко растет порог плотности заряда, необходимого для воздействия на мембрану, что опасно приближает нас к области нежелательных электрохимических реакций. Далее, в экспериментах на животных было показано нелинейное повышение перцептивного разрешения сетчатки при уменьшении размера электродов, что сводит на нет выигрыш в увеличении их числа и плотности. И это далеко не все из известных тонких эффектов взаимодействия электродов с живой сетчаткой. Даже банальное отведение тепла от компонентов может быть проблемой для организма, который нежелательно нигде перегревать выше 37°С.
Судьба проектов
Хотя упомянутые проекты и одобрены как медицинские изделия после успешных клинических испытаний, их судьба далеко не радужная.
Alpha AMS, при всей видимой продвинутости технологии, вызывал у пациентов осложнения. Из-за инвазивной процедуры отслойки сетчатки для размещения чипов, а также смещения со временем практически всех имплантов (некоторых – за пределы области центральной ямки сетчатки) в среднем на 0,6 мм большинство пациентов высказали неудовлетворение проведенной процедурой. В результате, после 27 установленных прототипов IMS и 8 одобренных изделий AMS проект был полностью свернут в 2019, а компания Retina Implants AG развалилась.
Серьёзные проблемы постигли компанию Second Sight. В 2019 году, имея клиентскую базу в 350 пациентов с изделиями серии Argus, они анонсировали следующий амбициозный проект – мозговой имплант Orion для стимуляции зрительной коры. Однако в 2020-м году компания стала резко терять деньги, сотрудников, и была в шаге от банкротства. Возобновив было свои амбиции к концу года, она, тем не менее, не смогла поддерживать своих пациентов, которых поставили перед выбором: носить в себе обреченную на поломку систему, либо сделать операцию по ее удалению. Недавно Second Sight провела переговоры о слиянии с Nano Precision Medical, которые, естественно, не дают прогнозов насчет того, будут ли заниматься проектом Orion и прочими переходящими по наследству проблемами.
Более-менее хорошо дела идут у Pixium Vision, которые также разработали субретинальный имплант PRIMA.
Перспективы?
Как понятно из написанного выше, ретинальный имплант невозможно использовать, если глазное яблоко сильно повреждено или уничтожено. Но наверное, можно подключиться стимулирующими электродами и на других участках зрительного пути? Да, это так.
Во-первых, возможна стимуляция самого зрительного нерва, а также латерального коленчатого ядра (geniculate nucleus) – зоны мозга, где точно известно соответствие ее слоев с областями сетчатки. Это труднодоступные зоны, в черепе под самым мозгом, но можно использовать и их при невозможности воздействия на сетчатку.
Во-вторых, некоторые группы ученых изучают стимуляцию зрительной коры, например, университет Монаша в Мельбурне, или европейская коллаборация CORTIVIS из Аликанте в Испании. Быть может, прокашляется и заведется заглохший Second Sight. Пока у них нет речи о выпуске готового продукта для людей, но сама концепция выглядит перспективной. Несмотря на то, что вмешательство в мозг представляется очень серьезной операцией, ряд ограничений, таких, как труднодоступность, жидкая внутриглазная среда, малый размер импланта, риск полной отслойки сетчатки в этом варианте операции отсутствуют. В ближайшее время мы можем стать свидетелями новых нетривиальных задач на пути разработки зрительной системы, а может быть и серьезного успеха в этой области.
Автор статьи @Vsevo10d
НЛО прилетело и оставило здесь промокод для читателей нашего блога:
— 15% на все тарифы VDS (кроме тарифа Прогрев) — HABRFIRSTVDS.

Bedal
Проблемы камеры считай, нет. Контактная передача на нервную ткань (или в мозг) изначально грешит деградацией контакта. И, похоже, решения на этом направлении не будет.
Беспроводные (скажем, микроволновые) методы пока не умеют воздействовать на достаточно малую точку. При этом куда передавать — не так даже и важно, если не ставить сразу конечную цель полноценного зрения. Можно «давить» на слуховую зону — мозг адаптируется и ориентироваться в пространстве будет можно.
Вот пока по третьему пункту не будет прорыва — не будет и настоящего протезного зрения.
Sap_ru
Есть намёки на пути решения - чипы с органическим покрытием, на которое укладывается нерв. Кроме физическое крепления нерва, есть ощущение, что можно подобрать такое покрытие, что нерв будет сам пытаться лежать в его пределах.
Ну, и как перспектива - выращивать часть нервных волокон или покрытие из клеток прямо на чипе из тканей реципиента. Но имея такие технологии можно не только зрение восстанавливать, а уже практически что-угодно лечить или протезировать. С другой стороны, есть понимание, что такие биотехнологии физически достижимы в обозримом будущем.
Bedal
Насколько я понимаю — идея зацепиться за конкретный нейрон тоже ложна. Нет там такой стабильности на годы.
Vsevo10d
Проблемы "крепления" или физического контакта как таковой нет. Есть проблема функциональности данного контакта.
Пока ваша задача - считать сигнал с нейронов, то проблемы с этим только в масштабе и степени инвазивности. Если ваша задача - передать электрический сигнал, то проблема в адресности (по масштабу вы как тычете веткой в пины процессора), совместимости материала электрода и клеточных мембран, возникновении нежелательных последствий электрического возбуждения, возможных электрохимических реакциях. Если же вам надо воздействовать химическим сигналом - то это практически невозможно, создать искусственный синапс в нужном нейроне - задача практически непосильная даже на срезе ткани, не говоря уже об организме. Так что "протезировать практически что угодно" не выйдет. Но да, проблема во многом материаловедческая и нужны пресловутые нанотехнологии.
Vsevo10d
Кстати, именно поэтому очень многие технологии помощи слепым вообще игнорируют остатки зрительной системы и ориентируются на тактильность и звук. Есть огромное количество вспомогательных систем на базе тростей, камер, УЗ- и ИК- датчиков как на ардуино-машинках, которые передают вибрацию или звук переменной тональности в зависимости от расстояния до препятствия. Исследовательские группы, разрабатывающие импланты для коры мозга, сейчас спорят на этапе фундаментальных исследований, не теряет ли свои функции зрительная кора у слепых от рождения. И это еще один аргумент, почему в клинические испытания берут пациентов с пигментным ретинитом, изначально зрячих и не пожилых, с хорошим потенциалом для восстановления.