Люди обладают рядом физиологических, психических, когнитивных, физико-химических и других особенностей, которые в совокупности и формируют основные признаки Homo sapiens. Ввиду эволюционных и генетических факторов каждый человек по-своему уникален. И эта уникальность проявляется не только во внешних особенностях, но и в работе внутренних систем. К примеру, сердце человека является одним из важнейших органов, который выполняет одни и те же функции, независимо от его владельца. Однако его форма, размеры, режим работы и даже положение могут отличаться от человека к человеку. Следовательно, в процессе разработки искусственного сердца для определенного человека необходимо учитывать особенности оригинала. Именно этим и занялись ученые из Массачусетского технологического института (США). Они разработали методику создания мягкого и гибкого роботизированного сердца на 3D принтере с возможностью точной настройки того, как именно оно будет работать. Из чего сделано искусственное сердце, как именно оно настраивается, и насколько точно оно имитирует оригинал? Ответы на эти вопросы мы найдем в докладе ученых.
Основа исследования
Говоря о сердце, сложно не затронуть проблемы, которые с ним связаны. Если бы их не было, то не было бы и необходимости в искусственных эквивалентах. Одной из самых распространенных проблем сердца является аортальный стеноз (АС), который представляет собой сужение устья аортального клапана из-за снижения подвижности створок клапана. Он возникает в результате воспалительных процессов, подобных тем, которые вызывают атеросклероз, когда повреждение эндотелия из-за механического стресса и других биологических процессов вызывает фиброз, утолщение и кальцификацию створок клапана. Хотя АС чаще поражает пожилых людей, его начало и прогрессирование могут быть значительно ускорены из-за врожденных дефектов, таких как порок двустворчатого аортального клапана (ДАК), который возникает при слиянии двух створок аортального клапана.
Гемодинамически сужение устья аортального клапана постепенно приводит к повышению трансаортального градиента давления. Повышенная постнагрузка (или перегрузка давлением) приводит к повышению систолического давления в левом желудочке (ЛЖ) и уменьшению объема, выбрасываемого при каждом сердечном сокращении (ударный объем* или УО), что приводит к падению сердечного выброса и возникновению таких симптомов, как стенокардия и обмороки при физической нагрузке. У двух третей пациентов с АС перегрузка давлением вызывает ремоделирование ЛЖ, что приводит к потере податливости ЛЖ и, в конечном итоге, к диастолической и/или систолической дисфункции. Это осложнение, вызванное АС, является причиной более высокой смертности или повторной госпитализации среди пациентов, которые перенесли операцию по замене аортального клапана. Не говоря уже о том, что это может привести к сердечной недостаточности.
Ударный объем* — объем крови, выталкиваемый левым желудочком сердца к аорте за одно сокращение или правым желудочком к легочной артерии.Как отмечают ученые, только в США от АС страдает порядка 1.5 миллиона человек, а 5-летняя выживаемость при условии отсутствия лечения составляет всего лишь 20%. На сегодняшний день не существует эффективных фармакологических методов лечения АС. По примерным оценкам в США ежегодно проводится от 80 до 85 тысяч операций по замене аортального клапана.
В настоящее время разрабатываются протезы аортальных клапанов нового поколения с целью улучшения гемодинамических характеристик. К сожалению, большинство гидродинамических моделей, используемых в настоящее время для функциональной оценки протезов клапанов, основаны на жестких, идеализированных компонентах и не могут воссоздать анатомию и гемодинамику конкретного пациента.
Недавно для исследований врожденных пороков сердца, расслоения аорты и АС были разработаны гидродинамические платформы, объединяющие реплики аорты, специфичные для пациента. В одном из исследований была продемонстрирована модель для конкретного пациента, которая объединяла формованные копии специфической для пациента геометрии корня аорты и кальцифицированного клапана, полученные по данным компьютерной томографии (КТ) с жесткой системой дублирования ритма. Тем не менее производительность этих гидродинамических моделей во многом зависит от наличия биомеханически значимых полимеров для 3D-печати и точности реконструкции створок.
Таким образом, несмотря на то, что эти напечатанные на 3D-принтере модели сердечных клапанов из нескольких материалов могут быть полезны для понимания влияния кальцификации на гибкость створок для определения размеров клапана при транскатетерной замене аортального клапана (TAVR от transcatheter aortic valve replacement), различия между механическими свойствами гибких материалов, используемых в 3D-принтерах, и свойствами нативных сердечных клапанов могут значительно снизить их способность надежно воспроизводить гемодинамику конкретного пациента.
Взяв за основу свое предыдущее исследование, в котором была продемонстрирована способность аортального рукава воссоздавать гемодинамику АС в модели свиньи, ученые разработали анатомическую гидродинамическую систему, напечатанную на 3D-принтере, которая способна индивидуально имитировать гемодинамики АС.
Результаты исследования
Первым делом ученые отобрали 15 пациентов (6 женщин, 9 мужчин; возраст 78 ± 13 лет; площадь поверхности тела 1.67-2.23 м2) с диагнозом АС, которым была проведена трансторакальная, чреспищеводная эхокардиография или их комбинация, а также КТ для гемодинамической и анатомической оценки. Отобранная когорта пациентов имела широкий спектр функциональных и структурных характеристик, относящихся к АС, как показано в таблице №1.
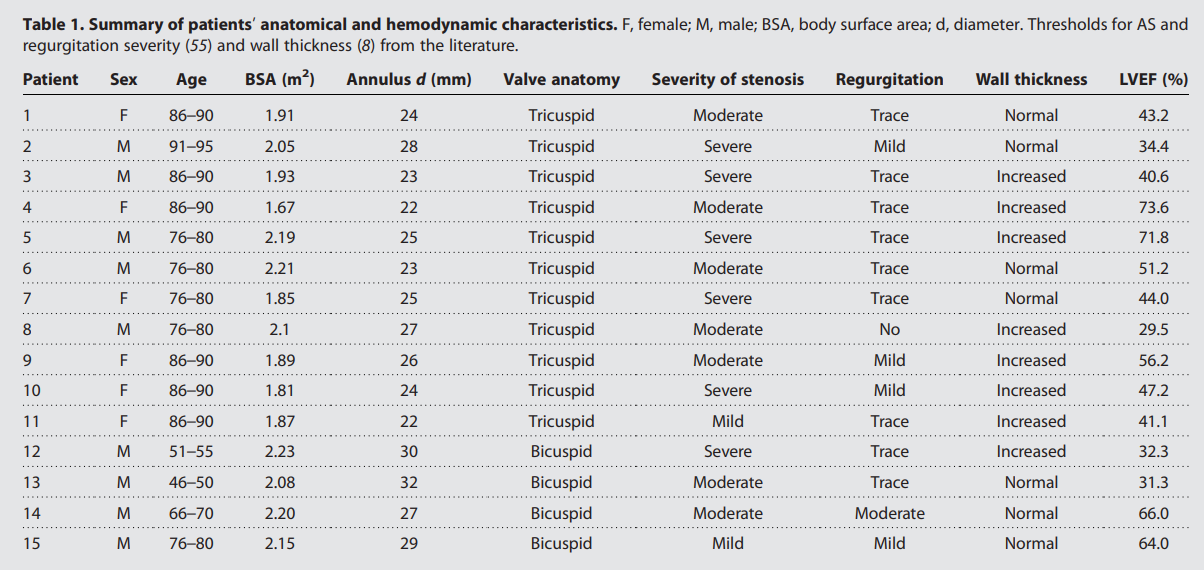
Таблица №1: анатомические и гемодинамические характеристики пациентов.
Диаметр кольца аорты у отобранных пациентов колебался от 22 до 32 мм. У четырех из них были признаки порока ДАК, у 6 был диагностирован тяжелый АС, у 14 были некоторые признаки аортальной регургитации, у 8 было выявлено утолщение стенки ЛЖ, а у 4 — фракция выброса ЛЖ (ФВ ЛЖ) была ниже 40%.
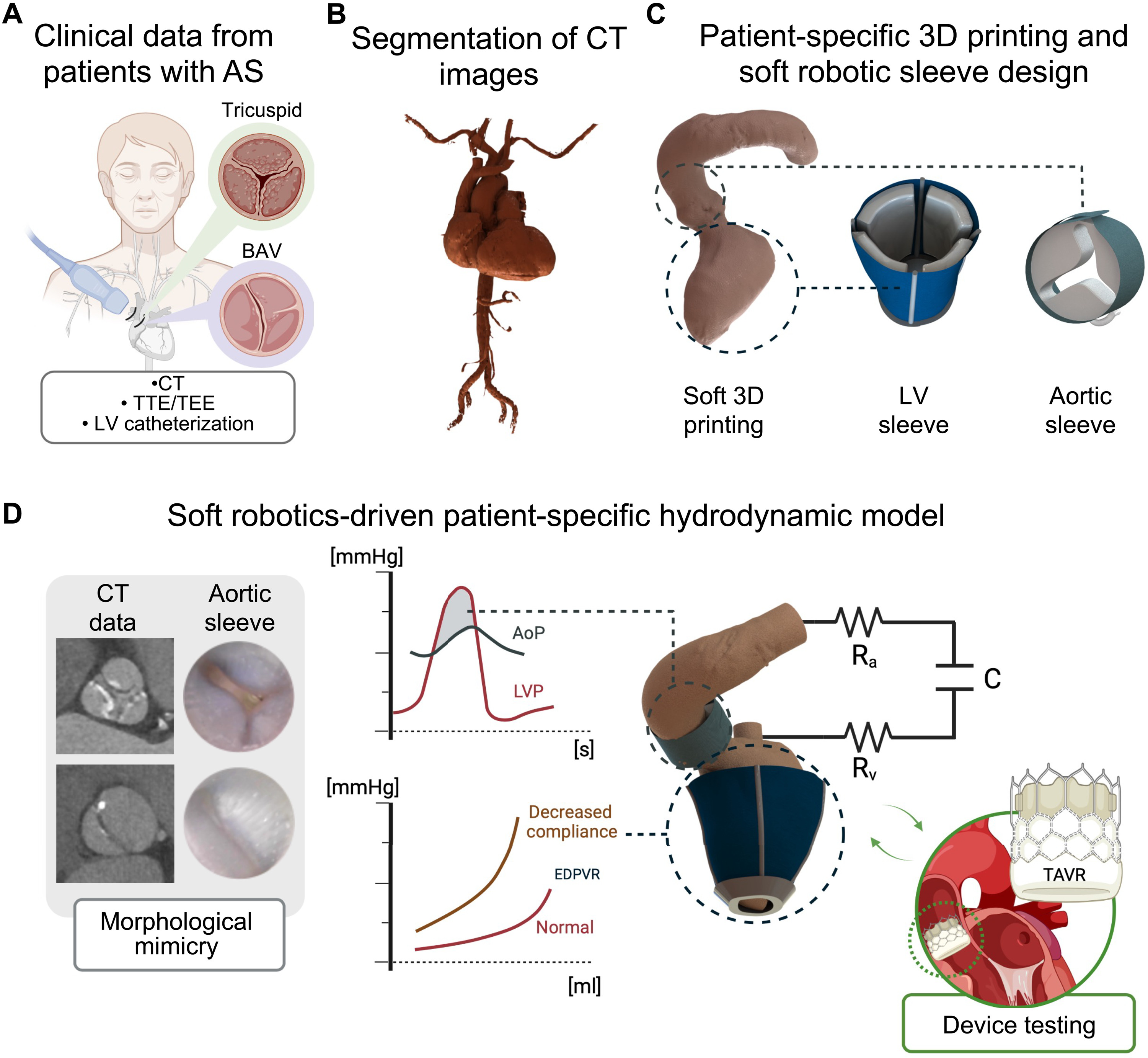
Изображение №1
Выше проиллюстрирован рабочий процесс и общая архитектура модели, разработанная на основе гемодинамики пациента и визуализации. Дополнительно от пациентов были получены клинические данные (КТ, эхография и катетеризация; 1A). Сначала было выполнено сегментирование КТ-снимка для создания трехмерных анатомических моделей ЛЖ и аорты пациентов (1B и 2A), которые затем напечатали на 3D-принтере с помощью мягкого эластомерного фотополимера (1C). Затем КТ-снимки были использованы для разработки индивидуальных мягких роботизированных рукавов ЛЖ и аорты для конкретного пациента (1C).
В сочетании с 3D-моделями для конкретного пациента и гидродинамической моделью in vitro (1D) мягкий роботизированный рукав ЛЖ обеспечивал сократительную силу, необходимую для создания систолического давления и кровотока, характерных для пациента, в то время как мягкий роботизированный рукав аорты обеспечивал морфологическую мимикрию и повторение гемодинамики, специфичной для данного пациента (видео №1). В конечном итоге эта персонализированная модель позволила протестировать гемодинамические изменения, вызванные TAVR, в различных условиях (1D).
Видео №1
Мягкий роботизированный аортальный рукав позволяет с высокой точностью воссоздать морфологию поражения клапана у каждого отдельного пациента. На 2A показано сравнение для каждого пациента КТ-снимков аортального клапана и поперечных сечений аорты разработанной модели при срабатывании аортального рукава.
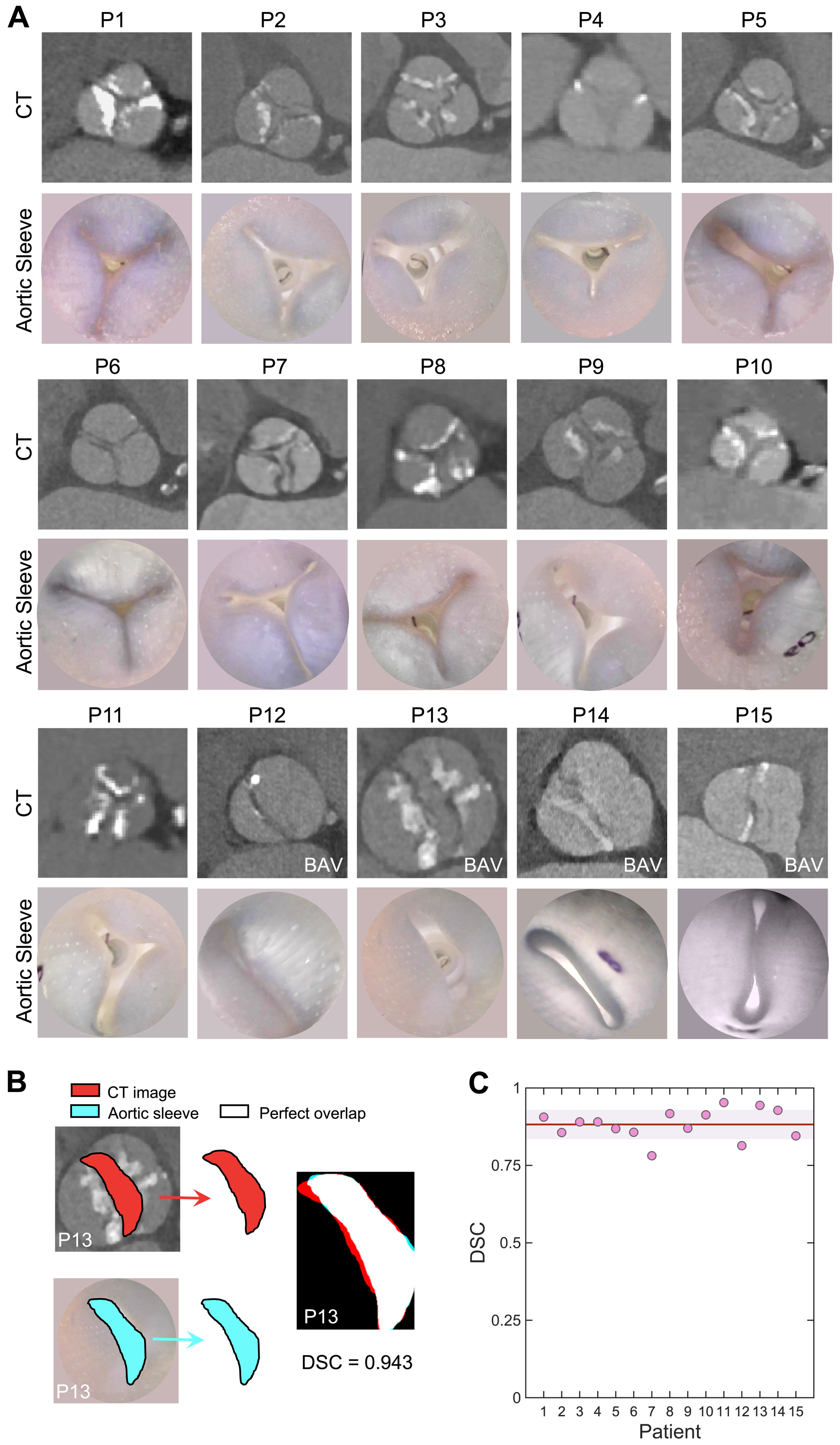
Изображение №2
Эти снимки демонстрируют, что созданный рукав может с высокой точностью воссоздать ряд анатомических структурных особенностей конкретного пациента, включая дегенеративный АС и порок ДАК. Затем КТ-снимки и снимки рукава аорты в области устья были наложены друг на друга для количественного сравнения и расчета коэффициента сходства Соренсена-Дайса (DSC от Dice similarity coefficient). На 2B показаны примеры этого сопоставления, где белая зона обозначает область полного перекрытия между двумя снимками, тогда как голубые или красные зоны обозначают области несоответствия.
Среднее значение DSC для 15 пациентов составило 0.88 ± 0.05 (2C), демонстрируя отличное перекрытие между морфологией нативного клапана, наблюдаемой на КТ, и созданным персонализированным рукавом аорты.
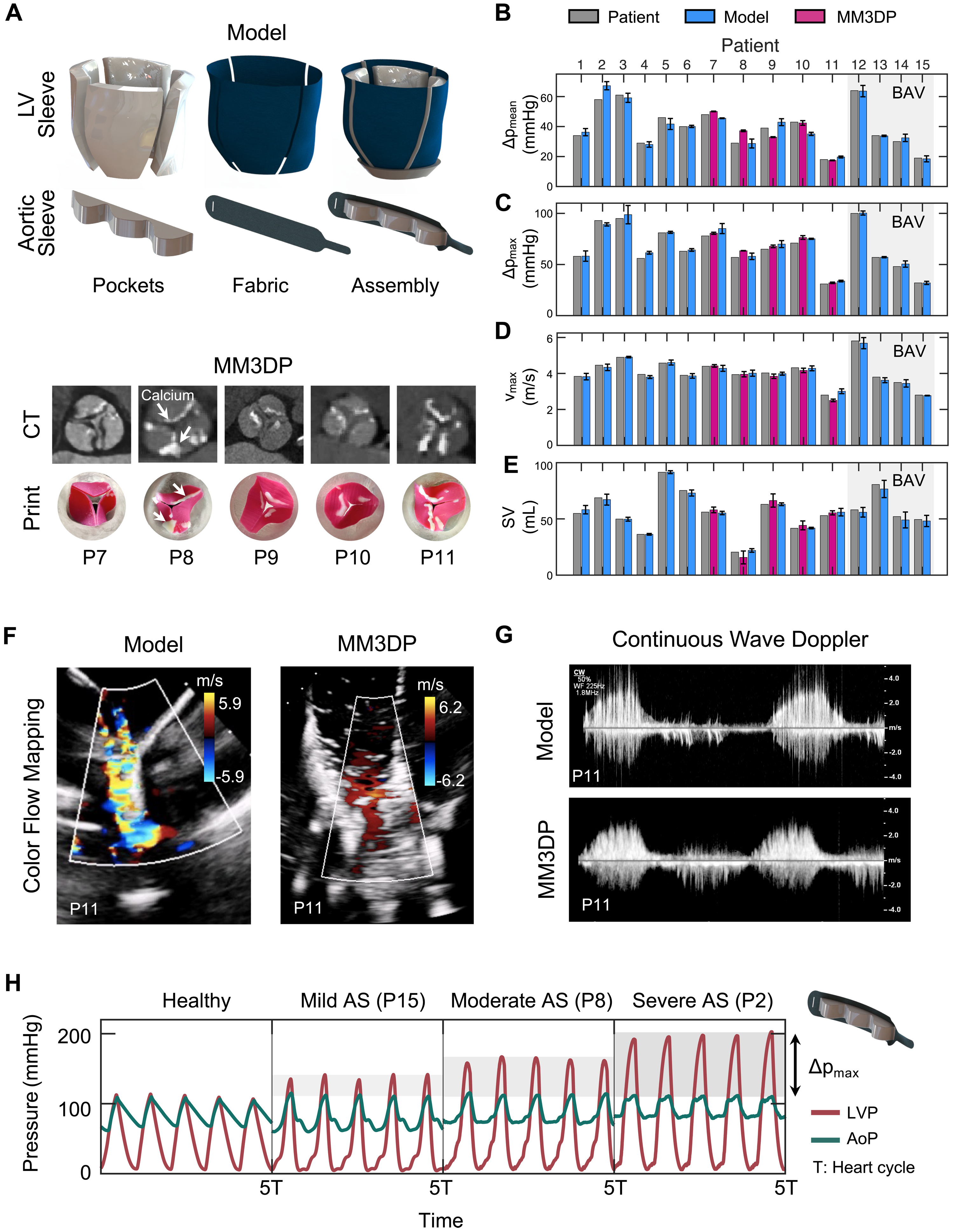
Изображение №3
Мягкий роботизированный аортальный рукав был способен генерировать гемодинамику аортального клапана, так как его строение полностью повторяло анатомию настоящего клапана пациента. Данная гемодинамика измерялась с помощью эхографии. Работоспособность модели (искусственного клапана) была подтверждена путем сравнения его параметров с клиническими показателями АС у пациентов.
Также было проведено сравнение производительность изучаемой модели с моделью, содержащей клапаны, изготовленные с использованием подхода MM3DP, когда используются жесткие компоненты в структуре устройства.
На 3A показаны снимки рукавов ЛЖ и аорты модели мягкого робота с выделением их основных компонентов, включая надувные карманы и неэластичную ткань. Тут же показаны и клапаны, для создания которых применялись жесткие компоненты.
Разработанная модель повторяла критические гемодинамические параметры АС с высокой точностью для каждого пациента. Для анализа ее работы ученые рассмотрели средний (ΔPmean; 3B) и максимальный (ΔPmax; 3C) трансаортальный градиент давления, пиковую скорость аортального потока (vmax; 3D) и УО (ударный объем; 3E).
Мягкая модель более точно соответствовала клиническим целям, со средним абсолютным отклонением в 7.7 ± 1.5% для всех показателей по сравнению с MM3DP моделью (13.9 ± 6.2%). Детальное сравнение отклонений по отдельным показателям мягкой модели (n = 15) и MM3DP модели (n = 5) показало следующие результаты:
Мягкая модель:
ΔPmean — 6.3 ± 5.6 %
ΔPmax — 9.8 ± 3.6 %
vmax — 7.5 ± 1.9 %
Ударный объем — 7.5 ± 1.9 %
MM3DP модель:
ΔPmean — 10.5 ± 11.3 %
ΔPmax — 11.3 ± 3.5 %
vmax — 10.6 ± 4.2 %
Ударный объем — 23.3 ± 8.3%
На 3F и 3G показаны цветовое картирование потока и доплеровские снимки, иллюстрирующие соответствующие профили скорости аорты, полученные для мягкой роботизированной модели и ее MM3DP аналога.
Видео №2
На видео выше показано сравнение эхокардиограмм мягкой роботизированной модели и MM3DP модели. А на 3H показаны кривые давления левого желудочка (LVP) и аортального давления (AoP) для здоровой физиологии и легкого (пациент 15; ΔPmax = 32.0 ± 1.6 мм рт. ст.), умеренного (пациент 8; ΔPmax = 58.0 ± 3.2 мм рт. ст.) и тяжелого (пациент 2; ΔPmax = 89.2 ± 1.6 мм рт. ст.) аортального стеноза.

Изображение №4
Далее ученые настроили рукав левого желудочка (ЛЖ) в соответствии с анатомией пациента и активировали его для воссоздания анатомического наполнения, опорожнения и движения стенки во время диастолы* (4A) и систолы* (4B и видео №3).
Диастола* — расширение полостей сердца (связано с расслаблением мышц предсердий и желудочков), во время которого оно заполняется кровью.
Систола* — сокращение левого и правого желудочков и выброс крови в аорту из левого желудочка и в легочный ствол из правого желудочка.Видео №3
Настройка давление срабатывания рукава ЛЖ во время диастолы позволяла модулировать податливость ЛЖ и диастолическую функцию (4C). Этот подход позволяет воссоздать повышение конечно-диастолического давления ЛЖ (4D), связанное с концентрическим ремоделированием, вторичным по отношению к аортальному стенозу.
Далее было проведено моделирование гемодинамики четырех пациентов с катетеризацией ЛЖ (пациенты 10-13), чтобы продемонстрировать способность мягкой роботизированной системы воссоздавать сердечную гемодинамику пациентов с различной степенью ремоделирования ЛЖ. График на 4E иллюстрирует PV-петли левого желудочка (PV от pressure-volume, т. е. давление-объем) здоровой физиологии и двух репрезентативных пациентов с диастолической дисфункцией (пациенты 10 и 12), подчеркивая изменения в отношении конечного диастолического PV (EDPVR от end-diastolic PV relationship) из-за ремоделирования. На 4F показаны наложенные друг на друга кривые LVP и AoP для здоровой физиологии и легкой (пациент 10; EDPVR = 18.0 ± 1.0 мм рт. ст.), умеренной (пациент 13; EDPVR = 27.6 ± 1.4 мм рт. ст.) и тяжелой (пациент 12; EDPVR = 35.4 ± 1.9 мм рт. ст.) диастолической дисфункции.
Измерения гемодинамики левого желудочка и аорты, в том числе конечно-диастолического давление ЛЖ (LVEDP; 4G), систолического давления ЛЖ (LVPS; 4H), фракции выброса левого желудочка (LVEF; 4I), систолического аортального давления (AoPS; 4J), диастолического аортального давления (AoPD; 4K) и среднего значение аортального давления (AoPm; 4L), а также ее сравнение с клиническими данными дополнительно подтвердили способность мягкой роботизированной системы создавать высокоточные модели гемодинамики ЛЖ и аорты для каждого пациента. Для каждого из этих показателей было рассчитано абсолютное отклонение от соответствующих клинических значений: 1.2 ± 0.9% (LVEDP), 0.6 ± 0.5% (LVPS), 3.8 ± 2.2% (LVEF), 4.6 ± 4.3% (AoPS), 2.1 ± 2.0% (AoPD) и 2.8 ± 2.6% (AoPm).
В совокупности вышеописанные результаты говорят о том, что разработанная система способна очень точно имитировать гемодинамику левого желудочка и изменения в его податливости, связанные с ремоделированием и диастолической дисфункцией, вызванной аортальным стенозом.

Изображение №5
Далее ученые применили свою разработку для прогнозирования гемодинамики после TAVR имплантации у пациентов с аортальным стенозом. В анализе участвовали пациенты, которым были имплантированы клапаны Evolut R и SAPIEN 3. На 5A показана схема клапана Evolut R, развернутого через дистальный конец напечатанного на 3D-принтере анатомического элемента, и деталь выходного отверстия клапана. Изменения в формах кривых LVP и AoP, а также в PV-петле левого желудочка для репрезентативного случая (пациент 6) до и после имплантации показаны на 5B и 5C. На этих графиках показана разгрузка ЛЖ с падением пикового давления и повышением ударного объема и пульсового давления в аорте.
Используя клиническую базу данных, ученые проверили гемодинамические данные после TAVR для пациентов с клапаном соответствующего размера (пациенты 3, 4, 6, 7, 11 и 14). На 5D и 5E показано сравнение клинических данных и модели до и после имплантации TAVR для ΔPmean и ΔPmax. Были обнаружены абсолютные отклонения ΔPmean = 4.3 ± 3.7% и ΔPmax = 15.7 ± 13.9% от клинических данных после имплантации. Это свидетельствует о том, что разработанная модель может точно предсказать гемодинамические изменения в результате лечения. Также были рассчитаны изменения эффективной площади отверстия (EOA; 5F; 0.9 ± 0.2 см2 по сравнению с 1.8 ± 0.4 см2), vmax (5G; 3.9 ± 0.7 м/с по сравнению с 0.7 ± 1.4 м/с) и ударного объема (5H; 53.2 ± 12.0 мл по сравнению с 76.4 ± 7.2 мл) до и после имплантации.
В заключение ученые провели исследование степени параклапанной утечки и регургитации в группе пациентов, получивших клапан меньшего размера (меньшего, чем надо), по сравнению с реципиентами протеза нужного размера. На 5I представлены репрезентативные допплеровские снимки цветового картирования потока для двух групп, подчеркивающие более значительную параклапанную утечку, связанную с имплантатами меньшего размера. Аналогично, расчет индекса аортальной регургитации (ARI от aortic regurgitation index) с помощью катетеризации показал менее оптимальную эффективность TAVR для группы с меньшим размером, чем для группы с клапанами соответствующего размера (5J; ARI = 22.0 ± 4.7 против 45.4 ± 7.8). Эти результаты полностью согласуются с данными из литературы, связывающими более низкие значения ARI с более высокой смертностью у пациентов с пороком аортального клапана.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые продемонстрировали мягкую роботизированную модель сердца человека, напечатанную на 3D-принтере. Особенность их разработки заключается в точной имитации гемодинамики реального сердца конкретного пациента.
Сначала ученые использовали КТ-снимки сердца пациента для их преобразования в трехмерную модель, которая потом использовалась для печати модели. Этим же методом ученые могли создать не только сердце, но и определенные его части, к примеру аорту. Чтобы достичь точной имитации работы сердца, ученые изготовили специальные рукава, напоминающие манжет тонометра. Этими рукавами обволакивали напечатанное сердце и аорту. Регулируя подачу воздуха в рукава, можно было регулировать сокращение сердца.
Если же наполнить воздухом рукав, который окружает аорту, то получится сужение сосуда, настройка которого может привести к точной имитации аортального стеноза. Данный дефект заставляет сердце работать с большей нагрузкой, чтобы проталкивать кровь. Лечение обычно предполагает имплантацию синтетического клапана для расширения естественного клапана аорты. Если учесть, что сердца отдельно взятых пациентов будут так же уникальны, как и их отпечатки, то использование напечатанной учеными модели может помочь медикам сначала протестировать тот или иной клапан перед его фактической имплантацией.
Ученые также отмечают, что их разработка будет полезна не только в трансплантологии, но и в исследовательской работе, направленной на поиски оптимального лечения тех или иных сердечных заболеваний. Имея в своем распоряжении модель сердца с широким спектром настроек его работы, исследователи смогут точно определять что и в каких случаях будет оптимальным методом борьбы с тем или иным дефектом.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
