В этом году в России каждый регион закупил минимум одну ИИ‑систему в здравоохранении. Где‑то выбрали предиктивную аналитику, где‑то — системы для работы с медицинскими изображениями. Но даже внутри одного направления конкуренция часто очень высокая — например, только по направлению рентгена лёгких в каталоге Московского эксперимента числится семь сервисов. Как выбрать лучшее решение? Фактически в ИИ в медицине сейчас не существует прозрачного процесса по выбору среди конкурирующих решений, и выбор происходит в лучшем случае по формальным критериям, в худшем — «по знакомству».

Есть ещё один понятный инструмент - это государственная сертификация. Регистрационное удостоверение на медицинское изделие Росздравнадзора в России, CE marking в ЕС, UKCA marking в Британии и, конечно, же FDA Approval в США. Казалось бы, если ИИ-система прошла такую сертификацию, то это доказывает её безопасность, эффективность и заявленные в клинических испытаниях метрики качества. Бери любую с хорошими подтвёрждёнными метриками точности - не прогадаешь. Конечно же, это очень далеко от правды, причём это верно не только для России - "FDA clearance of a model cannot serve as a reliable indicator of its performance in all radiology practices".
В этом тексте я хочу обсудить, как мы можем двигаться к более справедливой, осознанной и полезной для всех сторон процедуре выбора. Почти все примеры будут из сферы радиологии, но написанное в основном относится и к другим сферам ИИ в здравоохранении, да и к ИИ-системам в целом. Важно отметить, здесь я не буду особо затрагивать другой важный вопрос - как понять, а нужен ли вообще ИИ в той или иной ситуации? Полезные мысли на этот счёт можно почитать в гайде от британской NHS.
Если вы хотите узнать ещё больше об организации процессов ML-разработки, подписывайтесь на наш Телеграм-канал Варим ML
Обсудим:
Как бизнес-проблема влияет на выбор критериев качества
Как выбрать и разметить данные для тестирования
Как обеспечить честное сравнение ИИ-систем по выбранным метрикам
Какие особенности учреждения и региона важно не забыть
Какие ещё факторы могут влиять на выбор
Сценарий применения
Всем датасаентистам бы хотелось иметь единую магическую мега-метрику как на лидерборде Кеггла, которая могла бы проранжировать все модели по уровню качества. К сожалению, реальные задачи часто намного сложнее - и приходится использовать целый ряд метрик и страдать над многокритериальным выбором.
Когда мы выходим в продакшн, всё становится ещё сложнее - ведь процедура и критерии оценки ИИ-решения должны зависеть от предполагаемого сценария применения и роли системы в бизнес-процессах медицинского учреждения. К сожалению, на практике одни и те же метрики чаще всего кочуют из документа в документ без особого понимания, подходят ли они к конкретной ситуации.
Категоризаций сценариев использования медицинских ИИ-систем существует великое множество. Достаточно простая и разумная приводится в этой статье. Все ИИ-системы в радиологии можно разбить на три группы по их роли:
Триаж. Классический триаж - это разбиение пациентов на несколько групп по срочности необходимых медицинских мероприятий. ML-модели позволяют делать это ещё детальнее - можно сортировать пациентов по вероятности патологии или другим признакам. Такая сортировка может потом использоваться для оптимизации рабочего процесса врача (срочных пациентов можно смотреть в первую очередь или автоматически отправлять на дополнительное обследование) или распределения пациентов по врачам разной квалификации и специализации.
Системы поддержки принятий решений. Сюда можно включить все вспомогательные сценарии применения, при которых врач пользуется результатами работы ИИ-системы, но самостоятельно принимает все решения. Примеры - подсвечивание сложных областей интереса (например, подозрительных микрокальцинатов на маммографии), чтобы врач не пропустил их при высокой загруженности; оценка дополнительных параметров и автоматизация рутинных измерений (плотность молочной железы, объём кровоизлияния) и многие другие задачи (распознавание голоса и автоматическое заполнение протокола).
Автоматизация. Самый страшный для всех врачей сценарий - частичная или полная замена человека ИИ-системой, в статье он так и называется - replacement. Это, например, автоматическое определение исследований, где с близкой к 100% вероятностью нет никаких патологий - и автоматическая генерация протоколов для таких исследований.
Есть ещё отдельная большая категория "менеджерских" ИИ-систем - например, прогнозирование объёма исследований на период, предсказание пропуска процедур пациентами, чат-боты для ответов на частые вопросы пациентов.
Логично предположить, что важность разных критериев и метрик будет очень сильно отличаться для разных сценариев. К примеру:
Для триажа, вероятно, важнее всего будет возможность ML-системы корректно сортировать пациентов по степени риска (ROC-AUC для бинарных предсказаний, MA-MAE для ординальных шкал) и количество некорректных определений пациентов с высоким риском в низкие группы (чувствительность). При ретроспективном анализе (пересмотр большой выборки исследований) на первый план может выйти минимизация ложноположительных срабатываний (специфичность, precision).
В ССПВР в зависимости от конкретного применения могут играть ключевую роль количество ложных срабатываний (FPR, FROC-AUC), качество локализации (mAP, DICE, OC-cost, Hausdorff Distance), корректность оценки размеров (MAE), скорость работы системы и многие другие показатели.
В сценарии автоматизации критическими становятся пропуски патологий системой, но важен и процент исследований, которые система может корректно отсеять как не содержащие патологию. Поэтому здесь может подойти метрика Specificity@(Recall = 1.0) - специфичность при фиксированной стопроцентной чувствительности.
Ещё одна вещь встречается постоянно, что меня ощутимо расстраивает. Представьте, что заказчик хочет использовать ИИ-систему для минимизации пропусков случаев рака на скрининге. Он приходит к двум вендорам, запрашивает демо-доступ без объяснения своего сценария применения и проводит на ИИ-системах с настройками "из коробки" мини-тест с такими результатами:

Какая система лучше? Вопрос с подвохом, без знания сценария применения ответить сложно. Но кажется, что ИИ-2 как минимум не хуже - ROC-AUC повыше, высокая чувствительность, неплохая специфичность, F1-score выше. Но неискушённый в ML заказчик почти наверняка предпочтёт ИИ-1, потому что для его сценария он подходит лучше - ведь не пропускает рак! А ведь если бы ИИ-2 быстро донастроили под сценарий заказчика - результаты могли бы быть совсем другими. Вывод - рекомендую в самом начале максимально подробно описать свой кейс использования и шарить его с ИИ-вендором в самом начале диалога о потенциальной покупке. Вот хороший пример того, как можно описывать кейсы использования.
У кого-то здесь появится логичный вопрос: а почему речь идёт только об ML-метриках, если в итоге нам важно другое - сэкономленные деньги, спасённые жизни, снижение нагрузки на врачей? Всё так, только вот в рамках процедуры тестирования оценить эти показатели очень тяжело, по крайней мере на текущий момент развития отрасли. О некоторых причинах я говорил вот в этом видео. Да, есть пилотные проекты, об их достоинствах и недостатках поговорим чуть позже. ML-метрики могут хорошо коррелировать с бизнес-метриками - но как раз только если были учтены все факторы.
Подводя итог, копировать вслепую ТЗ или выбирать систему по какой-нибудь общепринятой метрике - не очень хорошая практика. Процедура оценки должна учитывать проблему, которую должна решить ИИ-система, и ключевые бизнес-показатели, по которым будут оцениваться результаты.
Базовые вопросы, которые помогут правильнее подобрать метрики и датасеты:
Какую бизнес-проблему должно решить внедрение ИИ-системы?
Кто является конечным пользователем - терапевт, рентгенолог, пациент, заведующий отделением, администратор?
Какие последствия будут при ошибках в работе ИИ-системы?
А в этой статье содержатся рекомендации по выбору конкретных ML-метрик для разных задач.
На чём тестируем?
Если принято решение идти путём внутреннего тестирования (об альтернативах - в следующей секции), то следующий шаг - создание размеченного набора данных для ретроспективной оценки.
Первая важная задача - выбор исследований, которые будут использоваться для тестирования. Не хочется повторять здесь простые истины про баланс классов и размер выборки, поэтому отсылаю вас к секции Independent Evaluation Performance Assessment и к секции Evaluating AI Models Using Site-Specific Data. Ещё можно обратиться к многолетней практике московского Эксперимента или к ГОСТу по тестированию.
Кроме метрик решаемая проблема и сценарий использования влияют и на выбор правильного датасета (а иногда и нескольких датасетов) для тестирования. Если ИИ-система используется для снижения количества пропусков на сложных и малозаметных случаях, то и измерять метрики в первую очередь нужно на таких кейсах, а не на видных для любого врача случаях. В зависимости от задачи при подборе датасета стоит учитывать разные факторы - баланс классов, демографические показатели, тип оборудования.
Разметка
Самый простой и популярный вариант - сделать выборку ранее описанных врачами исследований и выделить из них нужную разметку - например, наличие/отсутствие патологии, категория по шкале, объём поражения. Если нужные данные хранятся в RIS отдельно - повезло, если нет - придётся расчехлять какие-нибудь NLP-методы для выделения нужной разметки.
Если хочется посчитать более хитрые метрики локализации, то придётся делать дополнительную разметку. Медицинские организации крайне редко идут таким путём - из-за сложности, дороговизны и, видимо, не очень высокой ценностью по сравнению с первым методом.
Наконец, ещё один нередкий вариант - не делать разметку вовсе. В этом случае врач от организации глазами отсматривает результаты работы ИИ-системы и в конце выносит свой вердикт в свободной форме. При всём уважении к врачам использовать такой метод оценки как единственный я не рекомендую. Таким способом сложно оценить работу системы на датасетах немаленького размера, да и всякие primacy/recency эффекты действуют на всех независимо от квалификации.
Результаты тестирования практически всегда выявят какие-то расхождения между разметкой врачей и ИИ-системы. Какие у этого могут быть причины?
Ошибки в работе ИИ-системы. Да, так бывает, ИИ-системы ошибаются, какие-то чаще, какие-то реже. Это самый понятный тип ошибки, и это первый кандидат на объяснение расхождений. При этом ошибки могут иметь разную степень критичности - и это редко учитывается при оценке. Например, в нашем любимом Эксперименте при клинической оценке используется такая шкала: 1 - полное совпадение, 0.5 - неверная трактовка или локализация, 0.25 - ложное срабатывание, 0.0 - пропуск патологии. Впрочем, часто и пропуск пропуску рознь.
Data shift. ИИ-системы предназначены для работы с входными данными с заданными характеристиками. Если внезапно в тестовом наборе данных оказался ребёнок, а система обучена на снимках взрослых - вряд ли можно ожидать на этом исследовании хороших результатов. Включение таких "необычных" данных может помочь выявить несоответствия между ожиданиями медучреждений и возможностями ИИ-сервисов (об этом подробнее позже).
Ошибки врачей. Да, врачи - тоже люди и могут ошибаться. Мы натыкались на такие случаи, когда своими силами делали верификацию разметки, которую использовал потенциальный клиент. В определённых случаях даже небольшой процент ошибок может ощутимо повлиять на восприятие результатов тестирования заказчиком. Одно из решений - разметка несколькими врачами.
Ошибки выгрузки данных. Если для получения разметки из текстовых протоколов использовались автоматические средства (регулярные выражения, ML-модельки), то с большой вероятностью найдутся случаи с ошибками.
Разное понимание задачи у ИИ-системы и врача. Самая интересная и, возможно, наиболее важная причина. Расхождение между врачом и ИИ-системой может быть вызвано тем, что в них изначально закладывали разное понимание того, что такое - норма, а что - патология. Например, в некоторых учреждениях будут ожидать, что на рентгене органов грудной клетки ИИ-система отметит консолидированные (то есть, сросшиеся) переломы и инородные тела, а в других сочтут это лишним или даже ложным срабатыванием. Таких примеров много - спорные категории (типа Bi-Rads 3 на ММГ), плавающие пороги (размер лёгочных узлов, объём паракардиального жира).
Для особо продвинутых медицинских организаций могу порекомендовать провести совместный аудит ошибок с ИИ-вендором, особенно если вы всё-таки приняли решение о покупке - это может быть простым путём к улучшению результатов при реальной работе - иногда можно просто перекалибровать систему или убрать какие-то патологии из списка важных.
А у тебя точно АУК 0.99?
Окей, метрики выбраны и, может быть, даже собран размеченный набор данных. Как теперь обеспечить честную процедуру тестирования? Рассмотрим разные варианты - примерно в порядке возрастания сложности и временных и денежных затрат.
Выбор на основе данных производителя
Начнём с самого плохого, но существующего варианта - идём на сайты компаний или в РУ, выбираем ту, у которой выбранная нами метрика максимальна, и пишем под них ТЗ. Думаю, не надо объяснять, что сайт компании - не очень хорошее место для получения такой информации. Даже если там удастся найти какие-то немаркетинговые числа, то справедливо сравнить таким образом разные системы невозможно. Разные датасеты, разные аутпуты системы - думаю, долго на этом останавливаться не надо.
При этом отмечу, что наличие детальной публичной документации, описание текущих известных разработчикам проблем, реестр некорректных срабатываний, наличие публикаций о проведённых ранее исследованиях, нерекламные выступления на конференциях - всё это положительным образом говорит о разработчике ИИ-системы и увеличивает вероятность высокого качества и добросовестного подхода. Есть вот такие проекты, которые агрегируют информацию о научных публикация о ИИ-сервисах.
Плюсы:
Очень дёшево и быстро
Минусы:
Очень слабо, а иногда даже отрицательно коррелирует с реальными результатами ИИ-системы в вашем учреждении
Независимая оценка
В этом случае мы опираемся на чужой опыт - смотрим, как ИИ-система проявила себя в схожих сценариях работы.
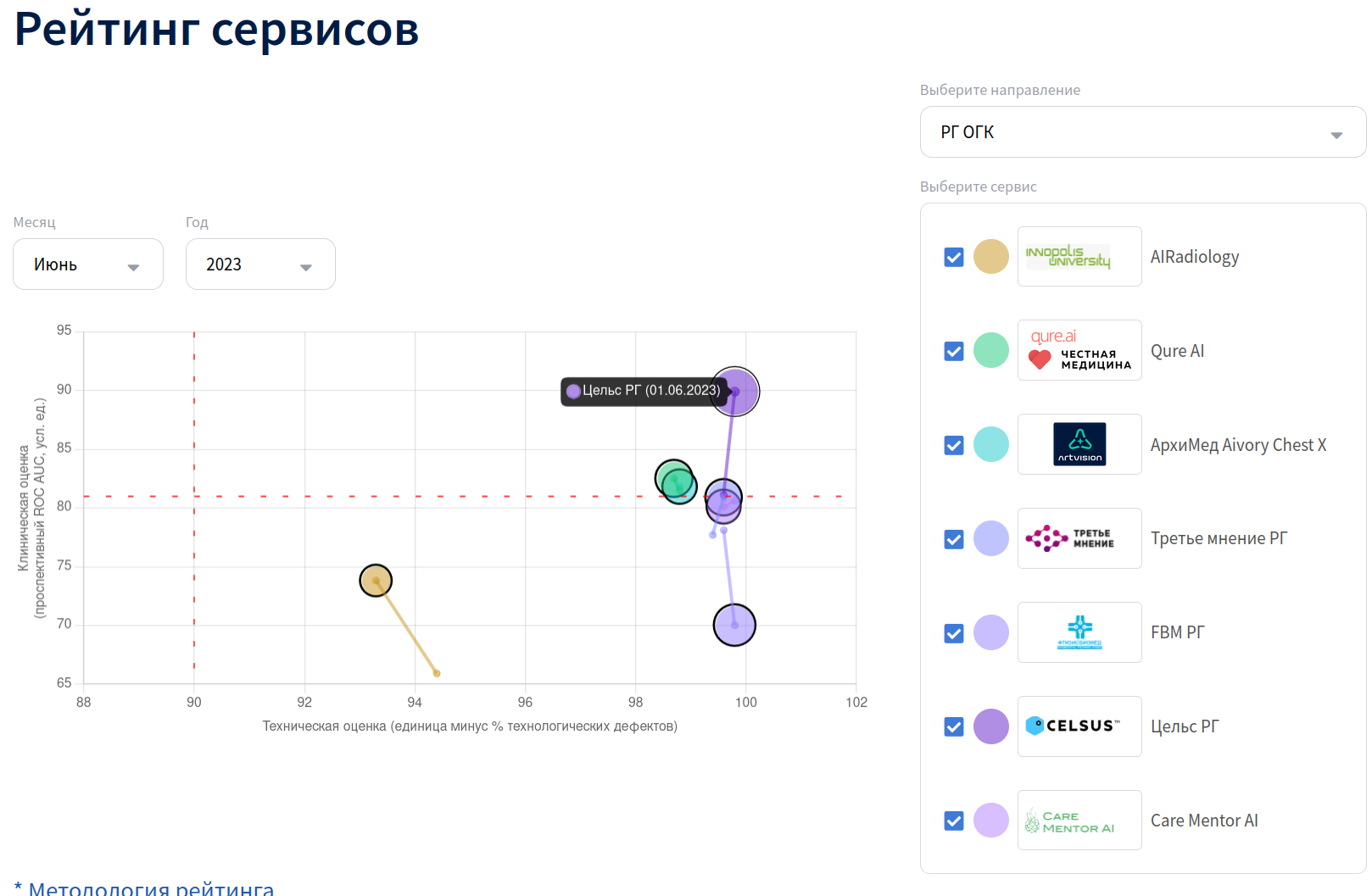
В России есть очень неплохой вариант - изучить результаты работы ИИ-системы в рамках московского Эксперимента. Несмотря на экспериментальный статус, в его рамках ИИ-сервисы обрабатывают реальные исследования, и результатам обработки пользуются реальные врачи. Организаторы регулярно публикуют так называемую "матрицу зрелости", которая даёт представление о качестве сервиса с трёх позиций:
Проспективный ROC-AUC (ось ординат) - рассчитывается на всём потоке обработанных исследований, за Ground Truth берётся мнение описывающего исследование врача (норма или патология)
Клиническая оценка (диаметр круга) - ежемесячная оценка на сбалансированной выборке из 80 исследованиях, оценивается качество классификации и локализации, производится врачом-экспертом
Процент дефектов (ось абсцисс) - технический показатель, сколько исследований по формальным критериям ушли в брак обработки
Насколько мне известно, в других странах пока экспериментов подобного масштаба и глубины проработки нет, но кое-где государственный регулятор ведёт общий каталог ИИ-сервисов. А в США и Великобритании можно обратиться к ACR и NHS соответственно с целью получения независимого заключения о качестве работы сервиса (полагаю, что за отдельную плату).
Ещё один вариант - обратиться за отзывами в другие медицинские организации, где использовалось или пилотировалось данное решение.
Плюсы:
Независимая оценка качества работы системы
Не нужно иметь опыта работы с ИИ-системами и экспертизы по их оценке
Минусы:
Не тестируемся на собственных данных, так что реальные результаты могут быть хуже - слегка или сильно
Передача датасета производителю
В этом сценарии мы готовим собственный датасет и передаём его производителю, а он через какое-то время возвращает нам результаты обработки. Совместив их с нашей разметкой, можно посчитать необходимые метрики.
Плюсы:
Дёшево и быстро
Минусы:
Нужно создавать свои датасеты для тестирования, и для каждого производителя он будет работать ровно один раз
Нужно очень сильно доверять производителю, потому что велико пространство для мухлежа
В любом случае требуется предварительная анонимизация данных
Платформа для тестирования
Бурный рост количества производителей ИИ-систем, естественно, привёл к появлению различных платформ и маркетплейсов. Некоторые из них были созданы известными производителями PACSов, а другие были разработаны специально под ИИ в радиологии.
Схема работы очень простая - медицинские учреждение интегрируется с платформой, по инструкции создаёт свой набор данных с разметкой, а платформа формирует сводный отчёт результатов работы разных производителей. Часто такие платформы организуют полный цикл - она может использоваться для интеграции с ИИ-системой и после тестирования и выбора лучшего решения.
Плюсы:
Требуется интеграция только с платформой, а не с отдельными производителями
Очень быстро можно получить сводные результаты по россыпи производителей
Если ИИ-сервис развёрнут на платформе, то данные не попадут к разработчикам
Минусы:
Нужно создавать свои датасеты для тестирования
Если это коммерческая, а не государственная платформа, то нужно отвалить денежку
Не каждый потенциально интересный ИИ-вендор будет представлен на платформе
Интеграция и ретроспективная валидация
Если такой платформы в стране нет, то придётся интегрироваться отдельно с каждым потенциально интересным вендором. Именно так чаще всего поступают коммерческие клиники в России. На бумаге интеграция по DICOM-протоколу очень проста, но на практике часто возникают всякие сложности - инфобез, сетевые проблемы, пропадающие админы и так далее. Альтернативно - при наличии веб или десктоп-приложения производитель может передать доступы для проведения тестирования.
Важное замечание, которое относится не только к этой схеме тестирования - в сфере здравоохранения действительно очень разнообразные и неочевидные данные. Иногда даже качественная система может показать плохие результаты из-за непредвиденной глупой ошибки - например, на ваших данных некорректно сработал алгоритм выбора серии. Если есть время и возможность - лучше всего предоставить ИИ-вендору небольшой пак (3-7 исследований) с вашими данными, чтобы заранее проверить корректность обработки и не тратить время на полноценный тест в случае необходимости доработок.
Плюсы:
Нет ограничений по списку производителей
Минусы:
Нужно создавать свои датасеты для тестирования
Временные затраты на интеграцию или установку приложения
Тяжелее обеспечить честность и прозрачность - в зависимости от конкретного процесса тестирования производитель ИИ-системы может иметь больше или меньше возможностей для обмана
Пилотные проекты
Наконец, самое тяжеловесное решение - полноценный пилот с тестовым внедрением ИИ-решения в бизнес-процессы организации. Ещё один вариант - shadow deployment с параллельной интерпретацией всех исследований врачом и ИИ-системой.
К сожалению, для по-настоящему успешного и полезного пилотного проекта должно сойтись много факторов - заинтересованность персонала, поддержка сверху, понятные цели. Часто же такие пилоты проводятся, чтоб поставить какую-нибудь галочку или получить официальный отзыв.
Плюсы:
При правильной организации можно замерить не только проспективные ML-метрики, но и что-то более близкое к бизнесу
Персонал получает возможно протестировать удобство работы с системой
Минусы:
Долго и недёшево
Большой простор для ошибок в организации
Требуется заинтересованность и вовлечение персонала
На реальных проспективных данных сложно получить вменяемые результаты для очень редких патологий, так что может понадобиться отдельный ретроспективный тест
Особенности национальных дайкомов
Выше я несколько раз отдельно подчеркнул важность тестирования системы на собственных данных. Однако, во многих случаях даже этого недостаточно - нужен отдельный тест, который проверит устойчивость системы к разным хитрым изменениям входных данных.
В России решение о покупке ИИ-систем чаще всего принимается на уровне всего региона, а регионы у нас большие - часть больниц находится в крупных городах, часть - в удалённых посёлках. Возраст и качество оборудования, а также скиллы лаборантов в этих организациях могут быть, так сказать, разными. Демографический состав тоже может сильно отличаться - как между целыми странами и регионами, так и внутри одного субъекта.
Всё это значит, что может быть полезно выделить в отдельный блок тесты на робастность и генерализуемость ИИ-систем. Здесь хочу привести примеры таких тестов. Это вовсе не означает, что их нужно проводить все и всегда, но точно стоит подумать об актуальных для вашего случая.
Устойчивость к аугментациям
Зачем - позволяет оценить общую устойчивость модели, коррелирует с робастностью моделям к доменным сдвигам.
Примеры - геометрические трансформации (флип, сдвиг, зум, поворот), пиксельные трансформации (яркость, контрастность, блюр, шумы).
Как - берём любой тестовый датасет, накладываем случайные аугментации (по одной или случайную из списка) с заданной интенсивностью и измеряем метрики.
Устойчивость к adversarial samples
Зачем - позволяет оценить устойчивость модели к атакам злоумышленников, коррелирует с общей устойчивостью модели.
Примеры - невидимые шумы, подобранные с помощью методов PGD, FGSM, UAP.
Как - берём любой тестовый датасет, для каждой картинки подбираем adversarial sample. Виды атак - black-box (доступ только к ответам модели на наборе данных), white-box (доступ к весам модели).
Общая генерализуемость
Зачем - позволяет оценить генерализуемость модели на сценариях работы из реального мира и качество работы системы на важных подвыборках данных.
Примеры - наборы данных из разных больниц и с разного оборудования; исследования с патологиями, которых не было в обучающей выборке; сдвиги по демографии и анатомии - пол, возраст, раса, особенности анатомического строения; редкие кейсы - импланты, удалённые органы; любые другие релевантные для модальности сдвиги.
Как - расчёт метрик (общих и по подгруппам) на специально подобранных датасетах, статистические тесты разницы в метриках для разных подгрупп.
Устойчивость к протоколу сбора изображений
Зачем - позволяет оценить устойчивость модели к параметрам процесса получения медицинских изображений.
Примеры - пониженная радиационная доза, разная степень компрессии органа. Больше примеров - тут.
Как - расчёт статистической значимости разницы в метриках для разных категорий.
Устойчивость к артефактам
Зачем - позволяет оценить устойчивость модели к часто встречающимся для модальности артефактам.
Примеры - посторонние предметы на изображении, засветы, некорректная укладка.
Как - расчёт стандартных метрик и визуальный анализ результатов обработки.
Проверка возможности обработки исследований с неверной мета-информацией
Зачем - позволяет оценить возможность работы модели на исследованиях с пропущенными или неверно заполненными DICOM-тегами.
Примеры - пропущенные или неверно заполненные теги модальности, части тела, стороны, проекции, спейсинга.
Как - проверяем возможность и корректность обработки на исследованиях с разными проблемами. Можно взять имеющийся датасет и в нём затирать или изменять теги.
Проверка корректности работы алгоритма по выбору серии
Зачем - позволяет оценить корректность работы системы в случае наличия в исследовании нескольких снимков или серий.
Примеры - снимки разных проекций (прямая и боковая), серии с разным кернелом или спейсингом, снимки разных частей тела, бракованные снимки вместе с нормальными.
Как - посылаем архив с несколькими исследованиями в систему и смотрим, какое изображение или серия были выбраны. Также полезно проверить поведение системы, если в архиве содержится только "плохие" серии - в идеале модель должна вернуть ошибку.
Другие факторы
Высокие диагностические метрики - это, конечно, очень важно. А какие ещё факторы могут влиять на выбор ИИ-решения? Ещё подробнее об этом можно почитать, например, в этой статье.
Наличие нужной сертификации - во многих сценариях использования ИИ-решение должно быть зарегистрировано как медицинское изделие с правильным классом риска. К сожалению, пока законодательство немного отстаёт от реальности, и поэтому ИИ-системы регистрируются по тому же процессу, что и другие медизделия. А это значит в числе прочего, что на каждую новую версию модельки нужно получать новое РУ, что может занять 6-12 месяцев...
Сложность интеграции - в идеале процесс интеграции в IT-инфраструктуру медицинской организации должен быть максимально простым и занимать минимальное время.
UX (визуализация находок и текстовый отчёт) - фактор, который легко недооценить. Какое-то время назад мы первые удовлетворили новым требованиям по метрикам в Эксперименте по направлению рентгена лёгких и остались единственной работающей системой. Некоторые врачи стали спрашивать, а когда вернутся системы других производителей. Оказалось, что по качеству работы к нам претензий нет никаких, но у конкурентов просто более удобная панель отображения результатов. Задумались.
Скорость работы - для сценариев экстренной медицины это критический показатель, но и при обычном использовании в формате СППВР вряд ли врачам хочется ждать результатов обработки по 10-15 минут.
Варианты деплоя - для некоторых медицинских учреждений критична возможность on-premise деплоя. Хотя для разработчиков облако, конечно, в разы удобнее.
Интерпретируемость - в научных статьях часто пишут исключительно о классификационных метриках. Но в реальности системы без возможности локализации находок применяются разве что при ретроспективном анализе.
Обучение пользователей - для наиболее эффективного использования ИИ-систем может понадобиться дополнительное обучение персонала. Начиная от банального "куда нажимать", заканчивая демонстрацией проверенных вариантов использования и известных проблем.
Стоимость - даже в такой сфере как здравоохранение не уйти от экономики. Если одно решение лучше другого по какой-нибудь метрике на 5 пунктов, но дороже в 10 раз - что делать? Конечно же, зависит от сценария применения и от задач конкретного учреждения и сферы здравоохранения в целом.
Техподдержка, мониторинг ошибок и обновления - это тема для отдельного обсуждения, но ИИ-системы фейлятся. Фейлятся громко (падают сервера, вылетают баги в апишках) и тихо (например, при дрифте данных или просто на сложных случаях). А это значит, что их нужно мониторить, чинить и по возможности обновлять. Как выстроена система мониторинга, входят ли в стоимость обновления? Всё это стоит узнать заранее.
Fairness - в России эта тема обсуждается разве что на заседаниях комитетов по этике, но вообще ИИ-системы действительно теоретически и практически способны дискриминировать разные группы населения. Особенно важно это для сценариев автоматизации и триажа.
Отношения с вендором - звучит не очень справедливо и монополистично, но если вы уже пользуетесь ИИ-системой одного производителя, то часто проще и дешевле для вас будет купить и другие системы у него же. Уже есть доверительные отношения и отточено техническое взаимодействие.
Подведём итоги
Итак, что нужно сделать, чтобы не ошибиться при выборе ИИ-системы?
Чётко понимать, зачем мы хотим её купить и внедрить, а также как мы будем её использовать
Хорошей идеей будет обратиться к экспертам в отрасли или регуляторе, чтобы правильно организовать процесс тестирования и выбрать нужные метрики и данные
Брать чужое ТЗ и копировать все критерии - плохая идея. Проводить все возможные тесты - плохая идея. Формировать набор критериев и тестов под свой случай - хорошая идея
Смотреть на чужой опыт - это полезно, но ИИ-система, умеренно себя показавшая в одном случае, может быть идеально подходящей для вашего случая
Прозрачная коммуникация с ИИ-вендором - главный шаг на пути к успешному внедрению
Если вы хотите узнать ещё больше об организации процессов ML-разработки, подписывайтесь на наш Телеграм-канал Варим ML
Комментарии (3)

AlexVist
21.09.2023 14:54Медицина, это одна из самых сложных отраслей для автоматизации. И тут все совершают простую ошибку. Ни одна система для медицины не соответствует понятию клинического мышления. Того инструмента, которым и руководствуются врач. Если врачу предоставлять только выводы, то теряется основа, на которой эти выводы сделаны. Обратная сторона медали заключается в том, что врач перестаёт полагаться на свои знания. Просто использует выводы. Более худший сценарий, который я знаю, это административное требование использовать такие системы. И, более того, полагаться на выводы этих систем. В случае не согласия с ии применяются такие же административные меры - лишение части зарплаты или увольнение. Эту сторону медали принято замалчивать. Но она так же вносит свои результаты в качество ии систем.)

imageman
Одна из немногих статей, в которой уделяется внимание робастности. В реальности (особенно в промышленных системах, которые работают десятилетиями) это очень важный фактор. Программа (система) должна должна как минимум сказать "Эй, у тебя какие-то странные данные, я не могу их адекватно оценить, извини". Вместо этого (как я подозреваю) многие системы будут бодро нести правдоподобную ерунду. В идеале, конечно, хочется видеть системы с самонастройкой или с простым дообучением.
crazyfrogspb1 Автор
с дообучением пока туго, и по техническим, и по юридическим, и по организационным причинам. а вот элементы адаптации есть - например, в препроцессинге изображений. и да, на практике лучше вообще не дать ответ, чем выдать чушь