Введение
CRISPR – это революционная технология генной инженерии, которая позволяет точно редактировать ДНК. Применение его в генотерапии может изменить жизнь миллионов людей с генетическими заболеваниями и миллиардов – с приобретенными. В этой статье я рассмотрю историю применения CRISPR в генотерапии, последние научные достижения и исследования, а также регуляторные и правовые аспекты, связанные с применением этой технологии.
А также выясним, от чего клиники генотерапии еще не начали открываться повсюду как стоматологии и какой потенциал есть у индустрии генотерапии в России.
I. Вновь о старом – что такое CRISPR?
CRISPR - – аббревиатура ставшая именем нарицательным для целого ряда различных систем редактирования генома. Будь то напрямую редактирование генов, нацеливание на РНК или же косвенно, меняя эпигенетический ландшафт через метилирование.[1-2]
По иронии, конкретно CRISPR в интересных людям манипуляциях не задействован вовсе. И за пределами теоретических исследований представляет мало практического интереса в генной инженерии.
Аббревиатура CRISPR за собой кроет малопонятный для незнающего человека набор слов – Clustered Regularly Interspaced Short Palindromic Repeats - Короткие палиндромные повторы, регулярно расположенные группами.
Представляют из себя они не более, чем базу данных молекулярной иммунной системы. Которой изначально являлось большинство родичей белкового комплекса CRISPR Cas9, столь полюбившегося человечеству.
По сути,это расположенная в геноме библиотека встреченных ранее угроз, что были расчленены беспощадными эндонуклеазами. Представляющая из себя небольшие, оставшиеся после резни ошметки, оставленные как трофей на память.
Нельзя сказать, что наш интерес ограничен исключительно тандемом CRISPR Cas9, где по факту мы используем только Cas, РНК-направленную эндонуклеазу. Однако, Cas9 не беспричинно самый знаменитый из этого плодовитого семейства белковой машинерии. По функционалу, это буквально молекулярные ножницы, излюбленные биотехнологами своей простотой выбора цели и точностью работы.
Все, что требуется эндонуклеазе Cas9 и в чем ее общая черта со всеми ее собратьями, это РНК-направленность. Целенаведение этого фермента в сути своей похоже на то, как два парных кубика лего входят друг другу в пазы, направляющая РНК (gRNA), прикрепляется к комплементарному ей участку ДНК, и уже по этой направляющей работает белковый комплекс.
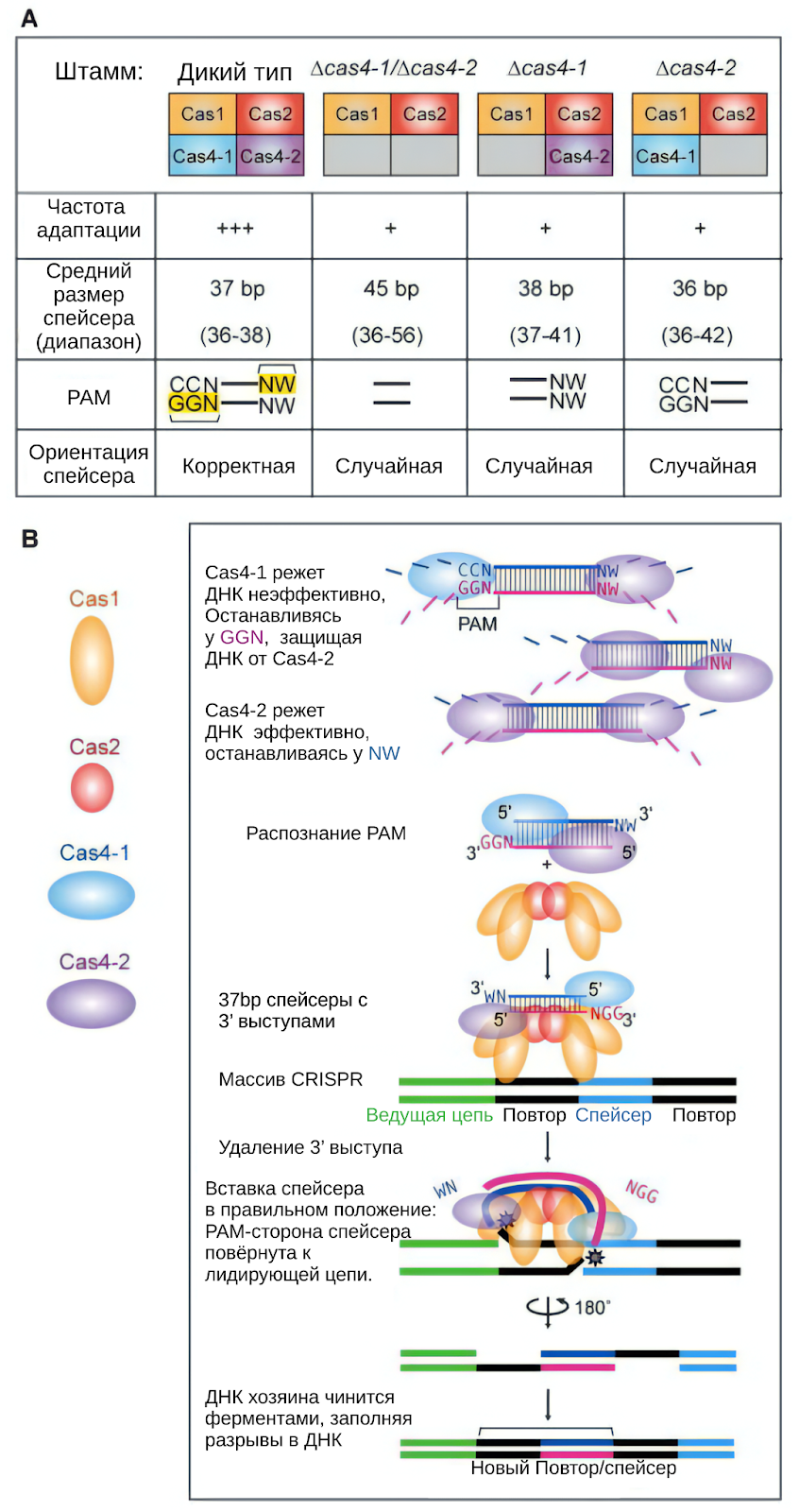
Как уже упоминалось, молекулярные ножницы в виде эндонуклеаз могут быть нацелены на конкретные участки ДНК или РНК, а также участвовать в метилировании. Не так давно, было обнаружено, что гены с помощью CRISPR могут не только вырезаться, но и вставляться. Этот механизм отличается от палиндромных повторов, связанных с CRISPR, и комплекса Cas4-Cas1-Cas2, ответственного за вставку новых повторов в локус CRISPR. [3]
Новый класс систем позволяет точнее вставлять гены с использованием направляющей РНК, решая проблемы традиционных систем CRISPR и открывая новые возможности для редактирования генома. Но подробнее об этом будет в следующих статьях цикла.
II. CRISPR за работой.
Разговоры о том что можно, и возможно будет сделать когда-нибудь в будущем впечатляют, но что в настоящем? Дошло ли хоть что-то до клинической практики или хотя бы испытаний? Вновь ли повезло лабораторным мышам и крысам, первее всех на свете получить очередную чудо-терапию, после первого упоминания которой она все также лет 10 на одних грызунах и будет испытываться? Или же и того скромнее, ограничились опытами на клеточных культурах да микро-органоидах?
Подобная ситуация, когда везде сплошь обещания, а результата все нету, разочаровывает, прекрасное далеко все маячит на горизонте, так никогда и не наступая. Дабы развеять хоть частично эту удручающую атмосферу, окружающую плотной пеленой любую технологию которая должна столкнуться с 9 кругами академических исследований, этических комитетов и легионов бюрократов из министерства здравоохранения, приведем некоторые из примеров где CRISPR все таки удалось прорваться до терапии на человеческих пациентах.
I. Лулу и Нана
Событие, вызвавшее множество дискуссий в области биоэтики в 2018 году, связано с рождением двух близняшек, Лулу и Наны. Эти дети, родившиеся в октябре 2018 года, согласно заявлениям ученого ответственному за их появление на свет, могут обладать врожденной устойчивостью к ВИЧ. Однако, данное утверждение всё ещё требует дополнительных подтверждений.
Китайский ученый по имени Хэ Цзянькуй использовал технологию редактирования генов CRISPR для создания первых в мире генетически модифицированных, дизайнерских детей.
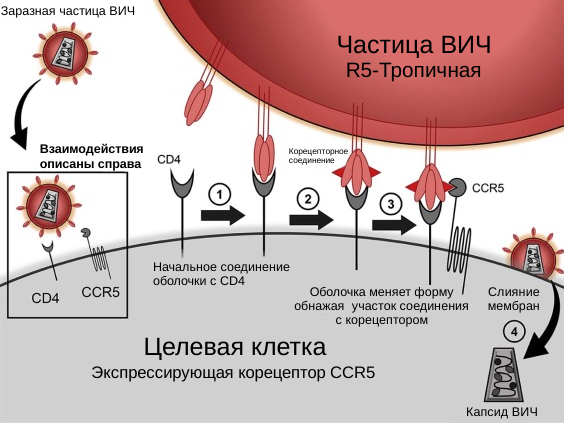
Хэ Цзянькуй использовал CRISPR для редактирования генов эмбрионов, которые в конечном итоге стали Лулу и Наной, с целью придания им устойчивости к ВИЧ. В частности, он использовал CRISPR для отключения гена под названием CCR5, который кодирует белок, позволяющий ВИЧ проникать в клетки человека. CCR5 и CXCR4 являются двумя основными ко-рецепторами, которые использует ВИЧ для входа в клетки хозяина. CCR5, в частности, играет ключевую роль в ранних стадиях инфекции, в то время как CXCR4 становится более важным на поздних стадиях.
Выполнив нокаут гена CCR5, Хэ Цзянькуй надеялся сделать близнецов невосприимчивыми к ВИЧ-инфекции.[4]
Однако, стоит отметить, что некоторые штаммы ВИЧ могут использовать другой ко-рецептор, CXCR4, для входа в клетки. Поэтому отключение только CCR5 может не обеспечить полную защиту от ВИЧ. Кроме того, мутация CCR5-Δ32, которая приводит к поломке белка CCR5, естественным образом встречается у некоторых людей и связана с увеличенной устойчивостью к ВИЧ, но не полному иммунитету.

Хотя генетическая модификация, проведенная Хэ Цзянькуем над эмбрионами Лулу и Наны, была направлена на обеспечение устойчивости к ВИЧ, вполне возможно, что она может иметь и негативные побочные эффекты, такие как повышенная восприимчивость к другим заболеваниям, либо дефекты вызванные непосредственно ненаправленной, либо излишне активной работой CRISPR.
Одним из заболеваний, которое представляет особый риск в данном случае, является вирус Западного Нила (WNV), вызывающий одноименную лихорадку западного нила. Вирус, переносится комарами и может вызывать тяжелые ухудшения здоровья, вплоть до смерти.
У людей с нарушениями в гене CCR5 наблюдается повышенная предрасположенность к заболеваниям и осложнениям, вызванным вирусом Западного Нила (WNV). Эпидемиологически, в регионе, где родились близняшки, вероятность заразиться ВИЧ ниже, чем быть укушенными комаром-переносчиком WNV[5-6].
Этот парадокс, когда блокировка экспрессии CCR5 делает человека устойчивым к одному вирусу и предрасположенным к другому, объясняется природой вирусов и непосредственно ВИЧ. ВИЧ инфицирует иммунные клетки, распознавая их по рецепторам на поверхности. Если рецепторы отсутствуют, вирус не может прикрепиться к клетке, и инфицирование не происходит.
Однако, CCR5 необходим иммунным клеткам для распознавания сигналов, запускающих иммунный ответ. Перманентно блокируя экспрессию этого гена, Хэ Цзянькуй защитил близняшек от абсолютного иммунодефицита, который мог вызвать ВИЧ, но при этом подарил им частичный иммунодефицит с повышенной восприимчивостью к другим инфекциям.
II. Первый пациент

2019 год, США, 34-летняя Виктория Грей, стала первым пациентов получившим одобренную, генетическую CRISPR терапию от серповидной клеточной анемии.[7]
Серповидноклеточная анемия - это генетическое заболевание, которое влияет на эффективность выполняемого эритроцитами газообмена, из-за аномальной серповидной формы эритроцитов, что снижает их площадь поверхности.
При серповидноклеточной анемии в бета-цепи гемоглобина происходит замена одной аминокислоты, заменяющая остаток глутаминовой кислоты на остаток валина в положении 6. Это изменение приводит к образованию аномальных молекул гемоглобина, называемых гемоглобином S, которые имеют тенденцию слипаться и образовывать длинные жесткие стержни внутри красных кровяных телец.
Что в конечном итоге и приводит к образованию деформированных, серповидных эритроцитов.[8]
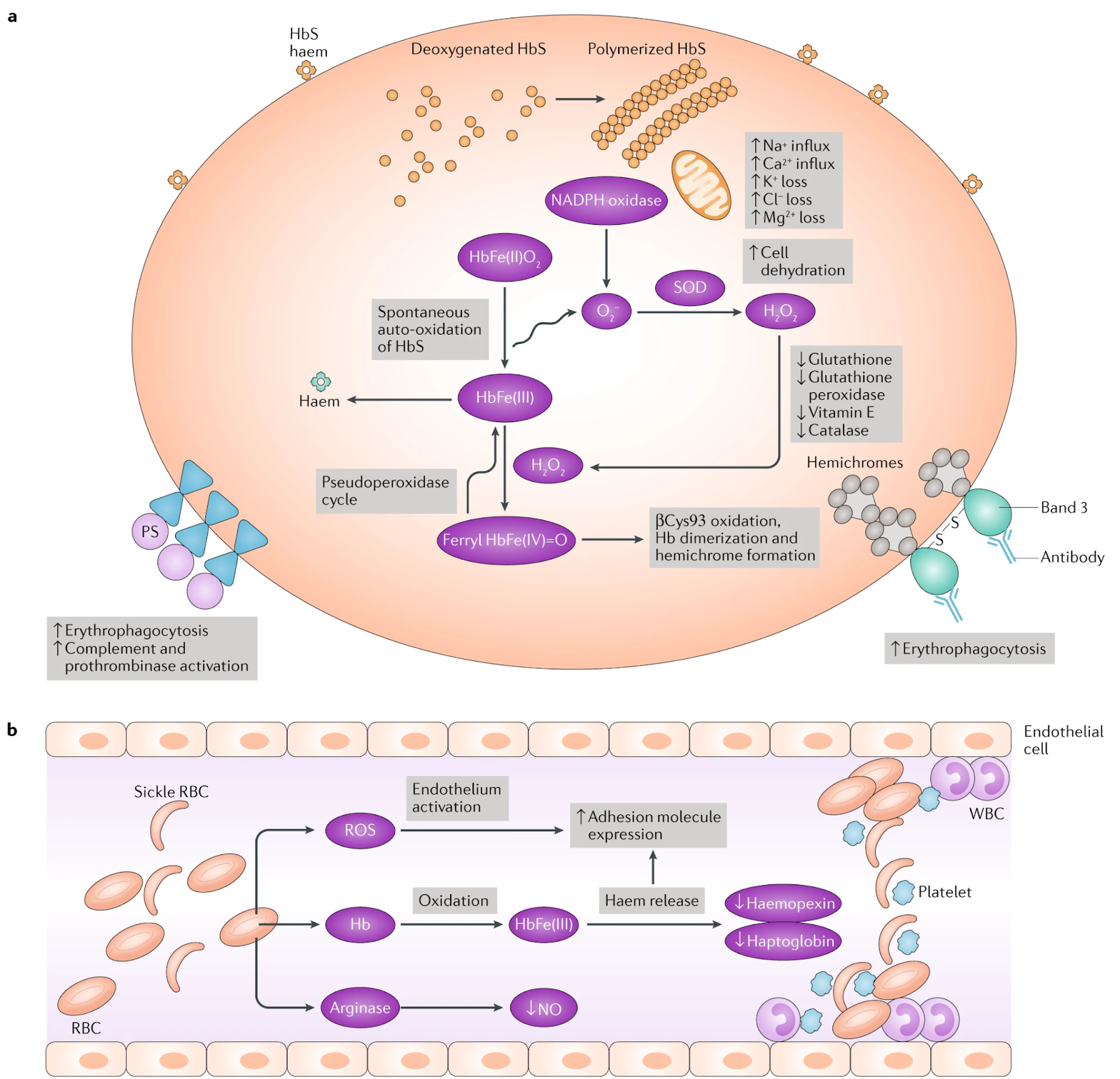
Стоит также отметить, что по иронии, и у этого генетического изъяна есть две стороны медали, несмотря на все свои недостатки, серповидная клеточная анемия, также повышает устойчивость к малярии. Вероятно, это вызвано тем, что паразит вызывающий малярию, однолкеточное простейшее Plasmodium falciparum, не может нормально развиваться из-за слишком малого количества кислорода, переносимого серповидными эритроцитами, в силу их меньшей площади поверхности.[9] Что в регионах с низким уровнем медицины и высокой заболеваемостью и по сей день может давать значимое эволюционное преимущество, несмотря на все негативные симптомы вызванные неэффективной работой эритроцитов.[9]
Методология проведенной терапии заключалась в следующем -
Сбор стволовых клеток крови пациента из костного мозга
Использование электрического тока(Нуклеофекция) для введения ферментов CRISPR- Cas9 в извлеченные стволовые клетки вместе с нормальным вариантом гена.
Использование химиотерапии, чтобы уменьшить популяцию больных клеток.
Повторное введение собственных отредактированных клеток пациента.[10]
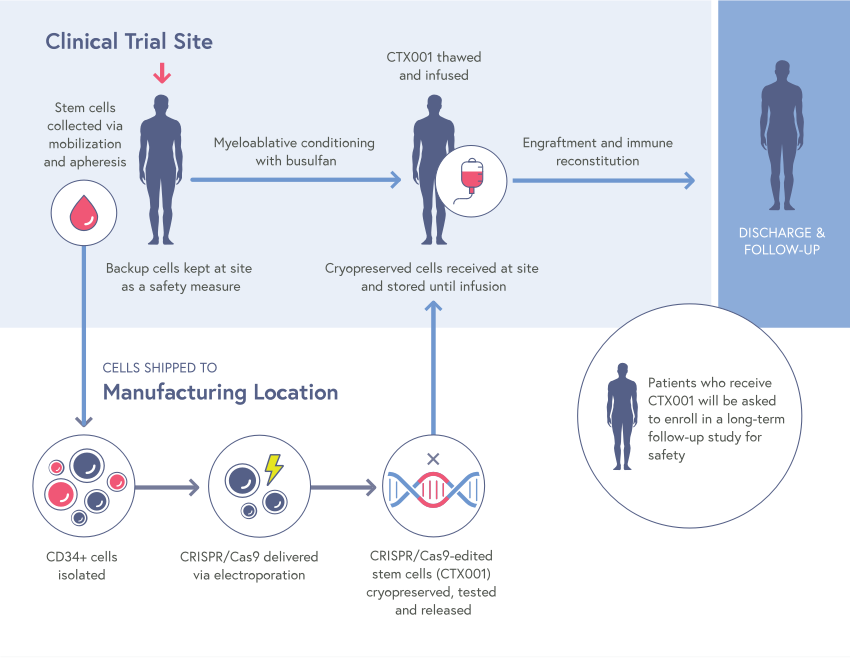
К счастью, не как часто это бывает в иных случаях, это не финал истории. Дальнейшие клинические испытания продолжились. Так, в 2022 году вышел пресс-релиз, где были представлены результаты 75 пациентов, которые прошли курс генотерапии с использованием CRISPR. Время с прохождения терапии варьировалось от 1. 2 до 37.2 месяцев. 44 пациента были больны бета-талассемией и 31 - серповидной анемией. Показатели всех из них, кроме двух пациентов с бета-талассемией, показали полностью нормальные параметры, без надобности в новых, что означало их полное излечение. Да и у тех двоих, которым трансфузии все еще требовались, их объем снизился на 75% и 89%.[11]
С учетом дешевизны и простоты производства эндонуклеазы Cas9, gRNA, а также ДНК, буквально каждый может заказать их через интернет по почте, можно смело предположить что в 21 веке эти 2 наследственных и ранее неизлечимых заболевания навсегда уйдут в небытие.
Этот метод имеет несколько сложностей, таких как извлечение костного мозга, использование CRISPR для редактирования генома с помощью нуклеофекции. Однако, эти проблемы могут быть решены, если использовать вирусные или иные векторы доставки in vivo.
III. CRISPR против рака
В 2021 году, 13-летняя девочка в Великобритании стала первым человеком, получившим лечение, в котором используется новый тип иммунотерапии c применением CAR-T клеток в комбинации с CRISPR.[12] CAR-T терапия — это форма иммунотерапии, использующая генетически модифицированные Т-лимфоциты пациента для борьбы с раковыми клетками. Суть метода в следующем: из организма пациента извлекают Т-лимфоциты, затем в лаборатории в них вводят специальный ген, кодирующий химерный антигеновый рецептор (CAR). Этот рецептор позволяет Т-лимфоцитам распознавать и уничтожать раковые клетки. Полученные таким образом CAR-T-клетки возвращают в организм пациента, где они начинают активно бороться с опухолью.
CRISRP в этой терапии выполняет роль внесения изменений в геном Т-лимфоцитов. Это позволяет "перепрограммировать" иммунные клетки, чтобы они могли эффективно бороться с раком.
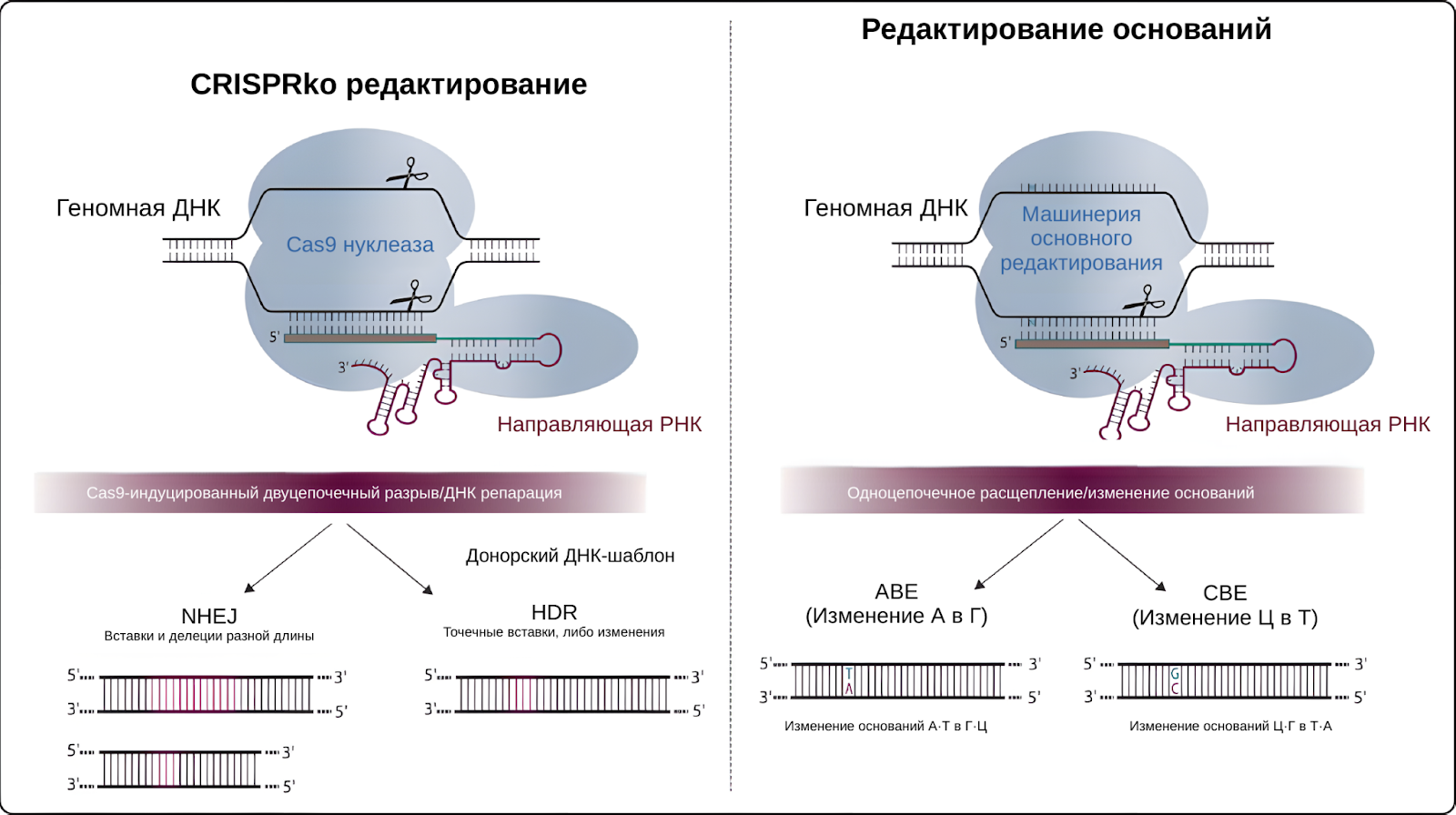
Заместо обычного нокаута генов, либо вставки донорского отрезка ДНК с помощью гомологически направленного восстановления(HDR), был использован метод редактирования оснований. Лечение было разработано Васимом Касимом(Waseem Qasim), профессором клеточной и генной терапии в Университетском колледже Лондона(UCL), оно основано на внесении точных изменений в ДНК, на уровне отдельных нуклеотидов.

Идея редактирования оснований с помощью CRISPR появилась в 2016 году, этот позволяет вносить точные изменения в отдельные нуклеотиды в ДНК, при этом все также сохраняя главное преимущество своих "старших" братьев в виде РНК-направленности. В отличие от традиционного редактирования генов CRISPR-Cas9, которое использует метод вырезания и вставки для редактирования генома, базовое редактирование опирается на другой ферментативный комплекс, который представляет из себя слияние эндонуклеазы Cas9 и цитидиндезаминазы. Ферменты подобные цитединдезаминазе, способны вносить точные изменения в ДНК путем преобразования одного нуклеотидного основания в другое, не вызывая двухцепочечных разрывов в ДНК.[13]
Конкретно цитидиндезаминаза специализирована на том, что основание аденина (A) может быть преобразовано в основание гуанина (G) путем удаления аминогруппы из основания, в то время как основание цитозина (C) может быть преобразовано в основание тимина (T) путем удаления метильной группы. Однако, обратное преобразование этот фермент не способен осуществлять, однако это не значит, что другие ферменты не могут. В последние годы активно развивается исследование и применение ферментов специализирующихся на базовом редактирование, в связке с РНК-направленными комплексами, для осуществления замен нуклеотидов в обе стороны за раз, без необходимости применения дополнительного фермента.
Одним из преимуществ редактирования оснований по сравнению с другими типами редактирования генов, такими как направленная на гомологию репарация или нокаут гена, является то, что это быстрее и эффективнее. Редактирование оснований может быть использовано для внесения специфических изменений в нуклеотиды без необходимости двухцепочечных разрывов или полагаясь на естественный механизм восстановления ДНК клетки, который может быть медленным и подверженным ошибкам. Кроме того, редактирование оснований может быть использовано для внесения точечных изменений в отдельные нуклеотиды, в то время как направленная на гомологию репарация и нокаут гена основаны на вставке или удалении более крупных сегментов ДНК.
IV. Текущий по венам CRISPR
Как и у почти любой терапии требующей вмешательства внутри организма и клеток, главная проблема при лечении большинства генетических заболеваний с помощью систем CRISPR заключается в том, чтобы доставить всю нам необходимую молекулярную машинерию до цели без повреждений, как самого груза в виде терапии, так и клетки.
В 2021 году, исследователи совершили прорыв в медицине, успешно введя терапию на основе препарата с CRISPR в кровь людей с редким заболеванием известным как транстиретиновый амилоидоз, которое вызывает смертельно опасные нарушения в работе нервов и сердца. В клиническом исследование принимали участие 4 мужчин в возрасте между 46 и 64 годами, а также 2 женщины.
Цель терапии была направлена на деактивацию мутантного гена, который заставляет клетки печени вырабатывать неправильно свернутые формы белка под названием транстиретин (TTR), который может накапливаться в нервах и сердце, приводя к боли, онемению и сердечным заболеваниям. Это состояние относительно редкое, и обычно для его лечения используются препарат патисиран.
Терапия заключалась в том, что пациентам вводили липидную частицу, несущую две разные РНК. мРНК, необходимую для синтеза белка Cas9, а также направляющую нРНК, направляющую ее к гену TTR. После того, как Cas делает свой надрез, клеточный механизм восстановления ДНК залечивает его, но идеально, что приводит к прекращению экспрессии дефектного гена.[14]
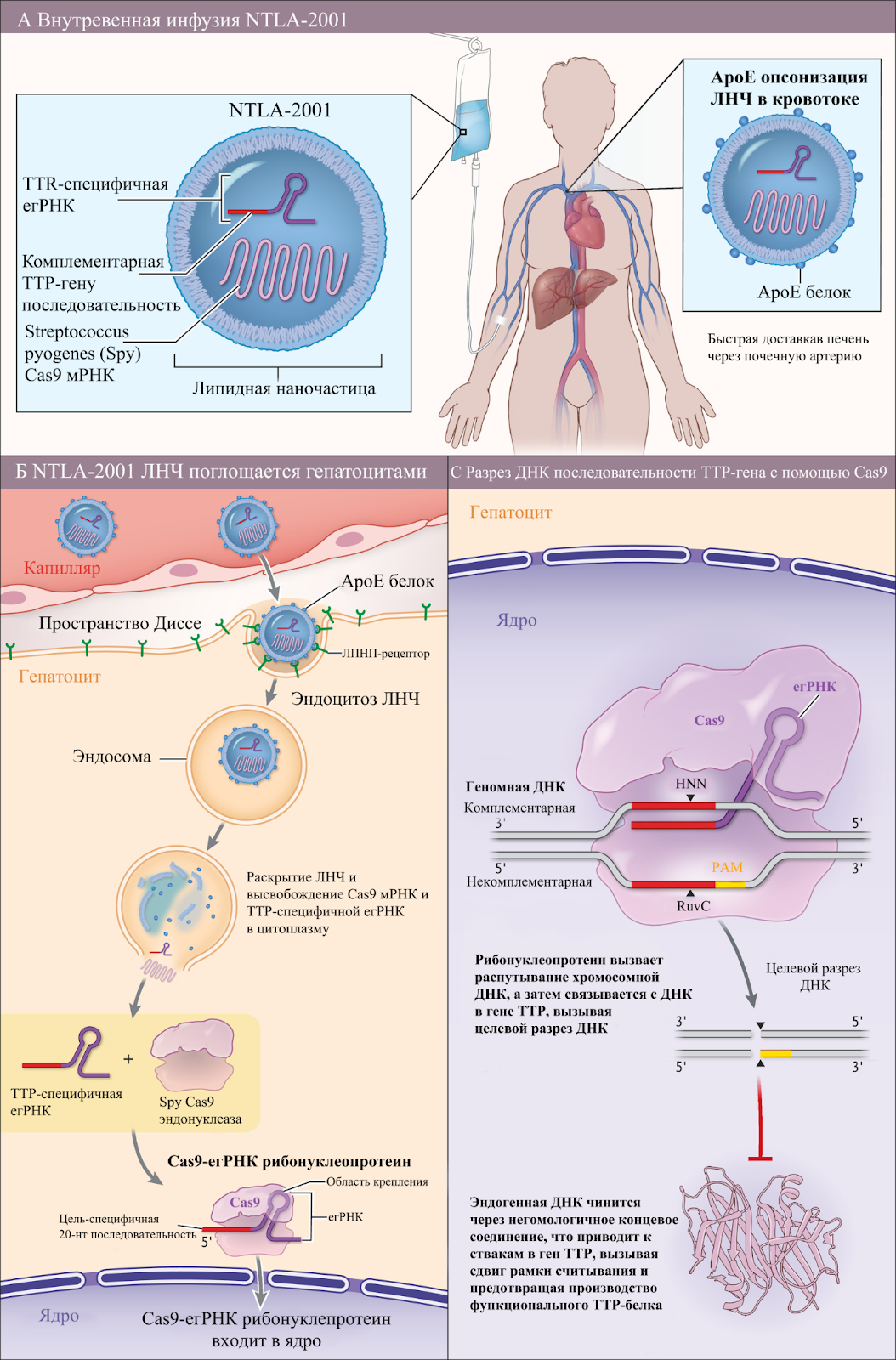
В своей сути подобный метод доставки очень схож с обретшими популярность и широкое распространениеРНК-вакцинами во время пандемии COVID-19. Однако, ключевое различие данной терапии с имеющимися на рынке РНК-вакцинами состоит в том, что вектор для доставки терапии имеет не вирусное происхождение. Что за собой в качестве плюса несет меньший шанс начала иммунного ответа из-за введения терапии.
Через 28 дней у трех мужчин, получавших более высокую из двух доз лечения, уровень TTR снизился на 80-96%, что на уровне или лучше, чем в среднем, на 81% при применении патисирана. Полученные данные очень обнадеживают, и потенциально это может стать первым методом лечения этого наследственного, инвалидизирующего и опасного для жизни заболевания, ранее считавшегося неизлечимым. [14]
* Патисиран представляет собой препарат на основе молекулы малой интерферирующей РНК(siRNA), которая специфически связывается с матричной РНК транстиретина и блокирует трансляцию белка с неё. Это приводит к снижению уровня транстиретина в организме, что помогает уменьшить симптомы заболевания.
Хотя пациентам, получающим лечение CRISPR, могут потребоваться месяцы, чтобы их симптомы уменьшились, лечение, по-видимому, не имеет серьезных краткосрочных побочных эффектов, доставка же РНК в векторе с липидной облочкойпотенциально безопаснее, чем использование вирусов в качестве носителей для препаратов генетической терапии.
И особенно разительная разница между применением классических препаратов, которые дают лишь временное избавление от симптомов, но только пока пациент продолжает свой курс.
Не менее важный аспект и то, что генотерапия в отличие от препаратов способна избавить от недуга не только самого пациента, но и его потенциальных, еще не рожденных детей, если нацелить ее также и на гаметы.
III. Регуляторный аспект

Регуляторный аспект относится к правилам и подзаконным актам, которые регулируют разработку и использование медицинских методов лечения, включая генетическую терапию. Использование CRISPR для медицинского лечения по-прежнему трудно лицензировать как в США, так и в ЕС/СК из-за проблем с регулированием.
Процесс регулирования генетической терапии часто более сложен, чем при традиционной терапии, из-за уникальной природы этих методов лечения. Генная терапия включает в себя изменение ДНК пациента, что может иметь далеко идущие и потенциально необратимые последствия. Кроме того, для правительств по всему миру редактирование генома стало давно излюбленным козлом отпущения и пугалом для обывателей, поэтому регулирующие органы проявлять особую придирчивость при оценке безопасности и эффективности методов лечения с использованием генотерапии.
В Соединенных Штатах регулирование генетической терапии контролируется Управлением по контролю за продуктами питания и лекарствами (FDA). FDA регулирует генетическую терапию в соответствии с Федеральным законом о продуктах питания, лекарствах и косметике (FD & C Act), а также Закон об общественном здравоохранении(PHS Act), которые наделяют агентство полномочиями оценивать и одобрять новые лекарства, включая генную терапию. [15] FDA также создало систему регулирования генной терапии, которая учитывает их уникальную природу и потенциальные риски, Центр оценки и исследований биологических препаратов(CBER). [16]
В дополнение к Закону FD&C, FDA выпустило дополнительные регуляторные нормативы для генной терапии и других передовых методов лечения, таких как клеточная терапия. Например, в 2020 году FDA выпустило руководство по разработке генной терапии редких заболеваний. Этот документ содержит рекомендации по разработке и проведению клинических испытаний генной терапии редких наследственных заболеваний. [17]
В Европейском союзе регулирование генетической терапии контролируется Европейским агентством по лекарственным средствам (EMA). [18] EMA регулирует генную терапию в соответствии с Положением о лекарственных средствах для продвинутой терапии (ATMP), которое устанавливает конкретные требования к разработке и разрешению передовых методов лечения, включая генную терапию.[19]
Регламент ATMP требует, чтобы генная терапия проходила тщательный процесс оценки, учитывающий ее потенциальные риски и преимущества. Этот процесс включает научную оценку Комитетом EMA по передовым методам лечения (CAT) и рецензирование Европейской комиссией, прежде чем терапия может быть разрешена к использованию в ЕС.[20]
О том, как все это обилие различных бюрократических надстроек влияет на биотехнологический рынок и непосредственно на развитие генных терапий, в том числе с использованием CRISPR, можно судить по тому, как идет развитие индустрии. А о развитии в многострадальной биотехнологической индустрии говорить в общем-то и не приходится, оно не идет, а в лучшем случае стоит на месте, на что не повлияла даже мировая пандемия COVID-19.
В тех же США, уровень одобрения препаратовна 2022 год снизился на 25%, до самого низкого уровня с 2016 года. И хотя на фоне пандемического угара, предвосхищая сверхприбыль, уровень слияний и поглощений вырос с 147 миллиардов до 212, венчурное финансирование даже немного снизилось, с 40 до 38 миллиардов.Разве что наблюдается интересная тенденция, что на фоне фармакологии с использованием малых малекул, растет доля биологических препаратов, из одобренных FDA препаратов их доля увеличилась с 34% в 2021 до 46% в 2022.[21]
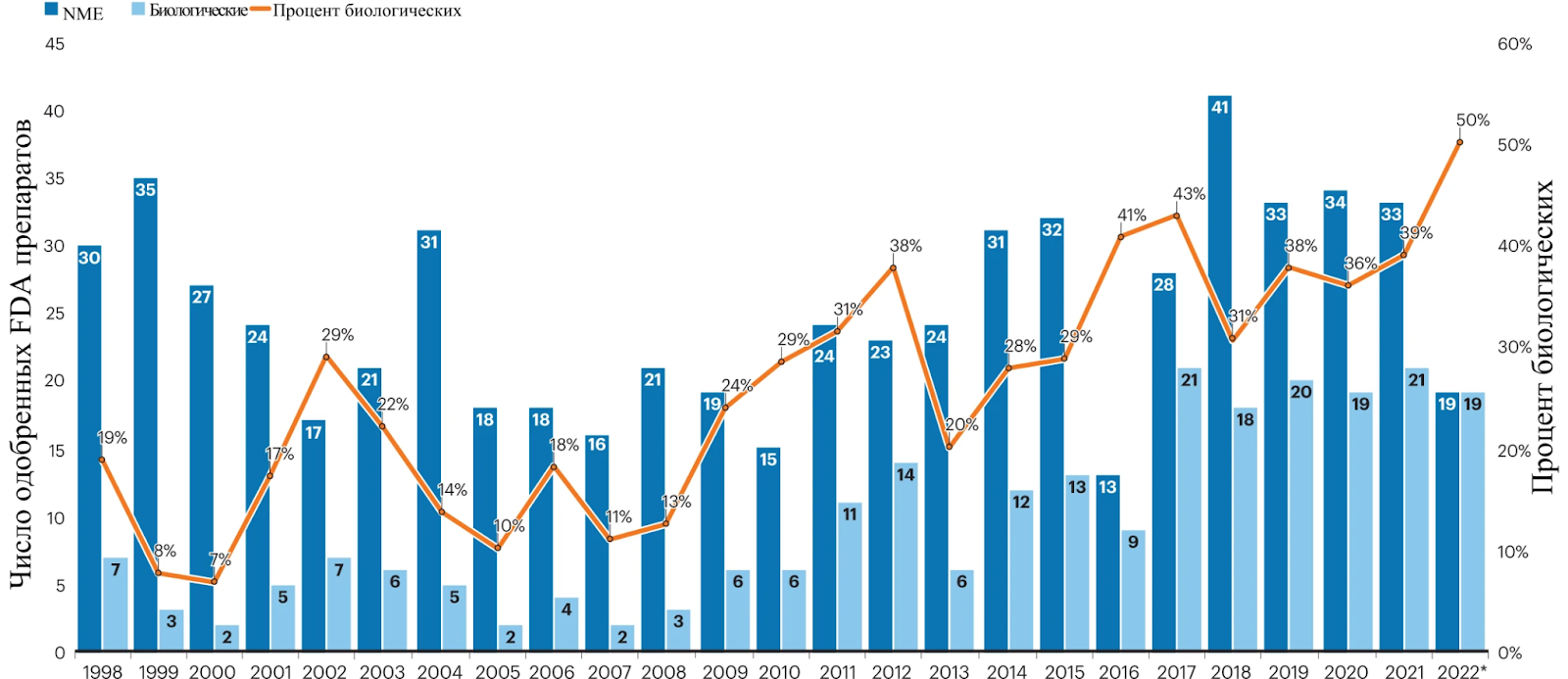
Но в целом же, индекс Nasdaq ясно указывает на то, что индустрия находится в крутом пике, в 2021 году индекс показал снижение на 25%, а в 2022 на 20%. Высокий уровень безработицы и перенасыщенность специалистами даже с докторскими степенями в сфере наук о жизни, также явно говорят о далеких от благоприятных условиях для развития.[22]
На фоне всего этого, неизменным является разве что бесконечная инициатива коллективов исследователей и разработчиков. И хотя биотехнологическая/биомедицинская индустрия переживает не лучшие времена, все новые методы лечения и понимания того как функционирует живая материя, продолжают появляться.
IV. Правовой аспект

Патентная война за право владеть CRISPR началась в мае 2012 года, когда ныне уже лауреаты Нобелевской премии, Дженнифер Дудна и Эммануэль Шарпантье, опубликовали статью, описывающую роль CRISPR в адаптивном иммунитете бактерий.[23]
Вскоре после этого, в декабре 2012 года*, группа исследователей во главе с Фэн Чжаном из Института Брода Массачусетского технологического института(MIT) и Гарварда подала заявку на патент на использование CRISPR в эукариотических клетках, таких как клетки человека.[24] Это вызвало судебную тяжбу между Калифорнийским университетом Беркли и институтом Брода по поводу того, кто имеет право патентовать и лицензировать технологию.
* В публичном доступе информация начала выходить в 2013 году, так как в США после подачи патента, идет период секретности в 18 месяцев.
С тех пор патентная война за CRISPR расширилась и охватила множество других университетов и организаций, каждая из которых соперничала за кусок пирога CRISPR. Борьба велась на нескольких фронтах, включая Ведомство по патентам и товарным знакам США (USPTO), Европейское патентное ведомство (EPO) и суды.
Одним из главных вопросов, лежащих в основе патентной войны CRISPR, является вопрос о том, кому принадлежат права интеллектуальной собственности на технологию. USPTO и EPO оба вынесли противоречивые решения по этому вопросу, причем некоторые патенты были выданы Калифорнийскому университету в Беркли, а другие - Институту Брода. Это привело к созданию сложной сети лицензионных соглашений, в результате чего некоторым компаниям пришлось выплачивать роялти обоим учреждениям, чтобы использовать технологию.
И хотя, по крайней мере в США, в этой борьбе верх традиционно одерживает институт Брода, даже не смотря на то что в 2022 году университет Беркли проиграл в очередной раз, попыток заполучить владение интеллектуальными правами на CRISPR Cas9.[25]
Главной проблемой всех этих патентных баталий между жабой и гадюкой за право владения системой, которую даже не изобрели, а открыли и которая более того не является уникальной, а широко представлена в царствах бактерий и родственных нам эукариотам архей, является факт того что это накладывает громадные ограничения на и без того словно цепями, окутанную в регуляциях индустрию.
Абсурдность современного патентного права в данном случае доказывает тот факт, что промышленность использовала CRISPR спокойно и до внезапного интереса безработных бюджетников академиков в его сторону. Так для создания устойчивых к патогенам штаммов кисломолочных бактерий, CRISPR нашел свое применение уже в 2007 году.[26]
Впрочем, не одним CRISPR едины, и такая безумная концепция как владение владение интеллектуальной собственностью на информацию показывает свою эффективность во всех уголках экономики. Статистика самих же патентных бюро весьма неутешительная, как правило около 50-70% компаний, от мало до велика заместо патентирования предпочитают коммерческую тайну. Вероятнее всего, в действительности доля и того больше.[27]
Один только институт Broda владеет 26 патентами на применение систем CRISPR-Cas9 и 3 патентами на CRISPR-Cas12/Cpf1. Но помимо него, к примеру есть и такие промышленные гиганты как DuPont. Которые по праву более раннего применения технологии на практике, выбили себе уникальные права для использования CRISPR в сельском хозяйстве и уже упомянутой молочной промышленности.
И теперь представьте, что чтобы начать собственное коммерческое исследование или же продукт с применением CRISPR, помимо 9 кругов государственного, бюрократического Ада, вам будет необходимо также получить лицензионное соглашение и с частными/полу-государственными структурами, владеющими патентами?
Да, они не могут запатентовать CRISPR как таковой, а имеют патенты на конкретные системы, но и патентование концепции, а не конкретного применения, это не нечто невозможное в современной правовой системе.
Да и разнообразие систем CRISPR не бесконечно, как и создание собственных альтернатив не попадающих под нарушение IP, не бесплатно.
V. Заключение
Лечение на основе CRISPR является перспективным направлением для создания терапий множества наследственных и приобретенных заболеваний. Эта технология имеет огромный потенциал, и исследования активно развиваются, несмотря на проблемы и ограничения, которые во многом висят над индустрией, словно дамоклов меч.
Однако, разработку и коммерциализацию CRISPR-терапий затрудняют условия государственного регулирования и законы о защите интеллектуальной собственности. Сложные клинические испытания, длительные процессы одобрения а также высокие затраты на патенты создают проблемы как для малых исследовательских групп и стартапов, так и для гигантов индустрии.
К 2021 году, средняя стоимость разработки новых лекарств для 20 крупнейших фармацевтических компаний составляла монструозные 2,3 миллиарда долларов. Это серьезная сумма даже для компаний с годовым оборотом в десятки миллиардов, и абсолютно неподъемная для всех кто меньше. Подобное положение дел можно было бы понять в тяжелой промышленности, и производстве микроэлектроники, где в процессе задействованы десятки тысяч работников и сотни тысяч тонн ресурсов.
Но никак не в сфере генотерапии, когда в наше время необходимые расходники можно заказать по почте, а масштабирование сводится в основном к тому, чтобы ПЦР-реакция работала 24/7, с себестоимостью сопоставимой с затратами на электричество для поддержания необходимой ДНК-полимеразе температуры.[29]
Учитывая огромный потенциал CRISPR-терапий, способных избавить человечество от ужасов наследственных болезней или даже старения, очевидно, что необходимо пересмотреть законы о защите интеллектуальной собственности, с учетом интересов общества и частных организаций. Возможным решением может быть запрет на патентование молекулярных комплексов обнаруженных в природе, по аналогии с решением Верховного суда США по делу Myriad Genetics. Где патенты на гены BRCA1 и BRCA2, повышающие вероятность рака яичников и молочных желез, дали начало преценденту, что вылился в запрет патентования человеческих генов.[30]
Такой подход бы способствовал инновациям и прогрессу в CRISPR-терапии, обеспечивая использование технологии в интересах общества и улучшение жизни в целом.
В контексте мировых проблем и трудностей, с которыми сталкивается биотехнологическая индустрия, Россия может стать благоприятной средой для биотехнологических и биомедицинских исследований, вместе с промышленностью. Это даст возможность развития отечественных предприятий, освобожденных от строгих патентных и регулятивных норм.
Ведь живая материя отличается от того же бездушного кремния способностью к воспроизведению. И для импортозамещения не требуется создавать новые технологии, либо обещать догнать Запад с отставанием в дцать лет.
Ферменты ДНК-полимеразы и эндонуклеазы Cas работают одинаково в США и России. Все до того просто, что уже сейчас их можно заказать по почте в любом городе [ЗДЕСЬ МОГЛА БЫТЬ ВАША РЕКЛАМА], а работать с ними вы сможете хоть в гаражной лаборатории.
К сожалению, Россия пока не определилась с своим отношением к редактированию.
Так, несмотря на относительную свободу в сфере медицины и фармакологии, всё продолжается бессмысленная и беспощадную борьба в сельском хозяйстве. И это при наличие у индустрии потенциала в триллионы рублей.
Одно радует, что хотя бы спонсирование на бюджетные деньги дармоедов демонизирующих технологию в медийном поле, похоже наконец-то вышло из моды.
Однако, учетом текущих тенденций и международных санкций, российским исследовательским коллективам и частным компаниям, скорее всего, придется продолжать получать лицензии от иностранных организаций, а точнее получать на них отказы. В дополнение к этому, даже если лицензия и будет получена, им еще придется пройти через многочисленные регуляторные процессы на родине, а потом и еще 666 регуляторных процессов при выходе на рынки ЕС и США.
Что впрочем, достаточно легко решить, выбирая политику протекционизма и игнорируя претензии на ИС дорогих западных партнёров, когда это вредит интересам национальной индустрии. Так и упрощение регуляционных процессов, требует лишь желания снизить уровень бюрократии и кормящихся на её раздутой неэффективности бюджетников.
Статья находилась в производственном Аду с ~марта по апрель, после была заброшена. Во многом она осталась сырой и недополированной, но желания дорабатывать дальше её давно уже как нету.
Однако, не хочется и дальше держать её "в столе", так что пусть увидит свет. Заодно, может быть и продолжу планировавшийся цикл статей, началом которого она должна была послужить.
Источники
[1] Burmistrz, M., Krakowski, K., & Krawczyk-Balska, A. (2020). RNA-targeting CRISPR–Cas systems and their applications. International journal of molecular sciences, 21(3), 1122.
[2] Vojta, Aleksandar, et al. "Repurposing the CRISPR-Cas9 system for targeted DNA methylation." Nucleic acids research 44.12 (2016): 5615-5628.
[3] Lee, Hayun, Yukti Dhingra, and Dipali G. Sashital. "The Cas4-Cas1-Cas2 complex mediates precise prespacer processing during CRISPR adaptation." Elife 8 (2019): e44248.
[4 ]Cohen, Jon. "Did CRISPR help—or harm—the first-ever gene-edited babies." Science 21 (2019).
[5] Ellwanger, Joel Henrique, et al. "Beyond HIV infection: neglected and varied impacts of CCR5 and CCR5Δ32 on viral diseases." Virus research 286 (2020): 198040.
[6] Glass, William G., et al. "CCR5 deficiency increases risk of symptomatic West Nile virus infection." The Journal of experimental medicine 203.1 (2006): 35-40.
[7] Stein, Rob. "In a 1st, Doctors in the US Use CRISPR Tool to Treat Patient with Genetic Disorder." NPR (2019).
[8] HBB hemoglobin subunit beta [ Homo sapiens (human) ]. Gene ID: 3043 https://www.ncbi.nlm.nih.gov/gene/3043
[9] Archer, Natasha M., et al. "Resistance to Plasmodium falciparum in sickle cell trait erythrocytes is driven by oxygen-dependent growth inhibition." Proceedings of the National Academy of Sciences 115.28 (2018): 7350-7355.
[10] Safety, A. "Efficacy Study Evaluating CTX001 in Subjects With Severe Sickle Cell Disease." Vertex Pharmaceuticals Incorporated. Available online at: https://clinicaltrials. gov/ct2/show/NCT03745287 (2018).
[11]Vertex Pharmaceuticals Incorporated and CRISPR Therapeutics. “Vertex and CRISPR Therapeutics Present New Data on More Patients With Longer Follow-Up Treated With exagamglogene autotemcel (exa-cel) at the 2022 European Hematology Association (EHA) Congress.” CRISPR, (2022), crisprtx.com/about-us/press-releases-and-presentations/vertex-and-crispr-therapeutics-present-new-data-on-more-patients-with-longer-follow-up-treated-with-exagamglogene-autotemcel-exa-cel-at-the-2022-european-hematology-association-eha-congress.
[12] Chiesa, Robert, et al. "Tvt CAR7: Phase 1 Clinical Trial of Base-Edited Universal” CAR7 T Cells for Paediatric Relapsed/Refractory T-ALL." Blood 140.Supplement 1 (2022): 4579-4580.
[13] Komor, Alexis C., et al. "Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage." Nature 533.7603 (2016): 420-424.
[14] Gillmore, Julian D., Michael L. Maitland, and David Lebwohl. "CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. Reply." The New England journal of medicine 385.18 (2021): 1722-1723.
[15] U.S. Food and Drug Administration. “Cellular & Gene Therapy Products.” FDA, www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products.
[16] “About CBER.” U.S. Food and Drug Administration, https://www.fda.gov/about-fda/center-biologics-evaluation-and-research-cber/about-cber.
[17] “Human Gene Therapy for Rare Diseases.” U.S. Food and Drug Administration, https://www.fda.gov/regulatory-information/search-fda-guidance-documents/human-gene-therapy-rare-diseases.
[18] “Multidisciplinary: Gene Therapy.” European Medicines Agency, https://www.ema.europa.eu/en/human-regulatory/research-development/scientific-guidelines/multidisciplinary/multidisciplinary-gene-therapy.
[19] “Advanced Therapy Medicinal Products Overview.” European Medicines Agency, https://www.ema.europa.eu/en/human-regulatory/overview/advanced-therapy-medicinal-products-overview.
[20] “Committee for Advanced Therapies (CAT).” European Medicines Agency, https://www.ema.europa.eu/en/committees/committee-advanced-therapies-cat.
[21] Senior, Melanie. "Fresh from the biotech pipeline: fewer approvals, but biologics gain share." Nature Biotechnology (2023): 1.
[22] “Is Biotech Facing a Long Bear Market?” Pharmaceutical Technology, https://www.pharmaceutical-technology.com/news/is-biotech-facing-a-long-bear-market/.
[23] Jinek, Martin. "A Programmable Dual-Siswanto, FM, BH Kartiko/Media Sains 1 (2)(2017) 56 J. Media Sains–September 2017 RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity." Science 337.6096 (2012): 816-821.
[24] “Broad Institute.” Broad Institute of MIT and Harvard, https://www.broadinstitute.org/files/shared/osap/pdf/Broad61-736527December122012.pdf.
[25] Ledford, Heidi. "Major CRISPR patent decision won't end tangled dispute." Nature 603.7901 (2022): 373-374.
[26] Lander, Eric S. "The heroes of CRISPR." Cell 164.1-2 (2016): 18-28.
[27] “National Science Foundation.” National Center for Science and Engineering Statistics, https://ncses.nsf.gov/pubs/nsf21339.
[28] “Journalist’s Statement and Background on CRISPR Patent Process.” Broad Institute of MIT and Harvard, https://www.broadinstitute.org/crispr/journalists-statement-and-background-crispr-patent-process.
[29] “It Cost $2.3B to Develop an Asset in 2022, More Than in 2021, While Return Dropped: Deloitte.” FierceBiotech, https://www.fiercebiotech.com/biotech/it-cost-23b-develop-asset-2022-more-2021-while-return-dropped-deloitte.
[30] “Supreme Court Rules Against Patents On Human Genes.” NPR, https://www.npr.org/sections/health-shots/2013/06/13/191400438/Supreme-Court-Rules-Against-Patents-On-Human-Genes.
Комментарии (4)

shadrap
30.12.2023 21:11+2Рисунки чем переводили?
Вцелом во всех статьях о Криспер,мне кажется, не доносится одна главная мысль- за редким исключением- олигонуклеотидного редактирования,все эти инструменты ничего не редактируют.Все что они могут это разрезать цепь в определённом месте-все ,все остальное делается за счёт внутренних сил клетки- способности к восстановлению,репарации или нокауту и вовремя подсунутым заменам.
Всех с Наступающим! Что б в жизни никому это не пригодилось!)

OrkBiotechnologist Автор
30.12.2023 21:11+1Переводил руками, половину изображений прогонял перед этим через Upscayl, для увеличения разрешения. А дальше в Krita убирал старый текст и писал перевод.
Ну и 2 рисунка вставленные под конец ухода статьи в стол, перевести уже поленился.
,все эти инструменты ничего не редактируют
Нокаут и вставка всё таки по определению являются редактированием.
Сама по себе гомологичная рекомбинация в нужном нам месте не произошла бы.репарации или нокауту и вовремя подсунутым заменам.
Подсунуть вектор-донор задача всё таки не тривиальная. И опять, без целенаправленного действия эндонуклеазы, мы бы имели просто внехромосомную плазмиду.
Помимо этого есть системы способные напрямую доставлять необходимую ДНК и вставлять в нужное место. Основаны они на CRISPR-ассоциированных транспозонах(CASTs).
Относительно свежее открытие 2020 года, традиционно прошедшее мимо академического внимания, ибо не мейнстрим.Можно ещё упомянуть РНК-направленные транспозоны не из семейства CRISPR, способные выполнять аналогичную роль. Но это другая история.
И возвращаясь к теме академии, надеюсь не она, так промышленность не обделит вниманием наши эукариотические РНК-направленные эндонуклеазы семейства Fanzor.
Ещё в 2020, в Барселоне с Евгением Куниным спорил, что раз CRISPR по его мнению появился очень рано на эволюционном древе, есть и у архей, включая его любимых асгардархей, то должны быть хотя бы остатки подобной или аналогичной системы у эукариот.
Он тогда говорил что это маловероятно, из-за того что либо CRISPR у эукариот был подвержен самонацелениванию и сам себя вырезал.
Либо в случае многоклеточных, оказался токсичен для иммунитета и провоцировал иммунные реакции.Первое опровергло существование Fanzor, а второе активное использование CRISPR в многоклеточных эукариотах с активной иммунной системой.
Всех с Наступающим! Что б в жизни никому это не пригодилось!)
Спасибо! И вас с Наступающим, счастья и всех благ в Новом Году!

OrkBiotechnologist Автор
30.12.2023 21:11+1Ещё в 2020, в Барселоне с Евгением Куниным спорил
Попутал, то был ещё август 2019 года, а не 2020.

Devastor87
Отличная подборка материала, плюсую ????
Воодушевляет )