К сожалению, в настоящее время нет лекарств, способных полностью вылечить болезнь Альцгеймера (деменцию) или остановить ее прогрессирование на поздних стадиях. В мире с таким диагнозом ежегодного сталкиваются порядка 50 миллионов человек, и с каждым годом эти цифры растут.
Во многом качество жизни пациентов с Альцгеймером зависит от того, как быстро человек обратился к специалистам, однако это тоже является большой проблемой. Болезнь долгое время протекает незаметно, а потом быстро и бесповоротно переходит в тяжелую стадию.
На помощь в решении данной проблемы пришло машинное обучение!
В данном исследовании я подробно расскажу, как с помощью моделей машинного обучения ученым удалось выявить диагнозы и характеристики состояний пациентов, предшествующие развитию болезни Альцгеймера за 7 лет до ее отправной точки!
Приятного прочтения! :)
Введение в исследование
Болезнь Альцгеймера — это хроническое нейродегенеративное заболевание, с медленным началом и значительным ухудшением с течением времени. В 70% случаев болезнь Альцгеймера приводит к деменции. В мире деменцией страдают около 50 миллионов человек, каждый год выявляется 10 миллионов новых случаев.
Отличительной чертой Альцгеймера является потеря памяти и другие когнитивные нарушения.

Лечение симптомов дорогостоящее и обременительное как для пациентов, так и для тех, кто за ними ухаживает. Подходы к замедлению прогрессирования заболевания направлены на медицинское вмешательство для людей, входящих в группу риска, и людей с первичными симптомами, до наступления необратимого ухудшения состояния. С этой целью развиваются биомаркеры, диагностика, тесты и нейровизуализация, позволяющие улучшить выявление и классификацию БА, а также подобрать методы лечения, модифицирующие болезнь (при этом до сих пор не существует лекарства, полностью лечащего болезнь).
За последние несколько десятилетий электронные медицинские карты (ЭМК) стали источником богатых продольных данных (данные, которые собираются и анализируются в течение определенного периода времени у одного и того же объекта или лица), которые могут быть использованы для понимания и прогнозирования сложных заболеваний, особенно болезни Альцгеймера.
ЭМК — это электронные медицинские записи, в которых хранится информация о здоровье пациента, включая историю болезни, результаты обследований, назначения врачей и другие медицинские данные. Электронные медицинские записи облегчают доступ и обмен информацией между медицинскими учреждениями, повышают эффективность лечения и позволяют более точно отслеживать состояние пациента.
Предыдущие применения ЭМК для изучения болезни Альцгеймера включают глубокое фенотипирование болезни, выявление связанных с болезнью Альцгеймера ассоциаций и гипотез, а также создание модели классификации и прогнозирования диагноза деменции на основе клинических данных.
Фенотипирование — это процесс оценки и описания наблюдаемых характеристик (фенотипа) организма или клетки. В ходе фенотипирования исследователи анализируют внешние и внутренние признаки, такие как форма, цвет, размер, структура и функции организма или клетки. Этот процесс помогает понять, как гены проявляются в конкретных физических или биологических характеристиках, и изучать взаимосвязь между генотипом (генетическим материалом) и фенотипом (наблюдаемыми свойствами).
Однако подход, основанный на применении машинного обучения не был достаточно эффективным из‑за ряда препятствий. К ним можно отнести: ограниченную специфичность для фенотипа Альцгеймера, отсутствие биологической интерпретируемости, зависимость от типов данных, недоступных в ЭМК для обеспечения раннего прогнозирования (например, нейроимиджинг или специальные биомаркеры).
Нейроимиджинг — это метод, используемый в нейронауках, который позволяет наблюдать и анализировать активность мозга с помощью различных методов изображений. С помощью нейроимиджинга ученые могут изучать, как различные зоны мозга активируются во время выполнения определенных задач или воздействия.

Существует достаточно факторов, влияющих на риски возникновения и непосредственно течение заболевания, но в данном исследовании важным фактором является пол, практически не рассматривающийся в уже существующих моделях.
В данном исследовании используются данные ЭМК из медицинского центра Университета Калифорнии в Сан‑Франциско для разработки прогностических моделей определения факторов, предшествующих началу болезни Альцгеймера, и формулирования гипотез о биологических отношениях между основными предикторами и самим заболеванием.
Ученые провели построение и интерпретацию модели, контролируя демографические и связанные с посещениями факторы, чтобы выявить биологически значимые клинические предикторы. Обязательным шагом является стратификация по полу!
В ходе работы используются гетерогенные сети знаний. Кроме того, предикторы проверяются с помощью подтверждающих доказательств во внешних наборах данных ЭМК и анализа генетической колокализации.
Гетерогенные сети знаний — это структуры данных, которые объединяют информацию из различных источников и форматов в единое знание. В таких сетях информация представлена в виде графов знаний. В графе знаний узлы представляют объекты или понятия, а рёбра (связи) указывают на отношения между этими объектами или понятиями. Графы знаний широко используются в области искусственного интеллекта, биоинформатики, они помогают организовывать информацию, отображать связи между сущностями, выполнять поиск, анализ и вывод новых знаний на основе имеющихся данных.
Генетическая колокализация — это метод исследования, который заключается в анализе связанных изменений в геноме, чтобы определить, находятся ли два или более генов вблизи друг от друга на одном и том же участке хромосомы. Этот метод основан на предположении, что гены, участвующие в одном и том же биологическом процессе или патологии, часто находятся в тесной близости. Исследование генетической колокализации может помочь выявить гены, которые могут быть связаны с определенными фенотипическими проявлениями или болезнями.
Методы исследования и полученные результаты
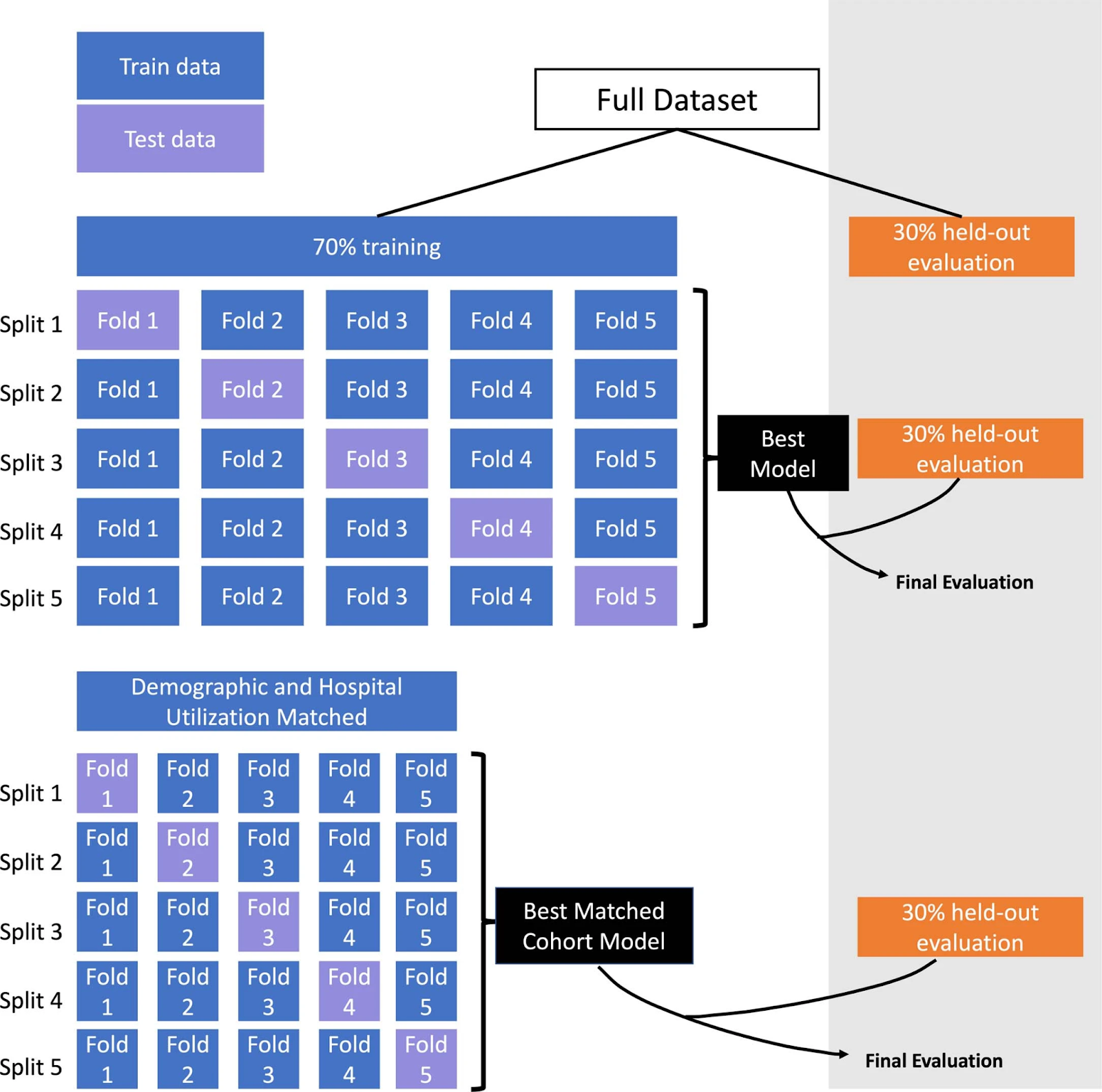
Из предоставленной базы данных, включающей более 5 миллионов человек с 1980 по 2021 год, были выделены 2 996 человек с БА, которые прошли обследование на предмет деменции в Центре памяти и старения и, таким образом, имели клинический диагноз экспертного уровня. Из оставшихся людей отобрали 823 671 контрольных субъектов, посещавших центр более года и, по итогу, не имевших деменции.
После идентификации начального момента развития болезни Альцгеймера (средний возраст появления симптомов — 74 года) и отбора лиц с доступной не менее чем за 7 лет продолжительной линейной динамикой данных, были выявлены 749 человек с Альцгеймером и 250 545 контрольных субъектов.

Из них 30% были выделены для оценки модели, а 70% использовались для обучения модели.

Могут ли модели случайного леса предсказывать болезнь Альцгеймера за 7 лет до отправной точки?

Модели случайного леса, обученные исключительно на клинических данных пациентов за период от 7 лет до 1 дня до появления болезни Альцгеймера, были оценены на общем наборе данных с использованием среднего значения площади под кривой ROC (Receiver Operating Characteristic) по методу бутстрепа.
В зависимости от временного промежутка, создавались разные модели, к ним отнеслись модели, предсказывающие болезнь Альцгеймера за 7 лет, 5 лет, 3 года, год и 1 день до ее возникновения. Основными и самыми показательными (да и интересными для исследования) являются модели «семи лет» и «одного дня».
Для модели «семи лет» значение площади под кривой ROC составило в среднем 0,72 (медиана 0,75), в то время как для модели «одного дня» это значение было выше и составило в среднем 0,81 (медиана 0,85).
Обо всем по порядку!
Модель случайного леса — это мощный алгоритм машинного обучения, который работает на основе ансамбля деревьев решений.

ROC‑кривая (Receiver Operating Characteristic curve) — это график, используемый в оценке качества бинарной классификации. Он отображает отношение между чувствительностью (вероятность правильного предсказания положительного класса) и специфичностью (вероятность правильного предсказания отрицательного класса) модели при различных порогах классификации.
Соответственно, AUROC (Area Under the Receiver Operating Characteristic curve) — это площадь под ROC‑кривой. Она представляет собой количественную меру качества бинарной классификации модели. Чем ближе значение AUROC к 1, тем лучше модель различает классы; значение 0.5 соответствует случайному угадыванию.

Таким образом, можно сделать вывод, что предсказательная способность моделей линейно зависит от времени до возникновения болезни. Модель «одного дня» показывает наилучшие результаты, при этом и самая заблаговременная модель также перешла границу «случайной классификации» и может различать пациентов с развивающимся Альцгеймером от пациентов с другим диагнозом.
Бутстреп (bootstrap) — это метод ресемплинга (формирования новых выборок на основе исходной), используемый в статистике для оценки распределения выборочной статистики. Он позволяет оценить стандартные ошибки и доверительные интервалы для параметров интереса на основе одного наблюдаемого набора данных.
Процесс бутстрепа включает следующие шаги:
Получение выборки с возвращением из исходных данных.
Оценка интересующей статистики (например, среднего, медианы, дисперсии) на основе каждой подвыборки.
Повторение шагов 1 и 2 многократно (обычно тысячи раз).
Получение распределения статистики на основе повторяющихся оценок.
Бутстреп является мощным инструментом для оценки точности и надежности оценок статистических параметров без предположений о распределении данных.

После добавления демографических данных производительность моделей случайного леса улучшилась. Среднее значение площади под кривой ROC увеличилось с 0.86 до 0.90, а площадь под кривой precision‑recall (AUPRC) увеличилась с 0.06 до 0.27 для модели, соответствующей 7 годам, и с 0.10 до 0.14 для модели, соответствующей 1 дню.
AUPRC (Area Under the Precision‑Recall Curve) — это площадь под кривой точности‑полноты. Она также является метрикой качества классификации, особенно актуальной для несбалансированных наборов данных, где классы имеют различное количество примеров. Точность (precision) измеряет, как много из объектов, которые модель предсказала как положительные, действительно являются положительными, а полнота (recall) измеряет, как много из всех действительно положительных объектов модель смогла обнаружить.

Возвращаясь к наборам данных, модели были обучены на клинических данных пациентов (например, информация о вакцинации, аномальных результатов в анализах кала, наличии катаракты, гипертонии). Также, были включены демографические характеристики.
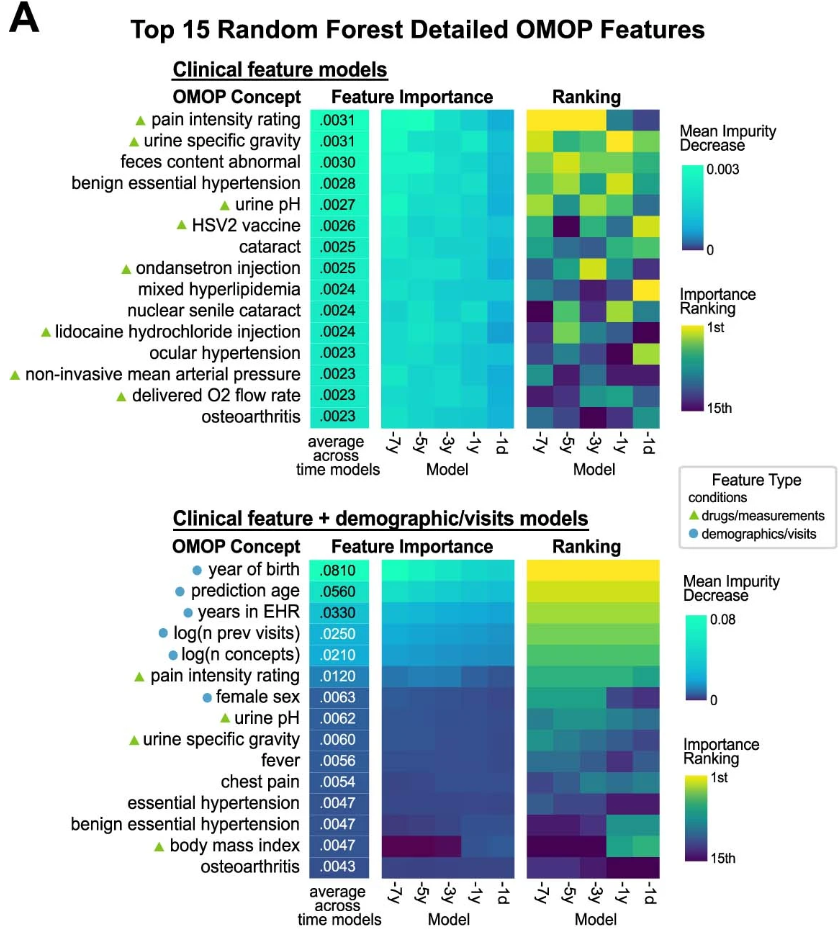
Был выделен «топ-50» характеристик/фенотипов, сгруппированных по относительной важности в разных временных моделях, способных наиболее точно продемонстрировать «предвестники» Альцгеймера. Тут важно отслеживать!сочетания болезней! ведь именно они показательны, а не каждый диагноз в вакууме. Нельзя сказать, что у всех людей с катарактой рано или поздно разовьется деменция, однако в совокупности с другими диагнозами шансы действительно растут. Подробно это продемонстрировано далее:

Так как это самые первые тестовые модели, есть смысл говорить о наиболее значимых и общих для всех временных моделей диагнозах, связанных с наступлением БА. К ним можно отнести: катаракту (частичное или полное помутнение хрусталика — естественной оптической линзы человеческого глаза); гиперлипидемию (состояние организма, при котором уровень липидов (холестерина и триглицеридов) в крови превышает норму); глаукому (заболевание глаз, характеризующееся повышением внутриглазного давления в результате нарушения оттока водянистой влаги); боль в груди; головокружение и тд.
Изменение результатов при обучении моделей на сопоставленных когортах
*Когорты — это группы людей или объектов, которые рассматриваются вместе на протяжении определенного периода времени.
Изначально модели были обучены на общих тестовых наборах данных, теперь же, для грамотного обучения и точных результатов, ученые использовали сбалансированный набор данных участников в соотношении 1:8 между пациентами с болезнью Альцгеймера и контрольной группой без такого диагноза.
Кроме того, в этом случае было решено использовать только клинические характеристики, без учета демографических показателей.
Модели случайного леса, обученные только на клинических характеристиках на всех временных промежутках, имели средний показатель AUROC — 0.58 (медиана 0.57) для модели «семи лет» и 0.77 (медиана 0.77) для модели «одного дня». При добавлении демографических характеристик, модели показали минимальное или отсутствие улучшений с средним AUROC — 0.61 (медиана 0.61) для модели «семи лет» и 0.71 (медиана 0.72) для модели «одного дня».
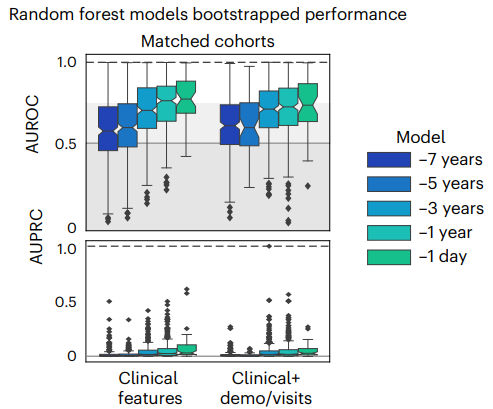
Среди главных характеристик, отсортированных по средней важности по всем моделям, ключевые включают проблемы с памятью, вплоть до ее потери, гиперлипидемию, головокружение, катаракту, сердечную недостаточность, остеоартроз (заболевание суставов, характеризующееся дегенеративным изменением покрывающего кость хряща, проще говоря, его разрушением) и другие. Эти признаки остаются неизменно важными, даже когда в модель добавляются демографические данные.

По сравнению с моделями, обученными на всех индивидах, в моделях, обученных на сопоставленных когортах, еще сильнее повысилась значимость таких признаков, как гиперлипидемия и амнезия, и снизилась значимость различных болевых ощущений (например, в прошлых моделях выделялись боль в груди и спинная боль).

Поскольку такое сопоставление позволяет контролировать влияние демографических факторов на прогнозирование БА, оставшиеся диагнозы могут быть выделены для формирования гипотез с более высокой специфичностью для выявления риска возникновения болезни Альцгеймера.

Анализируя результаты моделей, можно прийти к выводу, что некоторые диагнозы сохраняют предсказательную важность во всех временных моделях, к ним можно отнести гиперлипидемию и сердечную недостаточность.
Некоторые факторы оцениваются как значимые за несколько лет до начала БА, например, остеоартроз или аллергический ринит.
Также есть группа характеристик, которая становится важной приблизительно за 3 года до возникновения Альцгеймера — остеопороз, головокружение, боли в спине, геморрой, пальпитации сердца (усиленное, неправильное сердцебиение), и некоторые характеристики становятся значимыми ближе к моменту начала болезни — потеря памяти и дефицит витамина D.
В целом, это показывает, что модель может выявить комбинацию состояний, которые могут привести к выявлению риска развития БА для пациента определенного возраста и за определенное время.
Выявление значимых характеристик, связанных со стратификацией по полу
В связи с тем, что пол играет важную роль в риске развития БА, модели были обучены, с учетом разделения данных индивидов по половому признаку.
Модели, обученные только на клинических признаках, демонстрировали средний AUROC — от 0.71 (медиана 0.71) до 0.75 (медиана 0.76) для моделей «семи лет» для женщин и мужчин, и от 0.82 (медиана 0.89) до 0.84 (0.86) для моделей «одного дня» для женщин и мужчин. Для AUPRC модели демонстрировали производительность от 0.056 до 0.11 (медиана 0.022–0.061) и от 0.041 до 0.15 (0.015–0.056) для женских и мужских моделей «семи лет» и «одного дня».
С добавлением демографических характеристик результаты AUROC/AUPRC значительно улучшились.

Основные категории заболеваний в женских моделях включали особенности дыхательной системы и системы кровообращения на самых ранних этапах, особенности опорно‑двигательного аппарата в модели «пяти лет», заболевания органов чувств и психические расстройства в более поздних моделях.
Основные категории заболеваний в мужских моделях включали особенности эндокринной системы и системы кровообращения на самых ранних этапах, расстройства пищеварительной системы и мочеполовые расстройства в более поздних моделях, и психические расстройства в модели «одного дня».


При сравнении конкретных факторов, предвещающих болезнь Альцгеймера, многие, уже знакомые нам, стали общими для всех подгрупп. К ним относятся: гиперлипидемия, сердечная недостаточность и симптомы расстройств памяти.
К особенностям, определяемым женщинами в разных временных моделях, относится остеопороз, аллергический ринит, инфаркт миокарда, депрессивное расстройство и др.
Среди мужских характеристик — боль в груди, гиповолемия (состояние, при котором в результате избыточной потери жидкости уменьшается объем циркулирующей крови в организме), сексуальные расстройства и появление новообразований и др.

Применение иных методов для прогнозирования болезни Альцгеймера
Для определения факторов, предсказывающих наступление БА, также была протестирована модель логистической регрессии, которая демонстрировала сопоставимые или худшие результаты, по сравнению с моделями случайного леса и также смогла выявить признаки, частично совпадающие с вышеописанными.
Логистическая регрессия — это метод статистического анализа, используемый для моделирования вероятности возникновения определенного события в зависимости от значений различных предикторов. Этот метод часто применяется в задачах бинарной классификации, когда необходимо отнести объекты к одному из двух классов на основе их признаков.
В отличие от обычной линейной регрессии, где зависимая переменная является непрерывной, в логистической регрессии зависимая переменная представляет собой бинарную переменную (обычно 0 или 1). Модель логистической регрессии использует логистическую функцию для преобразования линейной комбинации предикторов в вероятность принадлежности к одному из классов.


В данном случае, например, гиперлипидемия также выделена как значимые признак во всех временных моделях, но при этом остальные важные заболевания недостаточно оценены.
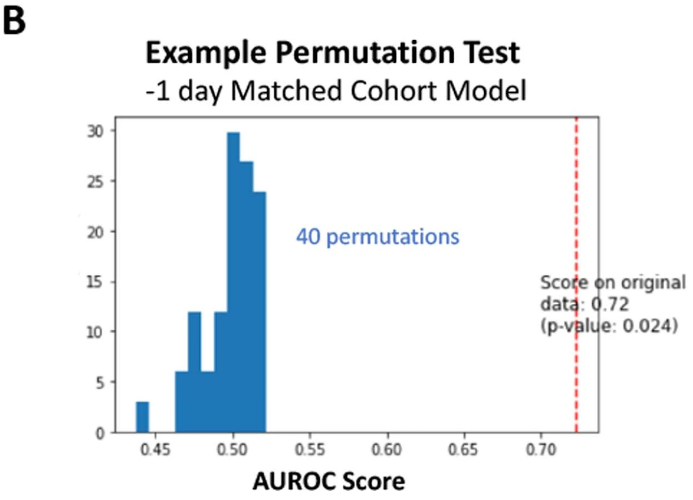
В качестве примера, позволяющего оценить степень значимости клинических признаков для прогнозирования БА, модели случайного леса были переобучены на перестановках истинной метки (для модели «одного дня» с 40 перестановками), в результате чего значение AUROC обученной модели было значительно выше по сравнению с показателями перестановочного распределения (P = 0,024).
Перестановка истинной метки — это процесс, при котором истинные метки целевой переменной в данных (например, наличие болезни у пациента) случайно перемешиваются или переставляются. Этот процесс используется в статистике и машинном обучении для создания нулевой гипотезы или базового уровня, когда не существует связи между предикторами (клиническими характеристиками) и целевой переменной.
Использование графа знаний для определения приоритетных потенциальных характеристик
Далее исследователи использовали граф знаний SPOKE, чтобы использовать существующие сведения для объяснения биологических связей между группами основных клинических признаков модели и болезнью Альцгеймера.
Граф знаний SPOKE (SPOKE knowledge graph) — это графовая база данных, которая интегрирует различные источники биомедицинских знаний, такие как данные о генах, протеинах, болезнях, лекарствах и других биомедицинских сущностях. SPOKE используется для анализа и извлечения информации о биологических взаимосвязях и позволяет исследователям лучше понимать сложные молекулярные и биологические процессы.
Ученые выявили общие биологические признаки (гены, белки и соединения) между 25 основными клиническими предикторами и узлами болезни Альцгеймера (ключевыми компонентами в сети биологических взаимосвязей, играющих важную роль в развитии и прогрессировании болезни) для каждой модели.
К таким генам отнесли: APOE, AKT1, INS, ALB, IL1B, TNF, IL6 и SOD1, а соединениям — аторвастатин, симвастатин, эргокальциферол, прогестерон, эстроген, цианокобаламин и фолиевую кислоту. Эти гены и соединения также имели взаимосвязи с несколькими узлами входных данных модели, особенно с гиперлипидемией и остеопорозом для всех моделей в разные временные периоды. Кроме того, некоторые узлы, такие как C9orf72, TREM2, APP и MAPT (тоже общие), имели взаимосвязи с различными клиническими состояниями, такими как мышечно‑скелетные расстройства, суставные расстройства, глухота и депрессия.

Можно сделать вывод, что на протяжении всего исследования гиперлипидемия и остеопороз были постоянными источниками болезни Альцгеймера, поэтому теперь обсудим эти заболевания.

Гиперлипидемия как важный предиктор болезни Альцгеймера
Для дальнейшего подтверждения полезности моделей исследователи проследили, как гиперлипидемия стала главным признаком, который был последовательным предиктором во всех моделях.
Путем анализа данных из электронных медицинских карт пяти больниц Университета Калифорнии выявили, что у лиц с диагностированной гиперлипидемией прогрессирование болезни Альцгеймера происходило быстрее, чем у людей без этого диагноза.


Это было дополнительно подтверждено анализом пропорциональных рисков Кокса (коэффициент риска (HR) 1,52 (95% доверительный интервал (CI) 1,46–1,57), скорректированный с учетом демографических признаков коэффициент риска (aHR) 1,26 (1,21–1,31), значение P < 0,005).
Регрессия Кокса, или модель пропорциональных рисков, — это метод прогнозирования риска наступления события для рассматриваемого объекта и оценки влияния заранее определённых независимых переменных (предикторов) на этот риск.
Риск рассматривается как функция, зависящая от времени. Регрессия Кокса используется для моделирования времени до наступления конкретного события на основе значений используемых объясняющих переменных. Основным результатом регрессии Кокса является коэффициент риска.

Для исследования потенциальных связей между гиперлипидемией и болезнью Альцгеймера, сеть знаний, специфичная для гиперлипидемии, дала приоритет общим ассоциациям генов с LSS, APOE, INS, SMAD3, ALB и GFPT1.

Пересечения локусов (конкретных физических позиций генов или другой последовательности на хромосоме) между высоким уровнем липопротеинов низкой плотности и болезнью Альцгеймера были выявлены в двух независимых общегеномных ассоциативных исследованиях (GWAS) с участием 408 942 пациентов с болезнью Альцгеймера и 94 595 человек с высоким уровнем холестерина, выявили несколько общих вариантов, включая chr19: 44 892 362(hg38): A > G (rs2 075 650) и chr19: 44 905 579(hg38): T > G (rs405 509).
GWAS (Genome‑Wide Association Study) — это метод исследования, который используется для выявления связей между вариациями в геноме человека и определенными фенотипическими характеристиками, такими как заболевания или физиологические особенности. В рамках GWAS исследователи ищут ассоциации между миллионами однонуклеотидных полиморфизмов (SNP) и конкретными фенотипами, чтобы определить, какие варианты генов могут влиять на различные биологические процессы.
Проще говоря, GWAS помогает нам понять, какие генетические различия могут способствовать развитию различных заболеваний или других характеристик у людей.
Однонуклеотидные полиморфизмы (SNP) — это небольшие генетические изменения, которые происходят в одном нуклеотиде (базовой паре) ДНК. SNP являются наиболее распространенным типом генетических вариаций у людей.
Например, если у одного человека в определенном месте генома может быть аденин (A), а у другого человека в том же месте — цитозин ©, то это будет представлять собой однонуклеотидный полиморфизм.
Таким образом, rs2 075 650 и rs405 509 — это примеры SNP‑маркеров (однонуклеотидных полиморфизмов), которые являются вариациями в геноме человека. Каждый из них имеет уникальный идентификатор, который используется для обозначения конкретного полиморфизма при генетических исследованиях. Эти маркеры могут быть связаны с различными фенотипическими характеристиками или заболеваниями и часто используются в генетических исследованиях для ассоциации с заболеваниями, ответом на лечение и другими биологическими процессами.


Исследования PheWAS для rs2075650 на UK Biobank подтвердили значительные ассоциации с уровнями холестерина, гиперлипидемией, и болезнью Альцгеймера.
Исследования PheWAS (Phenome‑wide association studies) представляют собой метод исследования, который используется для анализа ассоциаций между генетическими вариантами (обычно SNP) и множеством различных фенотипов (характеристик и состояний организма), измеряемых на широком масштабе.
В отличие от типичных GWAS (Genome‑wide association studies), которые обычно фокусируются на одном конкретном фенотипе или болезни, исследования PheWAS направлены на изучение генетических вариантов и их связи с множеством различных фенотипов сразу. Это позволяет исследователям обнаруживать новые ассоциации между геномом и различными фенотипами, а также понимать более широкий спектр влияния генома на организм.

Также упоминается вероятность совместно локализованных локусов H4, указывающая на возможность причинной связи между вариантами локусов для APOE протеина и признаками гиперлипидемии и болезни Альцгеймера.
APOE (аполипопротеин E) — это белок, который кодируется геном APOE и выполняет различные функции в организме. Он играет важную роль в метаболизме липидов и транспорте холестерина по организму.
Варианты гена APOE ассоциируются с риском развития различных заболеваний, включая болезнь Альцгеймера и сердечно‑сосудистые заболевания. Например, аллель ε4 гена APOE связан с увеличенным риском развития болезни Альцгеймера, в то время как аллель ε2 показывает защитный эффект от этого заболевания.

Остеопороз как важный предиктор болезни Альцгеймера
В исследовании было выявлено, что остеопороз является важным признаком для прогнозирования риска развития болезни Альцгеймера у женщин. В результате анализа данных, люди с диагностированным остеопорозом демонстрировали более быстрое прогрессирование болезни Альцгеймера по сравнению с контрольными лицами без остеопороза.


При стратификации по полу, прогрессирование болезни Альцгеймера было значительно у женщин с диагностированным остеопорозом по сравнению с общей женской контрольной группой. Кроме того, анализ пропорциональных рисков Кокса дополнительно подтвердил остеопороз как общий фактор риска для болезни Альцгеймера.

Сеть SPOKE, ориентированная на остеопороз, выявила общие генетические ассоциации с IL6, SMAD3, TNF, HSPG2, GATA1, GFPT1, HFE, INS и ALB.

На основании предыдущих GWAS‑исследований 472 868 человек с БА и 426 824 участников с остеопорозом, в 11 хромосоме был обнаружен общий локус риска между HBMD и БА среди семейства генов MS4A, а ближайший ген — MS4A6A.
Сравнение предыдущих GWAS, включающих до 71 880 человек с Альцгеймером и стратифицированных по полу GWAS для людей с остеопорозом (111 152 женщины, 166 988 мужчин) UK Biobank подтверждает ассоциацию в общем локусе, специфичную для женщин.


Таким образом, анализы показывают связь между геном MS4A6A и болезнью Альцгеймера, а также между остеопорозом у женщин и болезнью Альцгеймера. Весовые ассоциации MS4A6A с другими фенотипами показали ассоциации локуса с множеством воспалительных фенотипов, включая С‑реактивный белок, процент лимфоцитов и количество нейтрофилов.

Выводы
Важно понимать, что данное исследование не сможет со 100% вероятность предсказать начало развития болезни Альцгеймера, однако это уже значительный толчок в понимании природы диагноза.
Если говорить об имеющихся данных о БА в России, можно обратиться к статьям Юсуповской больницы в Москве. В данных материалах выделяют следующие симптомы болезни:
Предеменция. Обнаруживается сложно, так как ее можно ошибочно принять за стресс. Человек испытывает чувство усталости, снижается память (больной не может запомнить список из нескольких наименований, плохо усваивает информацию), исчезает интерес к жизни, появляется замкнутость и апатия.
Ранняя деменция. Симптоматика осложняется дефектами речи: забываются названия предметов быта, снижается скорость речи, сокращается словарный запас, происходит путаница похожих слов, ухудшается почерк. Именно в это время больной обращается в клинику.
Умеренная деменция. Характеризуется затруднениями в построении логических связей. Человек одевается не по погоде, теряется в пространстве, не помнит, как дойти домой, не знает свой адрес, забывает родных и себя самого. Появляется плаксивость, агрессия, нарушается долговременная память.
Тяжелая деменция. Человек полностью деградирует, он не способен управлять физиологическими процессами в организме, не в состоянии самостоятельно принимать пищу.
Все симптомы сводятся к когнитивным расстройствам, а также расстройствам психики и поведения. Эти признаки действительно важны (что также продемонстрировано в исследовании), однако они не рассматривают другие сферы здоровья.
Данное исследование помогает установить, на какие болезни и состояния пациента стоит обращать внимание, чтобы в совокупности с другими симптомами иметь возможность вовремя начать лечение Альцгеймера.
Будьте здоровы и тщательно следите за своим состоянием!
На этом все! Будем ждать Вас в комментариях :)
Спасибо за прочтение!
Комментарии (7)

belonesox
27.03.2024 21:03Спасибо! Это ведь перевод-компиляция? Если да, то наверно добавьте ссылки на оригинальные статьи (и может даже датасеты), если они под рукой.
Или тема как-то связана с вами, и можно задавать осмысленные вопросы вам?

muxa_ru
Они предсказали в 2024-7=2017 году и в 2024 это подтвердилось?
aansty4U Автор
В самом начале статьи я указала, что рассматривались данные пациентов с 1980 по 2021, стабильно проходивших обследование на протяжении 7 лет и имевших подтвержденный диагноз :)
muxa_ru
То что эта модель хорошо срабатывает на примерах на которых её обучили, это понятно.
Вопрос в том, какие реальные подтвердившиеся предсказания были.
А то это выглядит рассказом о том, что новый компакт диск, вышедший на рынок полгода назад, способен хранить информацию в течении 500 лет.
aansty4U Автор
Вы же понимаете, что это качественный рабочий метод, имеющий отличные перспективы применения, несмотря на его новизну. Как только будет достаточная база пациентов, с подтвердившимися предсказаниями в настоящее время - я обязательно напишу новую статью :)