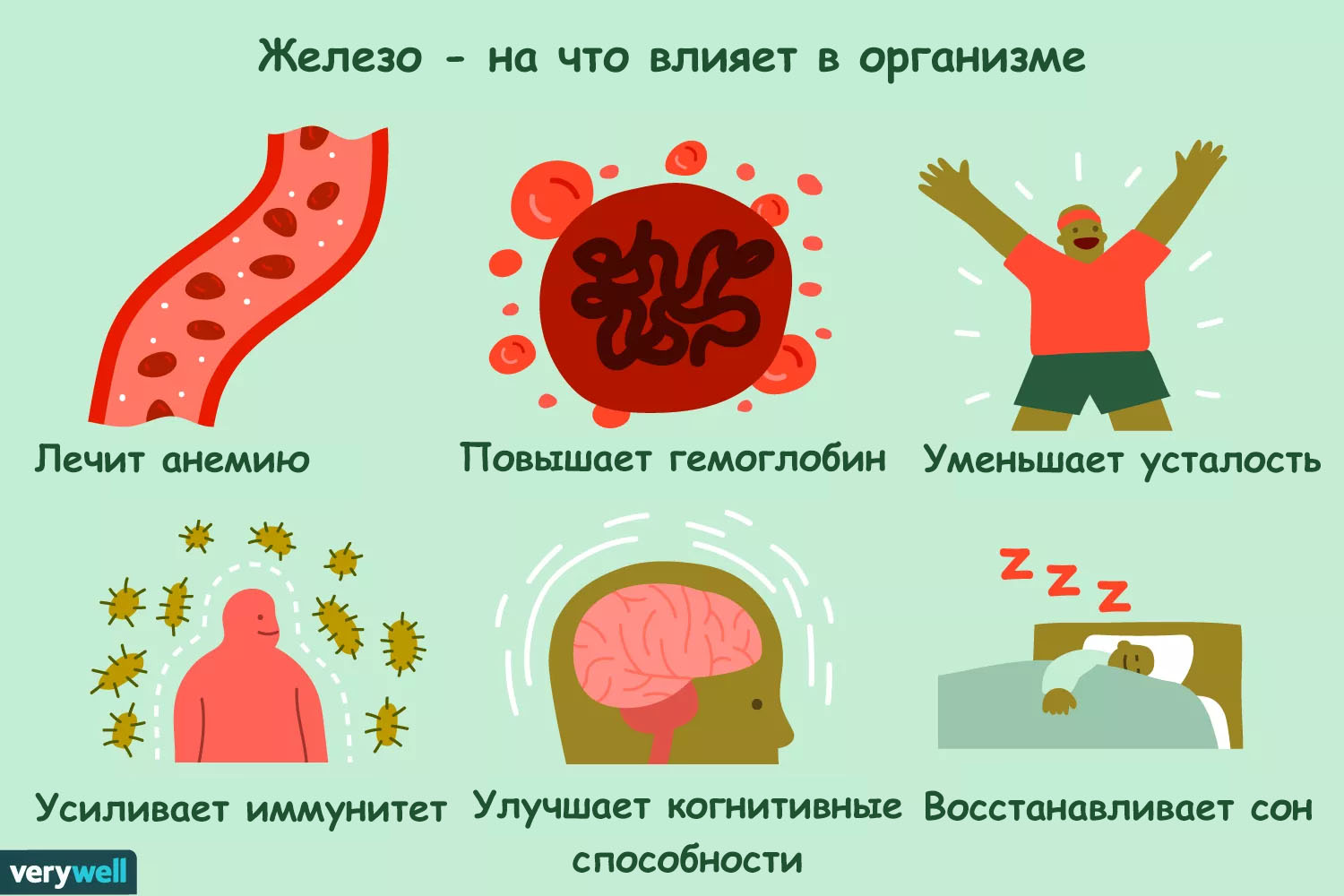
Железо является важным элементом для ряда фундаментальных функций организма, одна из которых, когнитивная способность, критически необходима для гиков.
Кроме этого железо регулирует ряд процессов, часть из которых показана на картинке.
В статье мы разберемся какие бывают причины дисбаланса железа, какие анализы сдавать для контроля и как поддерживать его уровень в нормальном диапазоне.
Гомеостаз железа
Рассмотрим изображение, на котором продемонстрирован гомеостаз железа [1].
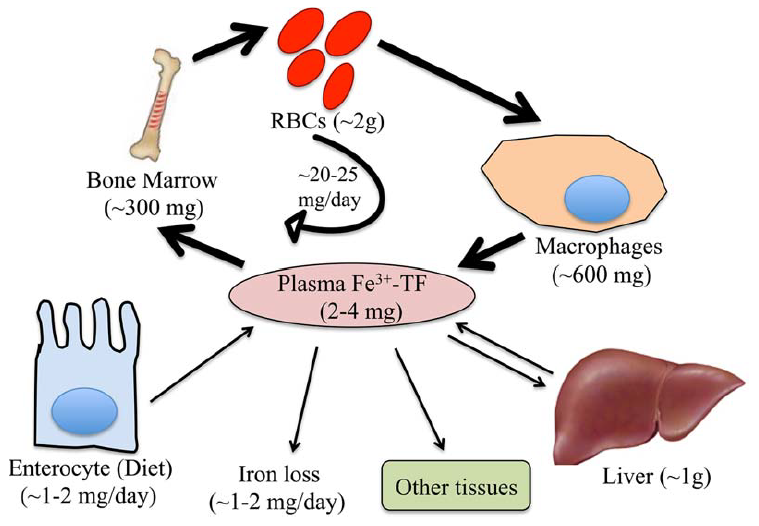
Рис. 1. Системный железный гомеостаз. Железо (Fe) циркулирует в кровотоке, связанном с трансферрином (TF) (белок крови, функцией которого является транспорт железа).
БОльшая часть железа доставляется в костный мозг для производства красных кровяных телец (RBCs), меньшие количества поступают в другие ткани для осуществления фундаментальных клеточных процессов, а избыток транспортируется в печень для хранения.
Системный гомеостаз железа поддерживается преимущественно путем рециркуляции железа из эритроцитов через ретикулоэндотелиальные макрофаги.
Меньшее количество железа обеспечивается всасыванием пищи через энтероциты двенадцатиперстной кишки, что сопровождается нерегулируемой потерей железа в результате отслаивания эпителия и кровопотери [1].
БОльшая часть железа содержится в гемоглобине эритроцитов (2 г железа) и перерабатывается в процессе эритрофагоцитоза ретикулоэндотелиальными макрофагами.
Эти макрофаги являются одним из основных хранилищ железа наряду с гепатоцитами печени (Составляют от 60% до 80% массы печени).
Все другие клетки в организме содержат меньшее количество железа для важных клеточных процессов.
Циркуляционный пул железа сравнительно небольшой (2–4 мг). Он осуществляется каждые несколько часов для удовлетворения суточной потребности организма, а также для поддержания эритропоэза (в ходе него образуются красные кровяные клетки) и других потребностей организма (20–25 мг).
Приблизительно 1–2 мг железа обеспечивается диетическим всасыванием в двенадцатиперстной кишке, что компенсируется нерегулируемой потерей 1–2 мг железа, главным образом, через десквамацию эпителия и кровопотерю.
Выделение железа с мочой, по-видимому, минимально, из-за связанной с трансферрином формы циркулирующего железа и множественных механизмов регенерации железа в почках.
Поскольку потери железа в организме не регулируются, основные пути регулирования системного баланса железа заключаются в контроле обновления железа в рационе и высвобождения железа из рециркулирующих макрофагов и гепатоцитов [1].
Болезни связанные с нарушениями метаболизма железа
Дефицит железа
Наиболее распространенное клиническое проявление дефицита железа это анемия (это снижение количества переносящих кислород красных кровяных клеток).
По данным Всемирной организации здравоохранения, анемия поражает почти четверть населения мира, причем 50 % случаев связаны с дефицитом железа [2].
Основные последствия анемии для здоровья включают повышенный риск материнской и детской смертности, нарушение когнитивного и физического развития у детей, снижение физической работоспособности и производительности труда у взрослых, а также снижение когнитивных способностей у пожилых людей.
В группе риска находятся дети, женщины во время беременности, люди с хроническими заболеваниями почек (в том числе на фоне проведения гемодиализа), люди, систематически употребляющие такие препараты как аспирин, нестероидные противовоспалительные (ибупрофен, кетопрофен), а также препараты ухудшающие усвоение железа энтероцитами (фосфатные связующие, антациды) [1].
Избыток железа
Основными причинами системной перегрузки железом являются врождённые или наследственные заболевания (гемохроматоз, талассемия, врожденные дизеритропоэтические анемии, сидеробластные анемии, миелодиспластические синдромы – группа заболеваний костного мозга (могут приводить к остеопорозу) [3]) и трансфузионные (связаны с переливанием крови) или другие вторичные формы перегрузки железом.
Перегрузка железом может привести сахарному диабету, другим эндокринопатиям, а также в некоторых случаях к росту злокачественных опухолей [4,5].
Окислительному стрессу подвергаются органы эндокринной системы, в частности, поджелудочная железа (панкреатин).
Важно отметить, что перегрузка железом снижает чувствительность организма к инсулину.
Сердце является одним из основных органов, где железо накапливается при наследственных гематохроматозе и таласемии. Это приводит к перегрузке сердца, нарушению электрической функции сердца, развитию фиброза.
Печень является главным хранилищем железа и основным органом, который утилизирует избыток циркулирующего несвязанного трансферином железа в условиях перегрузки.
В случае перегрузки происходят окислительно-обусловленные повреждения печени, что может привести к циррозу печени.
Алкоголизм, ожирение, вирусный гепатит являются основными факторами риска [1].
Железо и мозг
Железо является наиболее распространенным переходным металлом в мозге, оно необходимо для поддержания высокой дыхательной активности мозга, для миелиногенеза (процесс образования нервных волокон) и для производства таких нейротрансмиттеров как дофамин и норадреналин.
Дефицит железа влияет на развитие мозга и способность познания.
Перегрузка железом была связана со многими нейродегенеративными нарушениями (болезнь Альцгеймера, Паркинсона)[6].
Железо и инфекции
Помимо всего этого, важно отметить, что многим патогенным микроорганизмам необходимо железо.
Было выдвинуто предположение, что одной из функций системы гепсидин (гормон)- ферропортин (белок) у людей является ограничение доступности железа для микроорганизмов путем изоляции железа в макрофагах и снижения уровня циркулирующего железа. Например, железодефицит может сигнализировать о таких заболеваниях как малярия, диарейные заболевания, туберкулёз [7].
Диагностика
Одним из основных показателей уровня железа в организме является сывороточное железо, оно было открыто еще в далеком 1930-ом году и как раз-таки в норме должно соответствовать 2-4 мг для каждого индивидуума, как это продемонстрировано на рисунке 1 (сыворотка — это плазма крови, лишенная фибриногена).
Помимо сывороточного железа основными показателями метаболизма железа являются гемоглобин, ферритин и трансферрин. Если по-простому, то железо отвечает за обеспечение нашего организма кислородом.
Перейдем к диагностике.
Диагностика дефицита железа с помощью полного анализа крови может быть трудной и осложняться сопутствующим воспалением [8].
Результаты исследований железа всегда следует интерпретировать как общую картину, а не фокусироваться на отдельных параметрах.
Важно также вести подробный анамнез, сложно делать выводы на основании однократного проведения анализов.
Предложен упрощенный алгоритм диагностики железодефицита на основе сывороточных уровней ферритина (SF) и процентной насыщенности трансферрина (TST) (рис. 2):
1) Хотя бы раз в год, независимо от пола и возраста, сдаём общий анализ крови. В общем, если вы попадаете в больницу с какими-либо проблемами, так или иначе кровь у вас возьмут и неплохо бы поинтересоваться результатами своих анализов. Если видим сдвиги гемоглобина или гематокрита от референсных значений, то переходим к следующим пунктам.
2) Начальный этап оценки сводится к исключению ?-талассемического признака, сделать это можно согласно таблице 1, основным критерием является сильное снижение общего количества клеток.
Таблица 1. Интерпретация анализов связанных с метаболизмом железа [8].
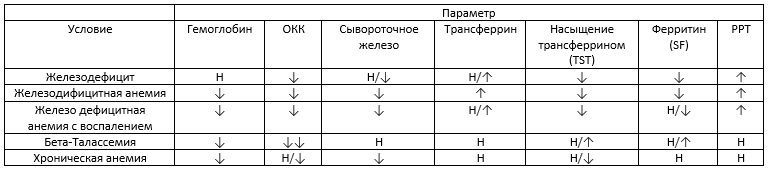
ОКК – общее количество клеток, Н – норма, v -понижение, ^ — повышение, vv — сильное понижение, РРТ — Растворимые рецепторы трансферрина.
3) Используя значения SF и TST определяем условные три подгруппы с анемиями: пациенты с (1) SF > 100 мкг / л и TST 20–50%; (2) SF > 100 мкг / л и TST < 20%; (3) SF < 30 мкг / л и TST < 20%.
4) Для первых двух групп стоит проверить показатели С-реактивного белка и исключить или подтвердить наличие хронических воспалительных процессов и обратиться к соответствующим врачам или терапевту.
5) Для второй и третьей групп вероятна хроническая анемия. Для второй группы важным критерием при назначении лечения являются уровни гемоглобина (таблица 3), исходя из них подбирается соответствующие дозировки препаратов железа. Для этой группы подходят препараты железа для перорального употребления, но в некоторых случаях возможно внутривенное (ВВ) введение препарата. В эту группу входят люди пожилого возраста, а также люди с нарушениями почек и сердечно-сосудистой системы.
6) Для третьей группы также назначается железозаместительная терапия. Это группа с возвращающимся железодефицитом. Частный случай — терапия не помогает, объяснить это можно наличием болезней ЖКТ [9]. Соответственно, идти надо к терапевту или сразу к гастроэнтерологу. Также в эту группу входят люди с низкой усвояемостью железа. Для этой группы предпочтительно внутривенное ВВ препаратов железа.
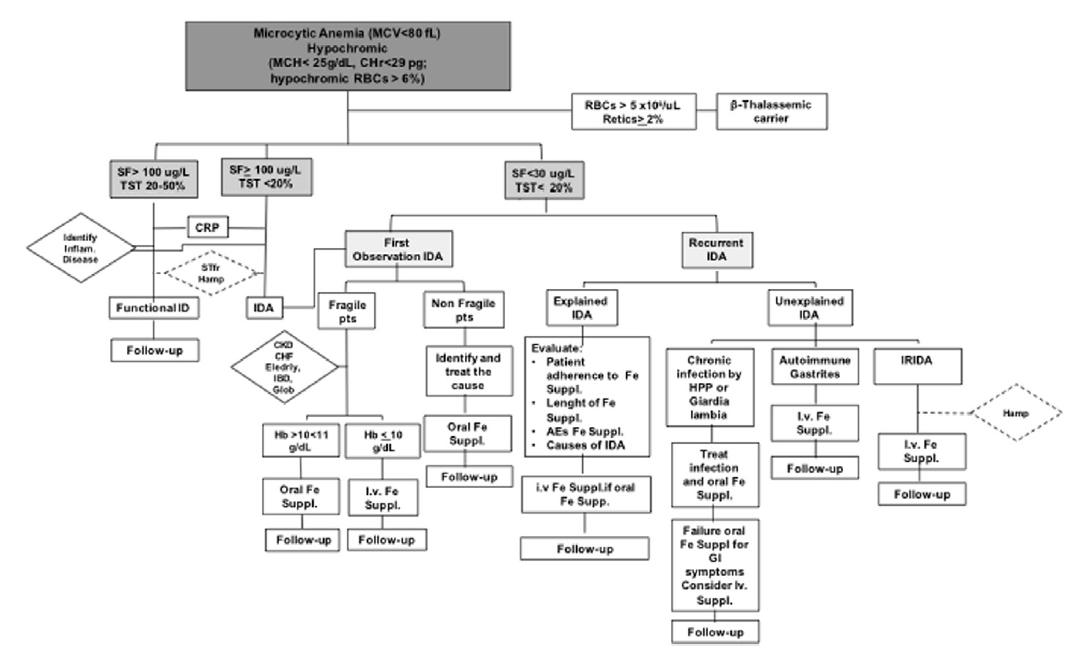
Рис. 2. Алгоритм действий при анемии [9].
Тезисно:
- Пациентов следует контролировать, даже если выявлена вероятная причина дефицита железа. — В случае дефицита железа нужно поставлять его извне.
- Пациенты, у которых не наблюдается позитивных изменений при терапии, должны быть направлены на исследования, исключающие внутреннее кровотечение.
- Для большинства взрослых пациентов рекомендуется ежедневное употребление перорального железа (30-100 мг элементарного железа) (таблица 2) в качестве первичной терапии.
- Безопасным и эффективным препаратом для внутривенных (ВВ) инфузий железа стал трехвалентный карбоксимальтозат.
- Подобные меры необходимы только для тех пациентов, которые не реагируют на парентальный (через рот) приём препаратов. Переливание крови является крайней мерой при железодефицитной анемии, которая применяется только в ситуациях, где жизнь пациента находится под угрозой.
Таблица 2. Железозаместительная терапия [8]. Терапия 1 линии предпочтительна.
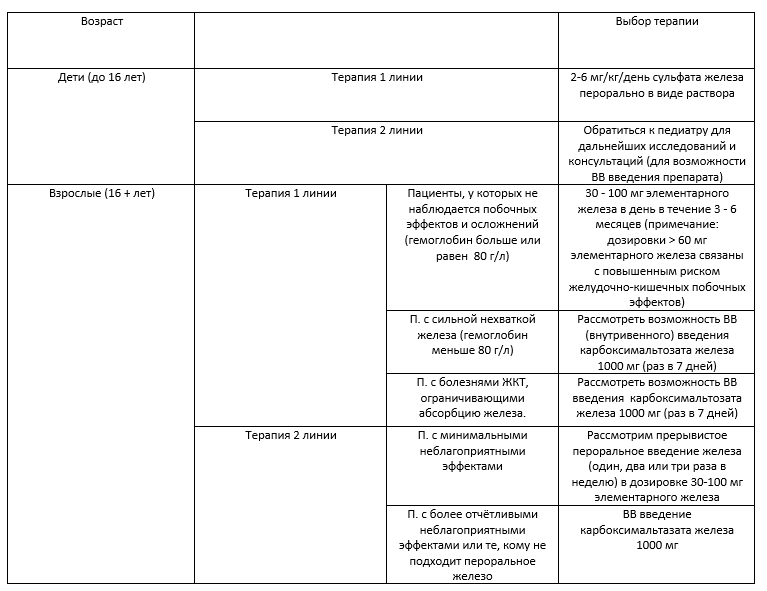
К основным побочным эффектам приема железа относятся такие эффекты как запор/диарея, тошнота, изменения цвета стула.
Подбор препаратов
Рискну заявить, что выбор препарата для перорального приема весомого значения не имеет. Однако к препарату для ВВ введения необходимо подойти с умом и, желательно, проконсультироваться с врачом.
В качестве основных современных препаратов для ВВ введения выступают карбоксимальтазат железа, ферумокситол, сахарат железа, натрия железа глюконат комплекс, а также высокомолекулярный декстран железа и низкомолекулярный декстран железа. Рисками при приёме подобных препаратов являются аллергические реакции и перегрузка железом.
Предпочтительными препаратами являются карбоксимальтазат железа, а также низкомолекулярный декстран железа.
Причины железодифицита
Основными причинами железодефицита являются неправильно питание или кровопотери (таблица 3).
Таблица 3. Основные причины железодефицита [8]

Диета
Для того чтобы минимизировать риски железодефицита можно следить за диетой.
Суточная норма железа – 10 – 30 мг (таблица 4).
Таблица 4. Примерное содержание железа в пище.
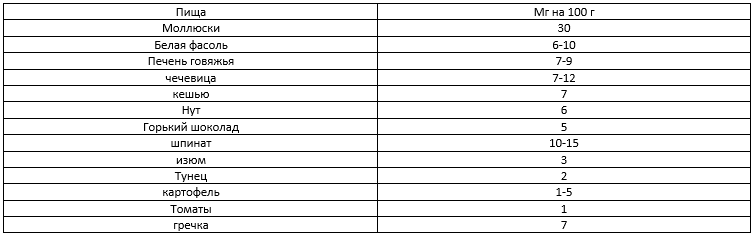
Самыми богатыми на железо продуктами являются бобовые, овощи и зелень, яйца, рыба и морепродукты, мясные продукты и субпродукты. То есть вегетарианцам для снижения рисков достаточно добавить некоторые продукты из списка в свой рацион.
В заключение хотелось бы сказать, что самостоятельно бороться с нарушениями баланса железа можно, но лучше обратиться к врачу.
Важнейшим для понимания моментом является то, что во многих случаях нарушения, связанные с железом, это сигнал о том, что что-то в организме не так и изменения в метаболизме являются индикаторами различных заболеваний, зачастую очень серьезных.
Помимо этого, не стоит забывать про правильное питание, регулярные занятия спортом, желательно на открытом воздухе, отказ от алкоголя и других вредных привычек, это позволит вам выйти из группы риска возникновения многих заболеваний.
Финальные рекомендации
Раз в год сдавать анализы на гемоглобин, ферритин, трансферрин, сывороточное железо. В случае их отклонения от нормы желательно сдать анализ на C-реактивный белок (можно и сразу вместе, этот анализ тоже входит в ежегодно рекомендуемые для сдачи) и, потом, с результатами анализов, сходить к врачу.
Предварительно можно самостоятельно изучить причины по диаграмме на картинке выше, чтобы быть в курсе возможных диагнозов и информированно общаться с врачом.
Спасибо за внимание, надеюсь статья была полезной.
На любые вопросы с радостью отвечу в комментариях.
Приложение Lifext зачем, какие перспективы
Мы сделали приложение, в котором внедряем все методики продления жизни. Прямо сейчас выпущена ранняя версия, где работает мониторинг и индивидуальная оценка анализов.
Оцениваются общие нормы и нормы Lifext.
Приложение мультиязычное — пока английский + русский.
Хранение анализов надежное, в облаке Google. Сразу выдает попадание анализа в общие нормы и нормы Lifext, с учетом пола и возраста. В следующей версии будет возможность добавлять любые анализы (не только из списка) + напоминалки когда их надо сдавать.
Сделана ранняя подписка — 120руб. в месяц (примерно 1,9$, при плавании курса цена может меняться). При внедрении крутых фич подписка будет дороже, но для ранних пользователей цена навсегда останется такой. Просим рассматривать эту раннюю подписку как что-то вроде краудфандинга, так как написание приложения, проведение исследований и прочие активности становятся невозможными только на энтузиазме.
Пока есть глюки и баги, но мы постоянно все улучшаем, просим относиться с пониманием ;)
Другие наши статьи-исследования
- Здоровье мозга и тела в долгосрочной перспективе
- Витамин D
- Медитация
- Омоложение организма, замедление старения — как измерить эффективность методик и/или лекарств
- Стресс
- Как мы стареем
- Интервальное голодание
Наши каналы
[1] S. Dev, J.L. Babitt, Overview of iron metabolism in health and disease, Hemodial. Int. 21 (2017) S6–S20. doi:10.1111/hdi.12542.
[2] E. McLean, M. Cogswell, I. Egli, D. Wojdyla, B. De Benoist, Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005, Public Health Nutr. 12 (2009) 444–454. doi:10.1017/S1368980008002401.
[3] P. Guggenbuhl, Y. Deugnier, J.F. Boisdet, Y. Rolland, A. Perdriger, Y. Pawlotsky, G. Chales, Bone mineral density in men with genetic hemochromatosis and HFE gene mutation, Osteoporos. Int. 16 (2005) 1809–1814. doi:10.1007/s00198-005-1934-0.
[4] A.L. Fracanzani, D. Conte, M. Fraquelli, E. Taioli, M. Mattioli, A. Losco, S. Fargion, Increased cancer risk in a cohort of 230 patients with hereditary hemochromatosis in comparison to matched control patients with non-iron-related chronic liver disease, Hepatology. 33 (2001) 647–651. doi:10.1053/jhep.2001.22506.
[5] C. Borgna-Pignatti, G. Vergine, T. Lombardo, M.D. Cappellini, P. Cianciulli, A. Maggio, D. Renda, M.E. Lai, A. Mandas, G. Forni, A. Piga, M.G. Bisconte, Hepatocellular carcinoma in the thalassaemia syndromes, Br. J. Haematol. 124 (2004) 114–117. doi:10.1046/j.1365-2141.2003.04732.x.
[6] A. Poujois, J.C. Devedjian, C. Moreau, D. Devos, P. Chaine, F. Woimant, J.A. Duce, Bioavailable Trace Metals in Neurological Diseases, Curr. Treat. Options Neurol. 18 (2016). doi:10.1007/s11940-016-0426-1.
[7] M.J. Murray, A.B. Murray, M.B. Murray, C.J. Murray, The adverse effect of iron repletion on the course of certain infections, Br. Med. J. 2 (1978) 1113–1115. doi:10.1136/bmj.2.6145.1113.
[8] M.S.Y. Low, G. Grigoriadis, Iron deficiency and new insights into therapy, Med. J. Aust. 207 (2017) 81–87. doi:10.5694/mja16.01304.
[9] L. De Franceschi, A. Iolascon, A. Taher, M.D. Cappellini, Clinical management of iron deficiency anemia in adults: Systemic review on advances in diagnosis and treatment, Eur. J. Intern. Med. 42 (2017) 16–23. doi:10.1016/j.ejim.2017.04.018.



makisseleva
Вообще гемоглобин — такой себе показатель. Можно ходить с нормальным гемоглобином и при этом иметь серьезный дефицит железа. Если низкий гемоглобин — это уже полный аут, приехали. В этом плане анализ на ферритин даст куда больше информации, он покажет как раз эту слепую зону, когда еще не анемия, но уже стоит предпринимать какие-то меры, чтобы в это состояние не скатиться
п.с. еще одна зона риска — люди, интенсивно занимающиеся спортом. Ну, то есть не два раза в неделю в спортзал, а больше 50-60 км бега в неделю
JIeM Автор
согласен, что по гемоглобину можно не заметить железодефицит, но это, так сказать, способ для людей, которые не хотят сильно заморачиваться, поэтому для диагностики неплохо использовать комплекс анализов. Из таблицы 1 можно заметить, что вы правы и для людей, которых беспокоит этот вопрос, расклады проинтерпретированы.
JIeM Автор
по идее отдельный анализ на ферритин может быть тоже не информативен, например, в случае воспаления, и тогда неплохо бы еще сдать и трансферрин, и сывороточное железо и C-реактивный белок