Существует много методов решения этой задачи, большинство из них относится к хроматографии. О том, как эти методы работают читайте под катом.
Неподвижная фаза «ловит» проплывающие мимо молекулы за их (-ОН)-группы.
Итак, мы получили нужный нам штамм и нарастили биомассу. Теперь нам нужно как-то вынуть из неё наш белок.
Первым делом мы берём нашу культуру и разливаем по флаконам для центрифугирования. Бактерии — довольно крупные и тяжёлые объекты, поэтому для их осаждения не нужны монструозные значения перегрузки при центрифугировании: 10000g в течение 20 минут хватит с лихвой. В итоге мы получим осадок на дне флаконов и жидкость (её называют супернатант). Жидкость мы выливаем, так как наш белок находится в бактериях, которые в осадке. Дальше можно действовать по обстоятельствам: либо сразу работать с полученным осадком, либо заморозить и хранить до тех пор, пока он не понадобится. Храниться он может очень долго. Дальнейшая процедура работы с осадком не зависит от того хранили мы его в морозильнике или нет.
Допустим, пришло время работать с осадком. Что дальше?
Первым делом нам нужно разрушить клетки, чтобы белок мог выбраться наружу. Для этого используют следующие способы:
- Последовательная заморозка-разморозка. Не самое эффективное средство для разрушения клеточной оболочки, зато оно безопасно для белка, поэтому часто начинают с нескольких таких циклов, а затем переходят к более эффективным методам;
- Обработка ультразвуком (соникация). Метод широко используется, он прост и эффективен. Обычно ультразвук подаётся напрямую в объём воды с помощью продолговатого «динамика», который вставляется в жидкость с клетками так, что конец «динамика» почти достаёт до дна. Это довольно «жёсткий» метод". Также есть более «мягкая» альтернатива — ультразвук подаётся в водяную ванночку, в которой плавают пробирки.

Выпускник MIT предупреждает — внимательно следите за своими соникаторами.
При проведении ультразвукового разрушения клеток важно следить за температурой: вода быстро нагревается под воздействием ультразвука, а нам совсем не нужна денатурация нашего белка и тем более нам не хотелось бы его кипятить. Поэтому в первом случае (с «вытянутой колонкой») пробирку с клетками вставляют в чашку со льдом и водой, причём льда должно быть много. Вода в данном случае выступает в качестве термоинтерфейса между льдом и охлаждаемой им пробиркой. В случае с «мягкой альтернативой» лёд добавляют непосредственно в водяную ванночку.
Демонстрация «жёсткой» ультразвуковой обработки. Обратите внимание на жуткий шум, стоящий около установки, он особенно хорошо слышен на 2:06 данного видео. Спасается кто как может: кто-то старается выходить на время соникации из помещения, кто-то носит специальные шумопоглощающие наушники.
Демонстрация «мягкой» ультразвуковой обработки.
- Добавление лизирующих агентов в среду. В основном это детергенты, то есть «мыло» (вообще слово «detergent» в английском означает «моющее средство»). Детергенты по сути являются родственниками липидов в мембранах клеток. Попадая в среду с клетками детергенты начинают встраиваться в мембраны, что приводит к их разрушению. А нам только этого и надо. Иногда также добавляют лизоцим — фермент, разрушающий клеточную стенку бактерий.
- Френч пресс. Суспензия клеток засасывается через входной клапан в рабочий цилиндр, откуда выдавливается прессом через узкую щель. Поперечные силы, возникающие при падении давления до атмосферного при прохождении клетками щели, приводят к разрушению клеточной стенки и мембраны.
По своему опыту могу сказать, что соникации в сочетании с детергентами обычно более чем достаточно.
Итак, мы получили клеточный лизат — «суп», состоящий из нужного нам белка и огромного количества «мусора» (хромосомной и плазмидной ДНК, кусков клеточной стенки, разнообразных белков, etc.). Как от всего этого избавляться?
Первый вопрос, на который нужно при этом ответить: «В каком виде наш белок существовал в клетке?». Тут есть два основных варианта:
- Белок был растворим до лизиса и с очень высокой долей вероятности таким и остался после него, значит мы не сможем осадить его центрифугированием. Зато мы можем осадить крупный «мусор», оставшийся после лизиса: так мы избавимся от кусков клеточной стенки, хромосомной ДНК и прочих крупных фрагментов. Осадок выбрасывается, а супернатант отправляется на хроматографию;
- Белок в условиях бактериальной цитоплазмы был нерастворим и он образовал т.н. «тельца включения», сохранившиеся после лизиса. Тельца включения — это белковые шарики, которые образуются в том случае, если белок во время синтеза не успевает сфолдироваться (то есть принять свою нормальную растворимую форму) до того, как столкнётся с другим таким же несфолдированным белком. У несфолдированных белков почти всегда есть торчащие наружу гидрофобные участки, с помощью которых они и прилипнут друг к другу. После того, как два белка «слиплись» у них уже недостаточно степеней свободы для того, чтобы завершить свой фолдинг. Потом к ним подплывает третий, четвёртый, пятый…. В итоге образуется белковая гранула. Обычно это происходит тогда, когда мы синтезируем в бактерии эукариотические белки (как я уже писал ранее, бактерия не умеет производить их фолдинг). В итоге мы имеем массу белка с «плохой» пространственной структурой. Но нет худа без добра, ведь в итоге образуются гранулы, почти полностью состоящие из нужного нам белка!
Поскольку в данном случае наш белок нерастворим, то при центрифугировании он вместе с «мусором» оказывается в осадке. Супернатант мы выбрасываем, а затем находящиеся в осадке тельца отмываются от всего ненужного следующим образом:
- Налили отмывочный буфер №1, в котором растворяется «мусорный компонент осадка №1»;
- Размешали осадок до однородности и поставили на шейкер (прибор, который взбалтывает);
- Отцентрифугировали и вылили супернатант. В итоге то, что растворилось в отмывочном буфере №1 мы отделили от осадка;
- Налили отмывочный буфер №2, в котором растворяется «мусорный компонент осадка №2»;
- Ну и так далее. В общей сложности обычно нужно около 5 промывок.
Ещё раз напомню, что если мы имеем дело с тельцами включения, то мы имеем дело с несфолдированным белком, а значит он не в состоянии выполнять заложенные в него функции. Поэтому перед последующей очисткой проводят его рефолдинг, то есть приводят в активную форму. Самый распространённый метод рефолдинга состоит из следующих этапов:
- Растворить тельца в «нефизиологических» условиях. Обычно тельца хорошо растворяются при высоких значениях рН (около 12) в присутствии двухмолярной мочевины. Идея этого метода в том, что при высоком рН в среде очень мало протонов и все, кто мог бы от них избавиться с лёгкостью это делают. Протон заряжен положительно, значит все доноры протонов получают отрицательный заряд, ну а дальше всё делает закон Кулона — имеющие большой отрицательный заряд белки начинают отталкиваться друг от друга;
- По капле добавлять весь объём «раствора белка» из первого пункта в гораздо больший активно перемешиваемый объём буфера с комфортными для белка условиями. Идея этого этапа в том, что при низкой концентрации белка у него гораздо больше шансов сфолдироваться перед тем, как он встретится со своим несфолдированным собратом. Обычно покапельный перенос белкового раствора производят в объёмы буфера, превышающие объём самого раствора минимум в 10 раз.
Итак, у нас готовы некоторые объёмы растворов белка в сфолдированном состоянии. Дальнейшая процедура одинакова для любых «начальных условий» — мы фильтруем наши растворы через фильтры с размером пор 100-450 нм (чтобы не засорить хроматографические колонки и сам хроматограф), а затем проводим хроматографию.
Типы хроматографии
Принцип любой хроматографии заключается в том, что различные компоненты раствора двигаются через колонку с разными скоростями, в итоге шедшие «на входе в колонку» вместе компоненты оказываются на выходе в разное время.
Но сначала вспомним ещё один метод — белковый электрофорез в геле.
Этот метод позволяет разделять белки согласно их массам. Для этого в пробу добавляют буфер, содержащий SDS и краситель (обычно это бромфеноловый синий). При этом плотность буфера выше плотности воды, это сделано для того, чтобы смесь образца и буфера было проще вносить в лунки на геле. Краситель добавляют для контроля процедуры внесения образца в лунку, а также он служит в качестве индикатора того, что форез пора заканчивать: краска движется быстрее белка, поэтому когда она достигает конца геля форез прекращают. Это очень удобно, так как движение белка по гелю мы не видим.
SDS-ПААГ электрофорез. Лучше один раз прочитать и увидеть, чем сто раз прочитать. В первую лунку на форезе в видео нанесён маркер молекулярной массы, а в остальные лунки нанесены исследуемые образцы.
SDS является ключевым компонентом: этот отрицательно заряженный детергент (ПАВ) денатурирует белки, после чего он их «окружает», при этом получается, что количество прилипших к белку молекул SDS прямо пропорционально его массе. Тогда из закона Кулона следует, что при отсутствии какого-либо сопротивления движению все окружённые молекулами SDS белки имели бы одинаковые ускорения в электрическом поле (сила растёт линейно с ростом заряда, но линейно с зарядом растёт и масса).
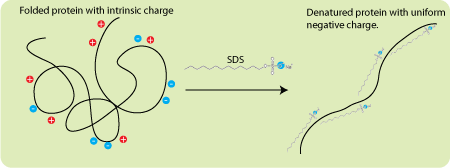
Схема действия отрицательного заряженного детергента SDS на белок. Сначала он его денатурирует, а затем «обволакивает». В итоге белок заключается в состоящую из SDS отрицательно заряженную оболочку, заряд которой прямо пропорционален массе белка.
И тут нам на помощь приходит ПААГ (ПААГ — полиакриламидный гель). При полимеризации он образует сеть каналов приблизительно одного и того же диаметра, через которую при прочих равных маленькие объекты движутся быстрее больших. Очевидно, что тяжёлый белок крупнее лёгкого, поэтому лёгкие белки двигаются быстрее.
После окончания процедуры электрофореза гель окрашивают. Точнее, окрашиваются те места, в которых в геле находится белок — получаются синие полоски (или чёрные, смотря чем красить). Для того, чтобы понять какой массе соответствует та или иная полоса нужно с чем-то сравнивать, поэтому на каждый гель наносят т.н. «маркер молекулярной массы» — смесь компонентов с известными массами.
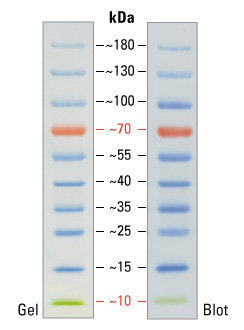
Пример полосок маркера молекулярной массы. Данный маркер удобен ещё и тем, что две полосы у него окрашены в индивидуальный цвет: красная (70 килодальтон) и зелёная (10 килодальтон). Это очень помогает экспериментатору ориентироваться в самом маркере. 1 дальтон, он же атомная единица массы, определяется как 1?12 массы свободного покоящегося атома углерода-12, находящегося в основном состоянии.
Казалось бы, чудо, а не метод — полоски не перекрываются, а значит белки идеально разделились! Но на деле учёные так и не научились проводить белковый электрофорез в промышленных масштабах и поэтому мы до сих пор используем колоночную хроматографию.
Примерная схема любой хроматографии. Колонка представляет собой чем-то наполненный цилиндр. Это «что-то» называется «неподвижная фаза», а «подвижной фазой» является раствор, компоненты которого нам нужно разделить. Компоненты движутся с разной скоростью и потому выходят из колонки порознь.
Большинство хроматографических приёмов основаны на том, что проплывающие мимо белки цепляются за неподвижный наполнитель колонки «с разным энтузиазмом»: те, кто «цепляются» часто и сильно движутся медленнее всех, а те, кто не «цепляется» ни за что быстро покидают колонку. В итоге существенная часть смеси часто выходит из колонки, так и не «зацепившись» за неё — они выходят вместе в самом начале хроматографии (эта фракция называется «проскок», так как они проскочили колонку, не «зацепившись» за неё). Но что делать с теми, кто «зацепился»?
Для начала разберёмся с тем, что происходит в колонке с теми, кто «цепляется». Сам «зацеп» происходит потому, что на поверхности неподвижной фазы есть что-то такое, что способно на время «захватить» проплывающий мимо белок (о том, как это происходит — чуть ниже). То есть «цепляющийся» белок проводит некоторое время в связанном с твёрдой фазой состоянии, затем отрывается от неё (в силу собственного теплового движения, соударений и т.д.), плывёт дальше, опять связывается с твёрдой фазой, опять отрывается и так до тех пор, пока он не покинет колонку. Понятно, что чем чаще и чем крепче он связывается с неподвижной фазой, тем медленнее он движется вдоль колонки.
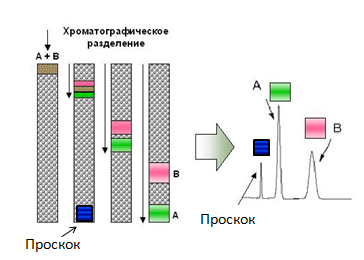
Принцип хроматографии. То, что не связывается с колонкой (проскок) движется со скоростью подвижной фазы (с поправкой на размер). Связывающиеся компоненты имеют разную скорость, что и приводит к их разделению на выходе.
Вообще говоря, только в случае большого невезения в смеси будут разные компоненты, которые движутся с одинаковой скоростью, поэтому мы можем просто подождать, когда они выйдут из колонки. Но зачастую «просто ждать» очень долго, так как движутся компоненты медленно. В этом случае их нужно «подгонять», а способ их «подгонять» зависит от типа колонки.
Наконец, рассмотрим сами хроматографические методы, которые подходят для промышленного получения белов.
- Ионообменная хроматография. Идея метода в том, что неподвижная фаза в условиях проведения хроматографии имеет заряд. Если заряд положительный, то говорят об «анионообменной хроматографии», если отрицательный, то о «катионообменной».
Логика названия проста, рассмотрим её на примере анионообменника: к положительно заряженной твёрдой фазе колонки «липнут» отрицательно заряженные компоненты смеси. При этом если мы будем следить за какой-то конкретной положительно заряженной группой на поверхности твёрдой фазы, то к ней поочерёдно будут «липнуть» и отрываться те или иные отрицательно заряженные компоненты. Таким образом, происходит своего рода обмен анионами между неподвижной и подвижной фазами, отсюда и название — «анионообменная хроматография».
Очевидно, что если мы хотим использовать анионообменную хроматографию, то мы должны проводить разделение смеси в таких условиях, при которых твёрдая фаза заряжена положительно. При этом у нас есть на выбор два варианта дальнейшего развития событий в зависимости от того, какой заряд при этих условиях имеет белок: если "-", то он «сядет» на колонку, а если "+", то он окажется в проскоке.
Как ускорить выход связанных компонентов, то есть как провести «элюцию»? Можно действовать двумя способами:
- Можно изменить заряд неподвижной фазы и связавшихся компонентов с помощью изменения рН подвижной фазы. Важно производить процесс изменения рН постепенно, тогда компоненты ускорят своё движение, но не «вывалятся» при этом все сразу;
- Добавить в колонку другие анионы. Действительно, колонка располагает конечным числом мест, за которые могут зацепиться анионы и если мы чем-то займём все эти места, то компоненты смеси будут двигаться быстрее. Для анионообменной хроматографии типично добавление анионов хлора. Внесение конкурирующих анионов также следует проводить постепенно.
Методика проведения катионообменной хроматографии в целом та же, только всё наоборот.
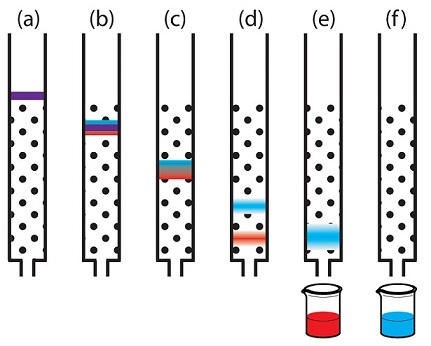
Катионообменная хроматография с элюцией за счёт изменения рН подвижной фазы.
1 — при рН=2 в подвижной фазе очень много протонов, поэтому все компоненты смеси нахватались их из жидкости, получив при этом положительный заряд;
2 — при рН=5 количество протонов в подвижной фазе снизилось и «пурпурный» компонент уже выступает не в качестве акцептора, а в качестве донора протонов, стало быть у него при данном значении рН заряд отрицательный и он покидает колонку. «Зелёный» компонент всё ещё выступает в роли акцептора протонов и он сохраняет положительный заряд при данном значении рН, значит он пока держится за колонку;
3 — при рН=9 в подвижной фазе очень мало протонов, «зелёный» компонент тоже становится донором протонов, приобретает отрицательный заряд и покидает колонку последним.
В общем и целом выбор типа ионообменника и условий проведения разделения зависит от того, что мы хотим выделить и что ещё есть в нашей смеси.
- Можно изменить заряд неподвижной фазы и связавшихся компонентов с помощью изменения рН подвижной фазы. Важно производить процесс изменения рН постепенно, тогда компоненты ускорят своё движение, но не «вывалятся» при этом все сразу;
- Ещё один метод разделения основан на гидрофобности (~неполярности) и гидрофильности (~полярности) тех или иных веществ. Идея тут точно такая же, как и в случае с ионообменником: компоненты согласно своим физическим свойствам «мечутся» между гидрофобной и гидрофильной средами, кто-то задерживается больше, кто-то меньше.
Прежде всего напомню, что неполярное растворяется в неполярном, а полярное в полярном. Зачастую «гидрофобный» и «неполярный» это одно и то же, как и «гидрофильный» и «полярный», хотя в общем случае это не так. Примером неполярного растворителя является этанол, а примером полярного — вода.

Полярный медведь сетует на то, что он растворяется в воде, которая является полярным растворителем. «Неполярному» бурому медведю это не грозит.
Теперь рассмотрим пример. Допустим, неподвижная фаза гидрофобна (неполярна). Тогда подвижная должна быть в целом гидрофильной (полярной). Все гидрофобные компоненты «сядут» на колонку, так как плавать в гидрофильной подвижной фазе им «страшно». Гидрофильные же компоненты окажутся в проскоке, так как им гидрофильная подвижная фаза по душе. Затем «севшие» на колонку гидрофобные компоненты нужно элюировать постепенным увеличением гидрофобности подвижной фазы. Регуляция гидрофобности подвижной фазы осуществляется за счёт насоса, который качает одновременно полярный и неполярный растворитель из двух разных резервуаров через колонку. От соотношения между ними и зависит итоговая полярность подвижной фазы.
- Металлохелатная хроматография с гистидиновым тагом (His-tag). Метод основан на том факте, что участки из шести гистидинов (гистидин — одна из 20 протеиногенных аминокислот) хорошо связываются с находящимися на колонке ионами никеля через свои имидазольные группы. Метод удобен тем, что мало в каком природном белке есть гистидиновый таг, значит с высокой долей вероятности все белки, кроме нашего будут в проскоке.
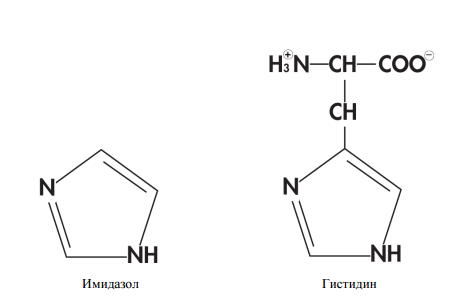
Строение молекул имидазола и гистидина.
Минус метода в том, что нужно модифицировать белок, а это может сказаться на его свойствах. Добавление 6 гистидинов тага к белку происходит ещё на стадии создания гена, а чтобы минимизировать влияние тага на белок эти аминокислоты добавляют в начале или конце аминокислотной последовательности. Естественно, метод не сработает, если белок таков, что его начало и конец спрятаны внутри: ионы никеля и таг просто не смогут встретиться.
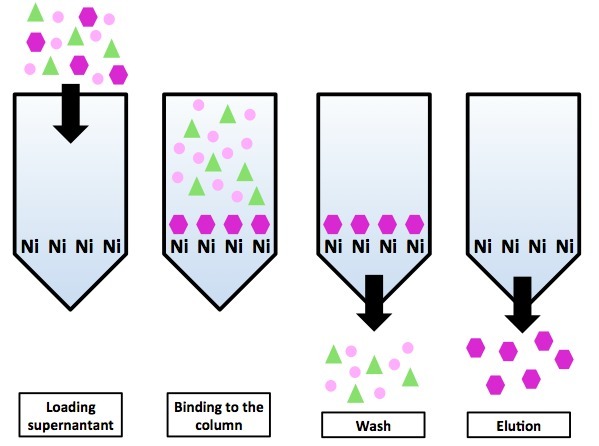
Схема хроматографии на никилевой колонке с использованием гистидинового тага. Все белки, кроме белка-«пурпурного шестиугольника» не имеют His-тага и оказываются в проскоке. Белки-«пурпурные шестиугольники» элюируются нанесением на колонку имидазола.
«Снять» белок с колонки можно постепенным добавлением имидазола. Суть метода элюции та же, что и у ионообменников — имидазол конкурирует с несущим His-таг белком за сайты связывания на неподвижной фазе (только на ионообменнике сайтами связывания были абстрактные ионы, а на металлохелатной колонке сайтами связывания являются ионы никеля). В итоге он занимает большинство доступных сайтов связывания и белку ничего другого не остаётся, кроме как покинуть колонку.
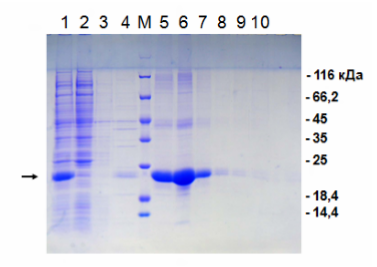
Электрофорез по итогам металлохелатной хроматографии на никеле.
1 — исходный «грязный» материал для нанесения на колонку; 2 — проскок; 3 и 4 — промывка без имидазола; М — маркер молекулярной массы; 5-10 — последовательная элюция имидазолом. Нужный нам белок помечен стрелкой слева. Как мы видим, в проскоке нет нашего белка, зато в нём есть много «мусора». Элюат же представляет собой очищенный целевой белок. Справа обозначены массы соответствующих полос маркера молекулярной массы.
Метод потенциально мог быть удобен ещё и и тем, что существует зависимость силы связывания от количества гистидиновых тагов в составе белка. Таким образом, можно было бы пришивать к одному белку таг только в начале, а к другому с обоих концов и синтезировать их в одной бактерии. Но на деле это не очень практично: разница в концентрациях имидазола, которые элюируют такие белки невелика (примерно 75 мМ и 100 мМ имидазола для одного и двух тагов, соответственно), значит существует вероятность возникновения сложностей с их разделением из одной смеси. А сделать два отдельных штамма это ничуть не сложнее, чем сделать один с двумя генами.
Другой возможной трудностью при работе с His-тагом является существующая в некоторых экспериментах необходимость в получении белка без каких-либо модификаций. В принципе отрезать ферментами таг от белка возможно, но часть белка при этом всё таки останется с тагом (то есть «КПД < 1»), также это приведёт к тому, что нам нужно будет проводить дополнительную стадию очистки от этих самых ферментов. При этом каждая стадия очистки сопряжена с потерями целевого продукта.
- Гель-фильтрация. Сразу оговорюсь, что данный метод можно назвать подходящим для выделения белков лишь условно: если нам нужно получить небольшое количество белка для исследований, то использование гель-фильтрации имеет смысл, но эта методика не годится для работы с действительно промышленными объёмами, и вот почему.
Во всех предыдущих методах скорость движения связавшихся с колонкой компонентов в отсутствии «подгоняющих факторов» настолько мала, что её можно вообще считать близкой к нолю. С гель-фильтрацией всё обстоит иначе: все компоненты, даже самые крупные, движутся со вполне заметными скоростями. Дело в том, что гель-фильтрация не использует какие-то специфические взаимодействия, как это было с предыдущими типами хроматографии (взаимодействие зарядов в ионообменниках, гидрофобные взаимодействия и узнавание ионов никеля имидазольными группами гистидина), а именно благодаря ним и обеспечивалось эффективное удержание некоторых компонентов. Это приводит к существованию сверхсущественного лимитирующего фактора: мы не можем наносить на гель-фильтрацию образец в объёме более 1-2% от объёма колонки. Действительно, околонулевая скорость компонентов в предыдущих методах позволяла не бояться того, что они размажутся даже при длительном нанесении, поэтому на колонку объёмом 10 мл запросто можно нанести смесь объёмом 400 мл: всё, что связалось будет сидеть в самом начале колонки вплоть до начала элюции. При гель-фильтрации же ни один компонент околонулевой скорости не имеет.
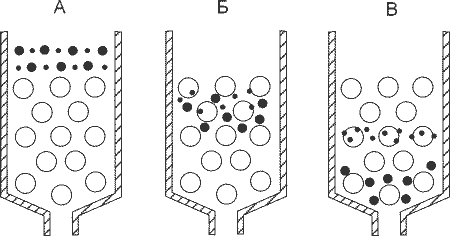
Принцип действия гель-фильтрации: крупные молекулы проходят только в крупные поры и поэтому движутся быстрее маленьких молекул, которые могут проникать в маленькие поры.
Как гель-фильтрация работает? Для её проведения нужна колонка, которая заполнена материалом, испещрённым каналами самого разного диаметра. При этом путь, состоящий из широких каналов является коротким, но если постоянно проникать в более мелкие канальцы и долго в них петлять, то путь заметно удлинится. Поэтому при гель-фильтрации крупные молекулы покидают колонку раньше, чем маленькие.
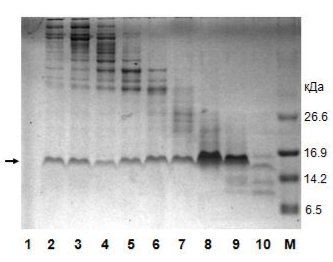
Электрофорез по итогам гель-фильтрации. Фракции пронумерованы в порядке выхода из колонки. Видно, что с каждой последующей фракцией масса белков уменьшается. М — маркер. Справа обозначены массы соответствующих полос маркера молекулярной массы.
Выше было сказано про существенный недостаток гель-фильтрации, но есть и существенное преимущество. Механизм разделения полностью независим от того, что из себя представляет подвижная фаза, поэтому мы легко можем проводить элюцию в том буфере, который нам будет нужен в дальнейшем. Гель-фильтрация — единственный хроматографический метод, позволяющий произвести смену буфера на нужный нам в очень широких пределах.
Ну что же. Вот мы и выделили наш белок и теперь его можно использовать для структурных или функциональных исследований, в качестве реактива в научной лаборатории или для проведения экологических анализов, в медицинских целях или в промышленности.
Комментарии (38)

HandleX
29.03.2017 06:56Генная инженерия бактерий это прекрасно!
Сценарий: кидаем в раствор сахарозы особые «дрожжи», оно там бродит скажем, трое суток, на выходе — бульон с хорошей концентрацией LSD, например ;)
То-то ФСКН удивится! На этом, «борьба» с т.н. «наркотиками» (в-вами в списках, контролируемых большими дядями) закончится, ибо запреты только нагнетают интерес и цену на чёрных рынках. Ну и крышевать большим дядям станет уже нечего — тов. майора к каждому, у кого есть трёхлитровая банка, вода и сахар, не приставишь.
TRYFAN
29.03.2017 10:03Ну подумаеш появятся LSDшные алкоголики
UJIb9I4AnJIbIrUH
29.03.2017 10:04LSD не вызывает зависимости и не имеет прямого отрицательного действия на здоровье.

TRYFAN
29.03.2017 10:38А если она такая хорошая то почему запрещена?
UJIb9I4AnJIbIrUH
29.03.2017 11:08+1Ну так запрещены не только наркотики же, а много чего ещё и если LSD не является наркотиком, то отсюда автоматически ничего не следует.
Вообще если рассматривать вопрос строго по определению, то наркотик — это соединение, обладающее наркотическим действием, то есть способное вызывать наркоз в той или иной форме или притуплять чувство боли. По этому признаку можно назвать наркотиком водку — если основательно надубаситься, то впадаешь в состояние «наркоза».
LSD же не обладает наркотическим действием вообще. Ну то есть вообще-вообще-вообще. И зависимости он тоже не вызывает. Другое дело, что это мощный галлюциногенный психоделик, представляющий опасность по двум причинам: возможное неадекватное поведение принявшего LSD со всеми вытекающими и потенциальный риск схватить осложнения на психику.

HandleX
29.03.2017 12:48-2Множество факторов, но основной — бабло, т.е. Системе это выгодно!
Объясняю на пальцах — Система, установившая закон, говорящий взрослому человеку «Вы, уважаемый, вот эту травку не курите, и марочки не клейте, а то бо-бо!», имеет возможность выдоить несчастного и его родственников по самое не могу — кормятся вся армия силовиков, судейских, прокурорских, адвокатских, строятся частные тюрьмы (в Америке например), выбиваются нереальные бюджеты на «войну с наркотиками», а с другой стороны, ими же и крышуется весь оборот с легендарной прибыльностью от «продажи наркотиков» — вечный двигатель бабла, золотая жила!
Ну и в конце концов, скажите, как управлять законопослушными людьми? ;)
LSD ускоряет метаморфозу «выдавливания из себя раба по капле» на порядки, поэтому особо ненавистно Системе… ИМХО.
Невозможно существование свободного общества, которое одновременно было бы свободно от использования психоактивных в-в.
Подробнее, например тут: (нашумевшая документалка «На высоте культуры / Culture High) https://www.youtube.com/watch?v=forWUtwFm14

VolkaDlak
29.03.2017 13:58А почему алкоголь и табак разрешен? Так уж сложилось исторически.
UJIb9I4AnJIbIrUH
29.03.2017 14:01Ну они всё таки не так опасны. У меня один знакомый как-то попробовал что-то галлюциногенное. Сначала ему начало казаться, что он посреди небольшого российского города видит гигантскую пирамиду, потом что у него остановилось сердце, потом что для его запуска нужно наесться снега (дело было зимой). Табаком или этанолом такого не вызвать всё таки.

VolkaDlak
29.03.2017 14:35+1Этанолом такое вполне можно вызвать, историй про встречу с белочкой в нашей стране вагон и маленькая тележка. Так же и с ЛСД, да можно принять столько что вы буквально сойдёте с ума, вам может показаться всё что угодно. Но это не объективный показатель что это хуже алкоголя или лучше.
В том же случаи «галюников» после протрезвления от ЛСД с вами будет всё в порядке как в психологическом плане (хотя есть мнение что можно и окончательно сойти с ума — что ж допустим), там и в общефизическом — у вас нет похмелья, вас не тянет принять это ещё раз «скорей, скорей». А вот после протрезвления от алкогольных «галюников» вас колбасит в лихорадке, у вас может отказывать сердце, печень или почки, и вы скорее всего склонны как можно быстрее употребить ещё рюмашку для опохмела…
По поводу разрушающего социального действия я бы тоже не стал утверждать что ЛСД страшнее чем алкоголь. Мордобой и даже поножовщина на почве алкоголя обычное дело обычное, а вот ЛСД не вызывает агрессии у людей, скорее они склонны вредить себе (ну там вышел погулять в окно) но и такие случаи единичны по сравнению с алкогольным угаром когда и море по колено и ты весь такой крутой.
P.S. Нет я не призываю что либо употреблять, я вообще за чистый разум (но кончено каждый волен выбирать как хочет жить), но факты указывают что алкоголь один из самых разрушительных наркотиков во всех отношениях, но тем ни менее он разрешён, а вот многие другие более лёгкие наркотики запрещены. Почему так? Ну просто так сложилось исторически.UJIb9I4AnJIbIrUH
29.03.2017 14:42Безусловно Вы правы в том, что алкоголь токсичнее LSD. Но всё таки это не совсем корректное сравнение. Во-первых, употребление алкоголя и алкоголизм и пьяные драки это вещи абсолютно разные. Кроме того, можно выпить бутылку пива и ничего не произойдёт, а дозы LSD, от которой ничего не произойдёт не бывает (вернее бывает, но кому она нужна?). Кроме того, поскольку LSD находится под запретом, то сложно сравнивать его «массовый» эффект с алкоголем, который доступен на каждом углу.

HandleX
29.03.2017 15:12В группе пациентов, принимавших ЛСД, 59% уменьшили количество употребляемого алкоголя. Среди тех, кто галлюциногены не принимал, этот показатель составил только 38%.
отсюда: http://www.bbc.com/russian/society/2012/03/120308_lsd_helps_alcoholics
В результате ученые сделали вывод, что ЛСД оказывает «значительный положительный эффект» на людей, злоупотребляющих алкоголем. Такой эффект сохранялся по меньшей мере полгода после приема препарата, однако по истечении года полностью исчезал.
Впрочем, по мнению ученых, более регулярные «кислотные трипы» могут привести к полному излечению от алкогольной зависимости.
У нас же вендинговые автоматы по продаже боярышника ставят: https://navalny.com/p/5085/
И кстати, когда сравнивали вред от в-в, где алкоголь на первом месте, а LSD на последнем, принималось во внимание не только токсичность, но и другие факторы:По специально разработанной шкале, которую эксперты не без иронии назвали «Независимым научным комитетом по наркотическим веществам» (the Independent Scientific Committee on Drugs, ICSD), каждое вещество получало определенное количество баллов — от нуля (безвредно) до 100 (максимальный вред). Баллы начислялись веществу за степень привыкания, за вред психическому и физическому здоровью «пользователя», а также за количество преступлений, за материальный урон экономике и обществу, связанный с его употреблением.

VolkaDlak
29.03.2017 15:13Я лично не раз наблюдал людей под ЛСД (ну есть у меня знакомые любители) и сам тоже употреблял.
Поверьте, есть доза ЛСД сравнимая с алкогольной банкой пива, и многие люди не употребляют ЛСД что бы посмотреть красивые картинки, они употребляют его для хорошего настроения или расслабления, некоторые в таком виде на работу ходят, они абсолютно нормальные кроме того что их хорошее настроение несколько нехарактерно («слишком сильно хорошее», назовём это так), при этом разум остаётся кристально чистым (ну ощущение такое), думается легко и просто, конечно вы не становитесь гениальным, но вы и не страдаете тупняками, вы думаете и можете вести себя вполне обычно.
По поводу агрессии, это чисто моё мнение выведенное эмпирическим путём на основе наблюдений. Никто уже и никогда не сможет меня переубедить в том что алкоголь вызывает агрессию, а ЛСД нет (как и марихуана впрочем). Но если найдёте ссылки на подобные исследования с удовольствием почитаю.

HandleX
29.03.2017 14:45Алкоголь, вообще-то, на вершине токсичности/опасности, LSD — в самом низу.
Отсюда: http://zdravkom.ru/factors_zav/alkogol_vrednee_narkotikov

vconst
29.03.2017 11:16Морфий так уже научились делать.

HandleX
29.03.2017 15:22Смешно будет, когда джин вырвется из бутылки, и «дрожжи» станут массово доступными… учитывая нереальный FUD на рынке сильных анальгетиков (вспоминаются случаи с раковыми больными, стрелявшихся из наградного оружия, потому что аптечных опиатов невозможно было достать из-за проволочек в лечебных учреждениях).

vconst
29.03.2017 15:23Пока — это стоит намного дороже традиционного способа, и нет предпосылок, что бы в ближайшее время стало сильно дешевле.

texder
29.03.2017 09:14Большое спасибо за статью. Всегда было интересно, как подобные невидимые глазу вещи делаются с физической точки зрения.

kloppspb
29.03.2017 12:38Про аффинную хроматографию забыли, а это метод с самой высокой специфичностью к получаемому белку.
UJIb9I4AnJIbIrUH
29.03.2017 14:03Не то, чтобы забыл, скорее умолчал, потому что чистить полученный в бактериях белок на антителах — довольно экзотическая вещь. Но про этот метод будет отдельная статья с раздором что, почему и как.

kloppspb
29.03.2017 14:13Ну, из лизата эукартиотов или из плазмы теплокровных выковыривал что-то на ура :) Вот только вспомнить бы что именно… БСА вроде тоже чистил, когда в голодные годы приходилось его руками добывать.
А с бактериями не так?UJIb9I4AnJIbIrUH
29.03.2017 14:21Да нет, можно и с бактериями провернуть данный номер, но просто это дороговато встанет, а нужной чистоты можно добиться и приведёнными в статье способами.

rustybastard
31.03.2017 00:01А разве иммуносорбенты не запретили? Но зато у аффинки есть большой плюс — в некоторых случаях можно сократить количество стадий до одной единственной))
UJIb9I4AnJIbIrUH
31.03.2017 00:03Не слышал про такую инициативу. Из-за жестокого обращения с животными?

rustybastard
31.03.2017 08:45Связано вроде как с тем, что антитела получают из раковых клеток и неизвестно как они могут действовать на продукт. К сожалению, не могу сейчас ничего найти по этому поводу, похоже, всё осталось на своих местах, но пару лет назад в месте, где я работал, отказались от иммуноаффинки из-за этих движений.

kloppspb
31.03.2017 10:06Ни разу не сталкивался с тем, что мнение бабок на лавочке хоть как-то воспринималось :)
UJIb9I4AnJIbIrUH
31.03.2017 11:54Хм. Скажем так, я понимаю о чем вы, когда вы говорите, что «антитела получают из раковых клеток». Но вот всё дальнейшее это просто бред на бреде и бредом погоняет и тот, по чьему указанию в вашей организации отказались от антител то ли просто необразованный человек, то ли имел в этой истории какой-то личный интерес.

rustybastard
31.03.2017 17:15В необразованности трудно упрекнуть, но причин я уже не узнаю. Действительно, никакой информации по этому поводу не могу найти, сказанул не проверив. Но можно ведь поспекулировать :) например, фолдинг антигена в раковой клетке идёт неожидаемым образом, а потом он модифицирует целевой белок (есть же рефолдинг на колонках)… но это только мысли))
UJIb9I4AnJIbIrUH
31.03.2017 17:21Для Рен ТВ и запугивания населения — самое то.
В этой истории не хватает только части про то, что всё это организовано межгалактическими жидомасонами с целью свержения власти рептилоидов)

OChSPb
29.03.2017 14:04Интересно, прочил на одном не отрываясь )
Только не смог до конца понять трудоемкость и продолжительность процесса.UJIb9I4AnJIbIrUH
29.03.2017 14:14Ну тут дело обстоит так:
- Добавили лизирующие агенты к клеткам — прошло 5 минут и поставили на ультразвук;
- Соницируются на ультразвуке они сами, это занимает около 10-20 минут и в это время можно начать подготовку хроматографа или попить чайку с коллегами;
- После соникации центрифугируем: поставить в центрифугу наши образцы это ещё 5 минут, потом 30 минут центрифуга всё делает сама и можно продолжить подготовку хроматографа или вернуться на лабораторную кухню;
- Подготовка образца к хроматографии занимает от 5 минут до нескольких часов (это если лаборатория хорошо укомплектована оборудованием, иначе это просто адский ручной труд). Можно продолжать готовить хроматограф;
- Итак, параллельно с предыдущими пунктами мы готовили хроматограф, это где-то час реально рабочего времени;
- Хроматография может занимать несколько часов, из которых ты реально что-то делаешь от силы 20 минут. Но всё равно нужно сидеть и следить за показаниями приборов, так как в процессе могут возникать разные неожиданности;
- Поставить электрофорез и покрасить гель — это ещё где-то полтора-два часа.
В общем если кое-что подготовить заранее, то за ненормированный рабочий день научного сотрудника можно сделать и проанализировать две хроматографии.

alex_vesna
29.03.2017 15:28Я хоть и читал предыдущие статьи, но всё же, — сколько от оформившейся в голове идеи, до реального субстрата, идентичного задуманному? Если можно в двух вариантах, —
1. небольшое количество для дальнейших исследований.
2. В виде таблетки, из готовой партии.
Просто интересно узнать не прикидки а реальную практику… :)UJIb9I4AnJIbIrUH
29.03.2017 15:50Время получения вещества в чистом виде это капля в море по сравнению с его испытаниями, которое может длиться годами. Я видел официальный план работ по одной рекомбинантной вакцине, там за три года даже не планировалось выйти на испытания на людях. Если не ошибаюсь, в документации к этому проекту речь шла о 7-10 годах от начала работы до выхода на рынок. Плюс к этому нужно прибавить ещё год-два, в течение которых разрабатывался эскиз проекта и составлялась и рассматривалась заявка на финансирование, а деньги тоже сразу на счета не поступают.
Хотя я в курсе нескольких историй, когда препараты (или прототипы) частных российских фаркомпаний тестировались на людях задолго до того, как могло бы закончиться предварительное исследование. То есть я не имею конкретных доказательств, но по срокам всё выглядело именно так.
APLe
30.03.2017 04:56Спасибо, очень интересная статья!
Чувствуется, что вы материал упрощали сильнее, чем в предыдущих. Лично меня это огорчает (хотя всё равно интересно!) – но, наверное, только потому, что меня когда-то учили чему-то похожему, и в этом смысле я отличаюсь от средней аудитории Гиктаймс.
SvSh123
30.03.2017 16:43Вот-вот. Для тех, у кого за плечами лишь школьный курс биологии и немножко научно-популярных статей (вроде меня :) ) — в самый раз.

Sirion
Пока осилил только наполовину (баиньки уже пора), но уже плюсую. Нужно больше таких статей!