Сегодня Атлас подробно расскажет, что такое молекулярное тестирование и как оно влияет на постановку диагноза.

На фото: Владислав Милейко, руководитель направления Онкодиагностика,
биомедицинский холдинг «Атлас».
Чтобы понять, как работает молекулярная диагностика и какое место она занимает в онкологии, нужно сначала разобраться в механизмах, происходящих в опухоли.
Молекулярные процессы в опухоли
Каждая здоровая клетка содержит молекулу ДНК, из которой она считывает информацию, какую форму и специальность получить, какие белки и ферменты производить, а главное, когда делиться и умирать. Подробнее о том, как это происходит почитайте в нашем первом материале.
Мутации в протоонкогенах и генах-супрессорах, отвечающие за деление и смерть клетки, приводят к тому, что клетка перестает следовать инструкции и синтезирует белки и ферменты неправильно. Молекулярные процессы выходят из-под контроля: клетка постоянно делится, отказывается умирать и копит генетические и эпигенетические мутации. Поэтому злокачественные новообразования часто называют болезнью генома.
В клетках опухоли могут происходить сотни тысяч мутаций, но только несколько из них способствуют росту, генетическому разнообразию и развитию опухоли. Они называются драйверными (driver). Остальные мутации, «пассажирские» (passanger), сами по себе не делают клетку злокачественной.
Драйверные мутации создают различные популяции клеток, что обеспечивает разнообразие опухоли. Эти популяции или клоны по-разному реагируют на лечение: некоторые из них устойчивы и приводят к рецидиву. К тому же разная чувствительность клонов к терапии может привести к радикальному изменению молекулярного профиля в ходе лечения: даже незначительные в начале популяции клетки могут получить преимущество и стать доминирующими в конце лечения, что приведет к устойчивости и развитию опухоли.

Источник: Cell.
Иллюстрации: Майкл Ковальски.
Молекулярная диагностика
Драйверные мутации, изменения в количестве или структуре белков используют в качестве биомаркеров — мишеней, по которым подбирают лечение. Чем больше мишеней известно, тем более точным может быть выбор из потенциально эффективных схем лечения.
Отделить драйверные мутации от остальных и определить молекулярный профиль опухоли непросто. Для этого применяется технология секвенирования, флуоресцентной гибридизации in situ (FISH), микросателлитного анализа и иммуногистохимии.
Методы секвенирования нового поколения позволяют выявить драйверные мутации, включая те, что делают опухоль чувствительной к таргетной терапии.
С помощью технологии FISH подкрашивают участки хромосом, на которых расположен определенный ген. Две соединенные разноцветные точки — это химерный или слитый ген: когда в результате перестройки хромосом вместе соединяются участки разных генов. Это может привести к тому, что онкоген попадет под влияние регуляции другого более активного гена. Например, слияние генов EML4 и ALK имеет ключевое значение в случае рака легкого. Протоонкоген ALK активируется под влиянием своего «партнера» по перестройке, что приводит к неконтролируемому делению клеток. Онколог, учитывая перестройку, может применить лекарство, которое будет направлено против активированного продукта гена ALK (Кризотиниб).
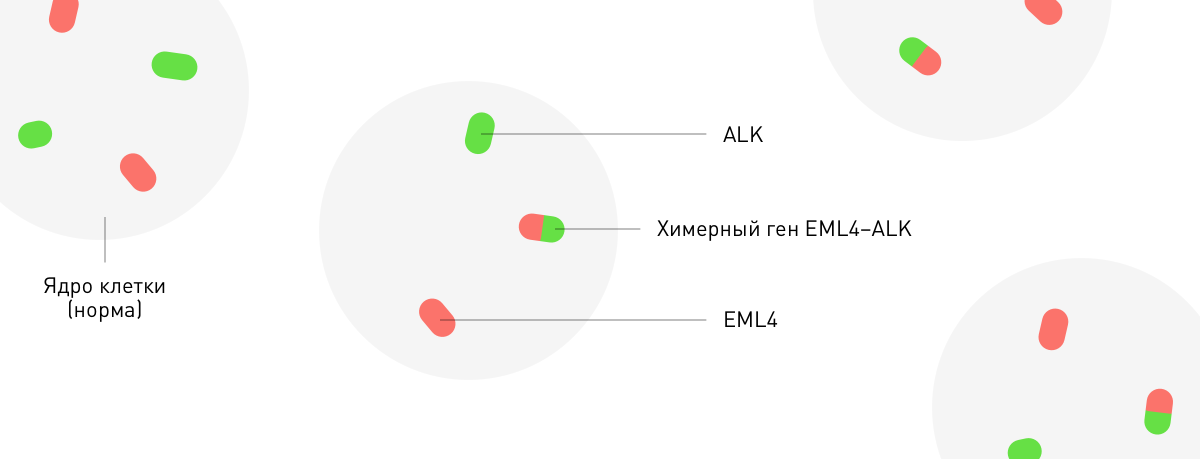
Флуоресцентная гибридизация in situ (FISH).
Микросателлитный анализ показывает степень нарушения системы репарации ДНК, а иммуногистохимия — белковые биомаркеры, расположенные на поверхности, в цитоплазме и ядрах опухолевых клеток.
Все эти исследования входят в новый продукт биомедицинского холдинга «Атлас» — тест Solo. С помощью такого теста онколог получает информацию о молекулярном профиле опухоли и о том, как он влияет на потенциальную эффективность широкого спектра противоопухолевых препаратов.
Специалисты Solo исследуют до 450 генов и биомаркеров, чтобы оценить, как опухоль может ответить на применение более таргетных препаратов для лечения онкологических заболеваний. Для некоторых из них анализ биомаркера продиктован производителем. Для других используют данные клинических исследований и рекомендации международных сообществ онкологов.
Помимо выбора мишеней для таргетной терапии, молекулярное профилирование помогает обнаружить мутации, которые напротив, делают опухоль устойчивой к определенному лечению, или генетические особенности, которые связаны с повышенной токсичностью и требуют индивидуального подбора дозы лекарства.
Для исследований используется материал биопсии или парафинизированные блоки послеоперационного материала.
Молекулярное профилирование дает дополнительную информацию о заболевании, но она не всегда применима для выбора лечения. Например, в ситуациях, когда стандартная терапия обладает достаточной эффективностью или показано хирургическое лечение. Можно определить клинические ситуации когда такое исследование может быть наиболее полезно:
- Редкий вид опухоли;
- Опухоли с неустановленным первичным очагом (неизвестно, где изначально появилась опухоль, давшая метастазы);
- Тех случаев, когда требуется выбор из нескольких вариантов применения таргетной терапии;
- Исчерпаны возможности стандартной терапиии требуется экспериментальное лечение или включение пациента в клинические исследования.
Специалисты проекта Solo консультируют онкологов или пациентов и подсказывают, нужен ли тест в данном случае.
Результат диагностики также включает рекомендации по клиническим исследованиям с подходящим тестируемым препаратом. У пациента есть возможность принять в них участие.
Прецизионная медицина и клинические исследования
Обычно в медицинской практике применяют общие стратегии для лечения пациентов с определенным диагнозом. Для мелкоклеточного рака легкого используется одна стратегия, для немелкоклеточного — другая. Для онкологических заболеваний этот метод подходит не всегда. Из-за различий на молекулярном уровне даже при одном и том же типе опухоли пациенты могут получить неэффективное или лишнее лечение.
С увеличением исследований и изобретением таргетных препаратов, подход к лечению онкологических заболеваний начал меняться. Чтобы увеличить безрецидивный период и продолжительность жизни пациента, нужно учитывать молекулярный профиль опухоли, ответ организма на лекарственные препараты и химиотерапию (фармакогеномика), знать главные биомаркеры.

Прецизионная медицина позволяет существенно улучшить прогноз конкретного пациента, избежать серьезных побочных эффектов онкологических препаратов и значительно повысить качество жизни больного. Но и у этого метода существуют недостатки.
Таргетных препаратов становится все больше, и они имеют два основных ограничения: большинство молекулярно-направленных агентов обеспечивают лишь частичное подавление сигнальных путей и многие из них слишком токсичны для использования в комбинации.
Представьте, что вы архитектор Москвы. Перед вами стоит непростая задача — решить проблему с пробками в час пик, построив один мост. Молекулярные механизмы можно сравнить с движением машин, а мост — главный препарат, который должен решить основную проблему. Кажется, что несколько лекарств (серия мостов), направленные на главные молекулярные нарушения, могут решить эту проблему. Но токсичность препаратов при этом увеличивается и может быть непредсказуемой.
Мы стали лучше понимать молекулярные процессы злокачественных опухолей, но текущие методы внедрения точной онкологии в клиническую практику сильно отстают. Чтобы ускорить изучение таргетной терапии, ученые разработали два новых подхода — Basket и Umbrella.

Суть метода Basket в том, что для исследования выбирают пациентов с определенным биомаркером, независимо от расположения и названия опухоли. В мае 2017 года FDA одобрила такой метод лечения для биомаркера под названием высокая микросаттелитная нестабильность (MSI-H) или дефект восстановления несоответствия (dMMR).
Молекулярные нарушения отличаются не только у разных пациентов, но и в пределах одной опухоли. Гетерогенность — большая проблема в онкологии, для решения которой был разработан дизайн исследования Umbrella. Для метода Umbrella пациентов сначала отбирают по типу злокачественных новообразований, а потом учитывают генетические мутации.
Такие исследования помогают не только собрать информацию о действии таргетных препаратов — иногда это единственная возможность для пациентов, которые не отвечают на стандартное лечение зарегистрированными препаратами.
Клинический пример
Мы решили привести наглядный пример, как может выглядеть использование расширенного молекулярного профилирования.
Пациент с меланомой кожи и метастазами в печени обратился к онкологу. Врач и пациент приняли решение сделать молекулярное профилирование, чтобы получить более полную информацию о заболевании. Пациенту провели биопсию и отправили образцы ткани на исследование. В результате диагностики в опухоли обнаружили несколько важных генетических нарушений:
- Мутация в гене BRAF. Указывает на активацию сигнального пути онкогенов RAS-RAF-MEK, который участвует в дифференцировке и выживаемости клеток.
- Мутация в гене NRAS. Указывает на дополнительную активацию сигнального каскада RAS-RAF-MEK.
- Наследственный вариант гена TPMT. Указывает на особенности метаболизма противоопухолевого препарата «Цисплатин».

Ориентируясь на результаты клинических исследований и рекомендации можно прийти к следующим выводам:
- Потенциально эффективными могут быть препараты класса BRAF-ингибиторов (Вемурафениб), более того, наличие мутации NRAS может служить дополнительным основанием для назначения двойной блокады сигнального каскада — комбинацией с MEK-ингибиторами (Траметиниб).
- Несмотря на то что нет одобренной терапии, направленной непосредственно на онкоген NRAS, известно, что мутации в нем повышают вероятность успешного лечения при назначении иммунотерапии (Ипилимумаб и Пембролизумаб).
- Наследственный генетический вариант в гене TPMT указывает на повышенную индивидуальную токсичность Цисплатина, что требует коррекции дозы при назначении платиносодержащих режимов терапии.
Таким образом, врач получает возможность ориентироваться среди возможных вариантов лечения отталкиваясь не только от клинических параметров пациента, но и учитывая молекулярные особенности опухоли.
Молекулярная диагностика — это не панацея для всех онкологических заболеваний. Но это важный инструмент для онколога, который позволяет подойти к лечению злокачественных опухолей с новой стороны.
Спасибо, что читали и комментировали наши материалы об онкологии. Вот полный список статей:
Комментарии (10)

Faramant
03.10.2017 09:35+1К сожалению, вот такие рассказы о перспективных методах диагностики и лечения никакого отношения к работе реальных онкологов до сих пор не имеют. В чем я убедился на собственной шкуре. Меланома кожи. После двух операций в 2014 году, в августе 2015 года на ЛКК получил справку с назначением «Наблюдаться по месту жительства». Всё, онкологи отказались меня дальше лечить. Через полгода был на консультации в НИИ онкологии в другом городе, получил там рекомендации по лечению и пришел еще раз в свой диспансер. 15 января 2016, результат ЛКК — «Наблюдаться по месту жительства», в лечении отказали. После этого из диспансера ни разу даже не позвонили, чтобы хотя бы узнать жив ли я еще или «ласты склеил». Медицинские исследования и работающие «на земле» врачи — два разных мира, между собой слабо пересекающиеся.

asyaaam Автор
03.10.2017 10:29+1Эту ситуацию мы и пытаемся поменять, сделав новые технологии понятными и доступными. Но, к сожалению, не всегда удается помочь больным даже вооружившись самыми передовыми достижениями науки. Сочувствуем вашему положению.

achekalin
Уверен, что многие бы здесь на ресурсе не прочь пройти тест на рак, но а) не знают, как это сделать, и б) не очень понимают, когда его делать — раз в месяц, в полугодие, в год. Цена вопроса непонятна.
Был бы понятный алгоритм, было бы проще: идти не после обращения к врачу с жалобами на серьезные сложности с организмом, а именно профилактически.
asyaaam Автор
Молекулярная диагностика нужна, чтобы разработать стратегию лечения злокачественных опухолей. То есть после того, как диагноз уже поставили. В качестве профилактики тест не используют — у него другие цели.
Panfilov
Мне кажется, вопрос автором комментатора ставился следующим образом:
— какой тест/набор тестов можно пройти, чтобы подтвердить наличие/отсутствие злокачественной опухоли
— цена вопроса такой диагностики?
— куда обращаться для этой цели?
Wuzaza
Гематологические исследования малоэффективны для ранней диагностики онкозаболеваний. Онкомаркеры не всегда появляются на ранних стадиях заболевания, могут давать ложноположительные результаты (когда они положительны а опухоли нет, что часто бывает при различных воспалительных, ревматологических или имунных процессах) или ложноотрицательными (когда опухоль есть, а маркеров нет).
Относительно «надежными» онкомаркерами являются ПСА при раке простаты у мужчин, и CA-125 у женьщин при заболевании яичников. Другие онкомаркеры во многом неспецифичны, и позволяют «заподозрить» заболевание.
Поскольку распространенность видов злокачественнных опухолей различна в зависимости от локализации, в первую очередь необходимо исключить наиболее распространенные.
Рак легких — ежегодная флюорография.
Рак желудка — гастроскопия 1 раз в 5 лет.
Рак кишечника — кал на скрытую кровь + колоноскопия после 50 лет 1 раз в 5 лет или при наличии положительного теста на скрытую кровь.
Рак молочной железы — УЗИ молочных желез ежегодно до 40 лет, и маммография ежегодно после 40.
Рак предстательной железы — ПСА крови после 50 лет ежегодно.
Рак матки, яичников — ежегодное посещение гинеколога, мазки, УЗИ малого таза.
Выполняя эти исследования вы сможете выявить большую чать опухолей на ранней стадии. А в случае обнаружения полипов в желудке и кишечнике с последующим удалением, вообще предупредить развитие рака.
Все другие формы рака встречаются гораздо реже, поэтому производить их скрининг достаточно неэффективно.
МРТ, РКТ, а также новомодная ПЭТ томография не являются методами первичной диагностики, а используются как уточняющие методы при подозрении или уже выявленном раке. Хотя зачастую они навязываются «недобросовестными» медиками ввиду их высокой стоимости.
asyaaam Автор
Для рака легкого, яичника и желудка не существет эффективных программ скрининга.
Флюорография не покажет наличее опухоли на ранней стадии, у нее другая цель — выявить туберкулез. Курильщикам с большим стажем рекомендуют проходить низкодозовое КТ. Мазок и тест на ВПЧ снижают смертность рака шейки матки, но не позволяют выявить рак яичника. Эффективная схема по выявлению рака желудка есть только у японцев (он у них на первом месте среди других злокачественных опухолей). Другие страны не смогли повторить этот успех. УЗИ не используют для скрининга, это дополнительный метод исследования, если есть подозрение на РМЖ. В остальном, кажется, все верно.
Скрининг — это не просто обследования. Его эффективность зависит от поддержки государства, квалификации специалистов, состояния оборудования, наличии исследований и других факторов.
Подробнее о том, с какими проблемами сталкиваются современные исследователи скрининга и какие обследования доказанно снижают смертность, можно почитать в нашем предыдущем материале.