В последние десятилетия рак кожи считается одним из самых распространенных онкологических заболеваний во всем мире. По оценкам ВОЗ, ежегодно регистрируется около 132 000 случаев меланомы кожи, а смертность достигает 66 000 случаев.
Диагностика рака кожи требует значительных усилий и времени, что может негативно сказаться на течении заболевания и привести к плачевным последствиям.
К счастью, наука не стоит на месте! В данной статье я расскажу о системе раннего автоматизированного выявления рака кожи, с использованием сил ИИ.
Приятного прочтения! :)
Введение в исследование
Рак кожи – это состояние, при котором клетки кожи начинают аномально и неконтролируемо делиться, что может привести к образованию опухолей. Он может развиваться в любой части кожи, но чаще всего возникает на участках, подверженных воздействию ультрафиолетового излучения.
Существует несколько типов рака кожи, включая базальноклеточный рак, плоскоклеточный рак и меланому. Базальноклеточный рак возникает из базальных клеток, находящихся в нижнем слое эпидермиса, и часто связан с длительным пребыванием на солнце. Плоскоклеточный рак развивается из клеток верхнего слоя кожи и может быть более агрессивным и распространяться на другие органы.
Меланома — это наиболее опасный и смертельный тип рака кожи, который происходит из меланоцитов, клеток, отвечающих за производство пигмента меланина. Меланома отличается высокой склонностью к метастазированию и быстрому распространению раковых клеток по всему телу.

Существует множество методов диагностики рака кожи. Традиционные методы, такие как биопсия и обычный медицинский осмотр, имеют недостатки: биопсия – инвазивный и болезненный способ, может привести к распространению болезни; осмотр задействует субъективное суждение врача и может привести к ошибкам в диагнозе. Точность различения новообразований является ограничением традиционных методов, особенно при ранних стадиях.
Доступ к дерматологам также ограничен во многих регионах. К тому же, процесс уточнения диагноза часто требует значительных временных затрат и может быть дорогостоящим. Поэтому важны новые технологии, такие как дерматоскопия, теледерматология и компьютерные системы поддержки диагностики.
Использование машинного обучения может значительно улучшить процесс диагностики и помочь сократить время на обработку дерматоскопических изображений.
Цель данной работы – использование автоматизированных алгоритмов на базе ИИ для диагностики рака кожи и определения характера новообразований. Предлагается GUI (графический интерфейс пользователя), который упростит диагностику для пациентов и врачей, сократит время на диагностику и повысит ее точность!
Методы исследования
В работе представлена интеллектуальная система обнаружения рака кожи, способная классифицировать доброкачественные и злокачественные новообразования.
Использование набора данных РН2 с дерматоскопическими изображениями позволяет системе анализировать различные типы поражений кожи.
Система включает этапы предобработки изображений, сегментации, извлечения признаков и классификации с помощью алгоритмов машинного обучения, реализованных в MATLAB с графическим интерфейсом для удобства использования. Результаты исследования подтверждают, что автоматизированный подход может улучшить процесс диагностики и стать важным инструментом в раннем выявлении рака кожи.
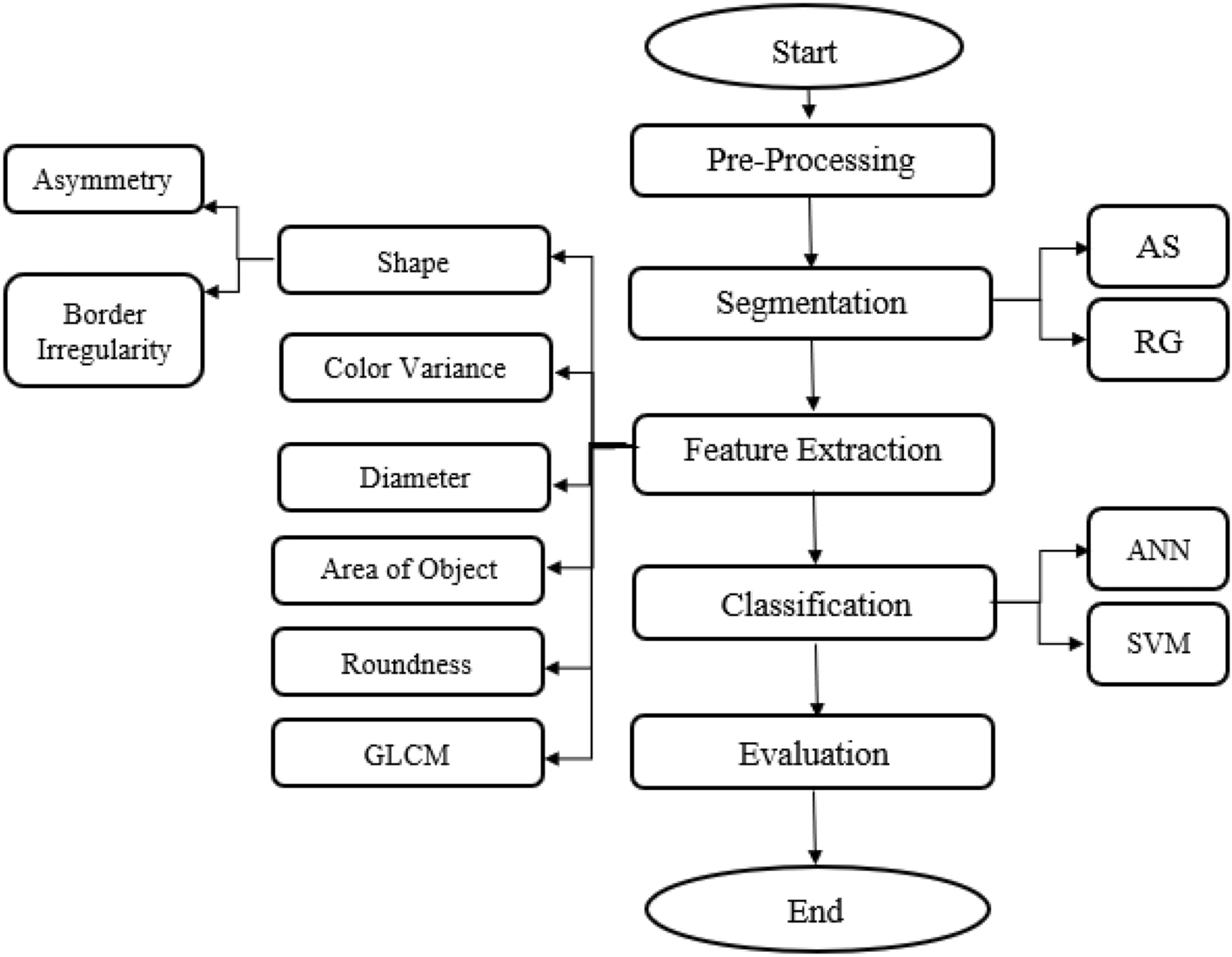
Предварительная обработка
В процессе предварительной обработки изображений для диагностики рака кожи удаляются шумы, также улучшается контрастность, изображения преобразуются в градации серого и фильтруются для повышения качества. Эти шаги помогают сделать новообразования более различимыми для последующего анализа.
Сегментация
Сегментация — это техника, которая позволяет отделить объекты от их фона, которая также может приспособиться к сложной морфологии биологических структур. На этапе сегментации используются и модифицируются алгоритмы адаптивного Adaptive snake (AS) и Region growing (RG).
Adaptive snake (AS) – это модель активного контура, используемая для обнаружения краев и границ объектов на изображении. Она работает путем минимизации энергетической функции, которая приводит к "змеевидной" кривой, обвивающей объект. Этот метод особенно эффективен для выделения объектов со сложным контуром.
Region growing (RG) – это процесс, при котором пиксели изображения группируются вместе на основе предопределенных критериев, таких как интенсивность или цвет. Этот метод хорошо подходит для выделения смежных областей, которые имеют одинаковые или похожие характеристики.
Извлечение признаков
Для анализа пораженных участков кожи используется метод извлечения признаков, основанный на матрице пространственной зависимости уровней серого (GLCM), которая характеризует текстуру изображения.
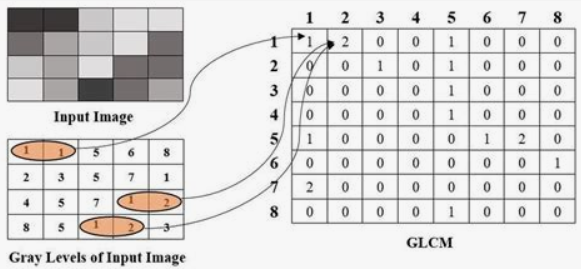
Этот метод позволяет получить статистическую информацию о текстуре, включая такие параметры, как контраст, однородность и энтропия.
Также на этом этапе применяются правила ABCDE дерматологии, оценивающие асимметрию, границы, цвет, диаметр и форму поражений кожи, что важно для обнаружения ранних признаков рака.
Классификация
На данном этапе используются алгоритмы ANN и SVM для классификации поражений кожи.
ANN (Artificial Neural Networks, искусственные нейронные сети) – это вычислительные системы, вдохновленные биологическими нейронными сетями, состоящие из большого количества простых, взаимосвязанных узлов, работающих вместе для решения конкретных задач. ANN способны обучаться и улучшать свою производительность на основе входных данных благодаря процессу, который имитирует способ, которым мозг человека обрабатывает информацию.
SVM (Support Vector Machines, метод опорных векторов) – это набор связанных методов контролируемого обучения, используемых для классификации и регрессионного анализа. Основная идея SVM заключается в поиске гиперплоскости в многомерном пространстве, которая наилучшим образом разделяет данные на разные классы. SVM эффективно работает с высокоразмерными данными и обеспечивает высокую точность благодаря использованию различных ядерных функций, которые позволяют решать нелинейные задачи.
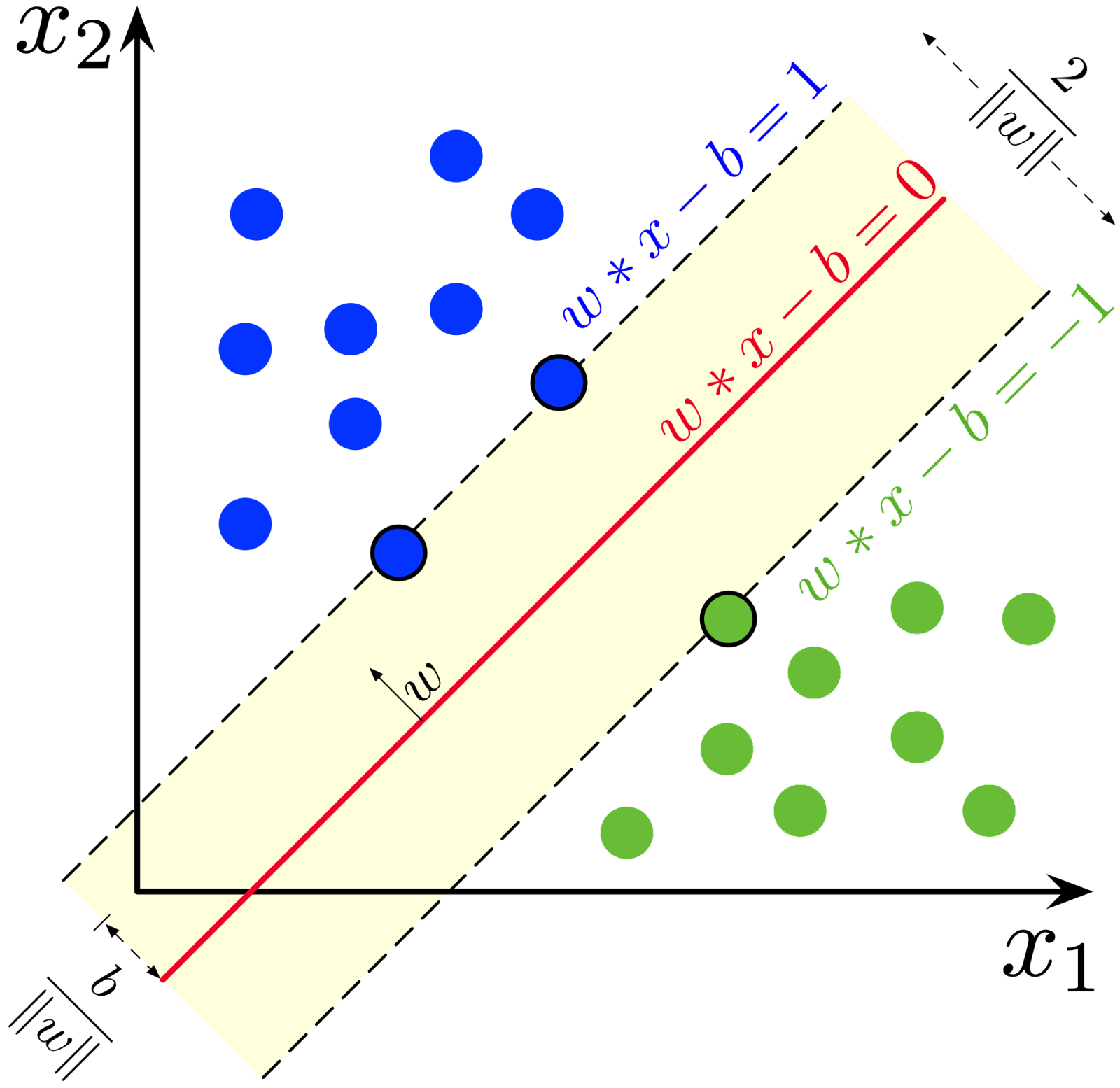
В процессе классификации при выявлении рака кожи алгоритмы ANN и SVM обучаются с использованием размеченных наборов данных, содержащих различные признаки, извлеченные из изображений поражений кожи, такие как информация о цвете, текстуре и форме. После обучения эти алгоритмы могут классифицировать новые изображения поражений кожи по различным категориям, таким как доброкачественные или злокачественные, на основе изученных закономерностей и взаимосвязей в данных.
Оценка
Метрики оценки играют важную роль в разработке, валидации и внедрении алгоритмов обнаружения рака кожи. Они предоставляют ключевую информацию о производительности алгоритма, поддерживают клиническое принятие решений и, в конечном итоге, способствуют улучшению результатов для пациентов.
Эффективность предложенной системы оценивается с использованием следующих метрик:
Точность;
Чувствительность;
Специфичность;
Показатель F1;
Индекс Жаккара;
Коэффициент корреляции Мэтьюса.
Результаты исследования
На данном рисунке для сегментации используется алгоритм AS. Его точность составляет 96%!

Точность сегментации с помощью RG достигает 90%.

AS показывает лучшую эффективность в силу своей гибкости, способности включать в себя предыдущие знания и способности работать со сложными поражениями.
AS обеспечивает более точные границы по сравнению с RG, особенно для объектов с нерегулярными границами или сложной формой. AS больше подходит для более широкого спектра изображений.
RG может сегментировать изображение, если оно симметрично, но медленнее, чем AS, и не может сегментировать изображение, если оно асимметрично.
На рисунке ниже показан графический интерфейс для предлагаемой системы:
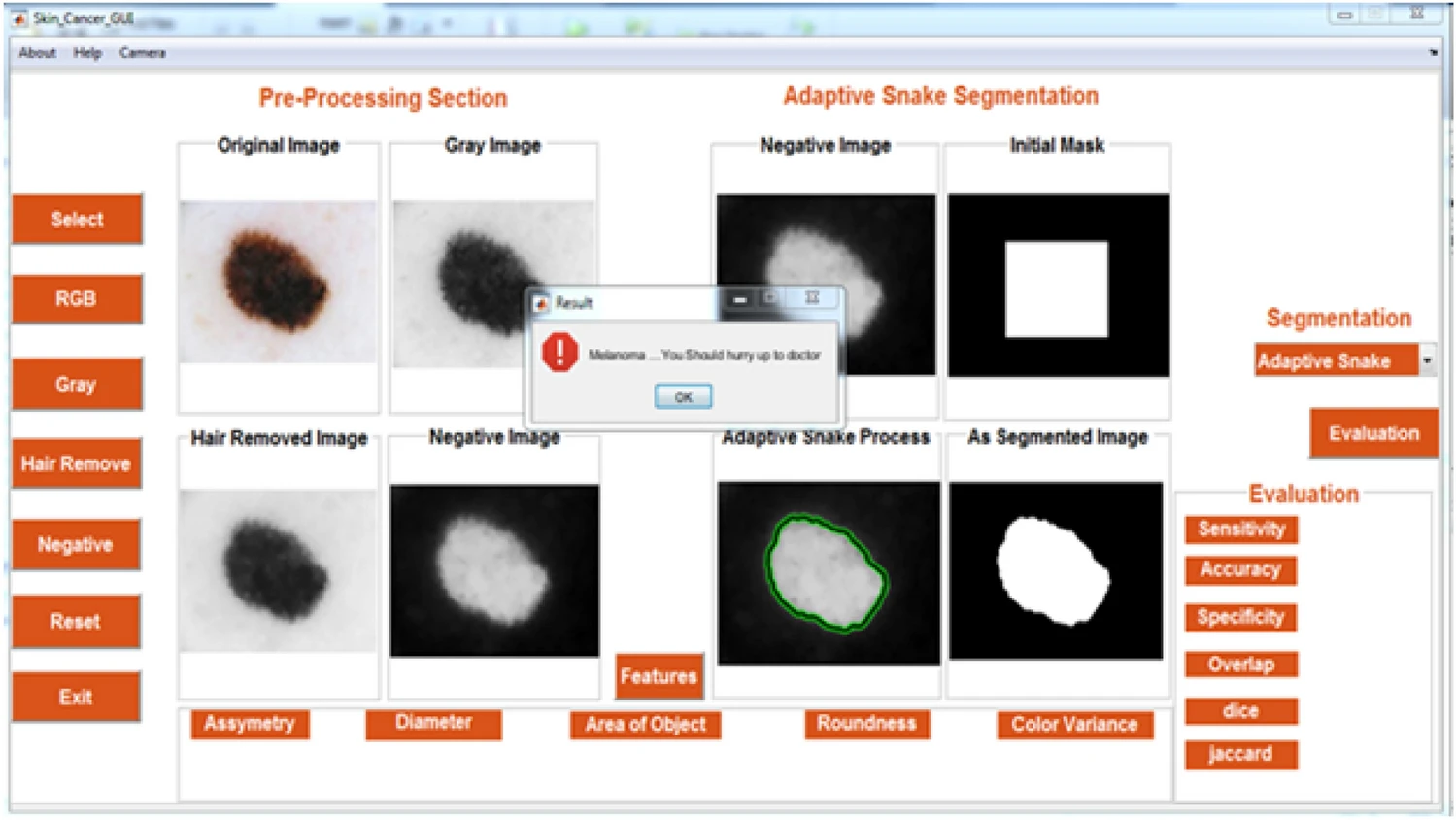
Предлагаемая система с алгоритмом ANN обладает максимальной эффективностью (точность – 94%; специфичность – 95,83%; чувствительность – 92,30%; показатель F1 – 0,94) по сравнению с SVM.
Предложенная система проста в использовании, экономит время, позволяет пациентам самостоятельно осуществлять удаленный мониторинг и обладает высокой производительностью. Такая система ускоряет работу дерматологов и повышает эффективность диагностики.
Вывод
Безусловно, данная система еще требует доработок, но уже на данном этапе она становится эффективным методом ранней диагностики рака кожи.
Важно уточнить, что она не сможет заменить врачей, и не может быть единственным безоговорочным источником диагноза. Это отличный инструмент, который действительно может значительно облегчить жизнь как специалистам, так и пациентам. Использование данного метода может обеспечить диагностику опухолей на ранних стадиях, что упростит лечение и реабилитацию и, соответственно, сократит смертность.
С основным исследованием Вы можете ознакомиться по ссылке: https://www.nature.com/articles/s41598-024-59783-0#Tab1
На этом все!
Спасибо за прочтение, будем ждать Вас в комментариях! :)
Комментарии (14)

Dynasaur
30.04.2024 14:24"This image database contains a total of 200 dermoscopic images of melanocytic lesions, including 80 common nevi, 80 atypical nevi, and 40 melanomas."
Можно ли нормально что-то исследовать и обучить ИИ на 200 фотографиях? Неужели нет нормальных наборов фотографий кожных образований хотя-бы в десятки тысяч образцов? Что мешает собрать такой набор? Через одного врача за месяц проходит под сотню образцов, а в нормальном онкологическом центре можно собрать десятки тысяч и тогда уже работать.

starfair
30.04.2024 14:24У меня самого недавно обнаружили кожную онкологию, ттт, не сильно зловредную и вырезали, надеюсь без дальнейших последствий.
У вас немного писимистичное представление о том, сколько на самом деле есть доступных материалов в онкоклиниках. Во первых, до недавнего времени никто эти фото не собирал в некие коллекции для последующего машинного обучения. Я прошел три онколога, и несколько иных врачей, так или иначе связанных с онкологией, и никто по внешнему виду моего случая, так и не смог поставить примерный диагноз, поэтому шли по варианту максимальному - как при меланоме. И что самое парадоксальное, и потом, когда уже делали анализ по "стеклышкам", ставили два разных вида онкологии. Так что, это очень субъективный процесс, и он доступен только для очень хорошо подготовленных медицинских центров. И то, при условии, колоссальной предварительной работы по сбору данных, их подготовке и обработке. А это деньги. И очень и очень не маленькие. Поэтому это уровень или очень богатых мед\фарм компаний, или же дело государства.
Во вторых, любые попытки систематизировать и автоматизировать работу на стадии диагностики достойны только самой большой похвалы! В любом раскладе, я буду очень благодарен любым разработкам, которые помогут в диагностики любых видов рака, не важно на чем они базируются. Ибо лучше испугаться и не обнаружить при проверке, чем отмахнуться, и загнуться за пол года.
Dynasaur
30.04.2024 14:24Зря вы утруждали себя писанием стольких букв. Первый же запрос в интернете даёт примеры общедоступных наборов данных с онкологическими изображениями:
130 тысяч картинок: https://www.kaggle.com/datasets/obulisainaren/multi-cancer
десятки наборов данных по разным видам рака: https://www.rcpath.org/profession/guidelines/cancer-datasets-and-tissue-pathways.html
ну и ещё куча других - просто не буду всё сюда переписывать

starfair
30.04.2024 14:24Почему же зря? Наборы это хорошо! Другое дело, что набор-набору рознь. Учитывая, что помимо самих изображений, тут ещё важна и достоверность и вообще точное описание к каждому изображению, такое как: точный типа онкологии, степени дифференцированости опухоли, точно подтвержденная стадия опирающаяся на послеоперационное исследование образца опухоли и ещё многих факторов, без которых потеряется достоверность и точность такого рода наборов.
Не спорю, найти картинки сейчас наверное не так уж и проблематично. Проблематичнее построить модель ИИ, которая бы как можно меньше ошибалась в своей диагностике. А потом ещё и дообучитть её в чем она конкретно ошибается, дабы исправить подобные ошибки на будущее. Поэтому, наверное локально собранные наборы пусть и не столь репрезентативны из-за количества возможных вариаций опухолей, но зато обладают куда большим сопутствующим набором данных, для построения последующих векторных БД, которые будут опираться не только на саму картинку, ну а допустим и на другие факторы: пол, рост, вес и разного анамнеза, которые сомнительно что доступны для таких открытых баз.
Dynasaur
30.04.2024 14:24Обучение ИИ начинается с данных. Нет данных - и говорить не о чем. Поэтому и моя исходная реплика - 200 картинок это крайне мало. Вся последующая работа будет бесполезна, пока не собран нормальный набор данных.

starfair
30.04.2024 14:24Еще раз, повторю свою мысль: такая нейросеть должна выдавать диагноз не просто по одному снимку, но и по куче сопутсвующих медицинских фактов. Ни один нормальный онколог, не возьмется прямо сразу утверждать, у вас меланома, если она допустим ещё первой или даже второй степени. Про всякие плоскоклеточные виды опухоли вообще молчу! На этих стадиях они вполне себе могут быть похожи на какие нибудь кератомы, невсусы, или другие пигментозные новообразования. Нужны сопутствующие медицинские данные, чтобы нейронные связи устанавливались не только по схожести самого внешнего вида, но и по другим векторам, которые на первый взгляд могут быть совсем не очевидными, но выявиться именно путем нейрообучения ИИ. И тут просто картинки мало чем могут помочь.
Опять же - приведу свой пример. Мне два опытных врача - онколога при осмотре поставили диагнозом меланому. Два других (кстати не онкологи в общем то, но встречавшихся с нею не раз у своих пациентов), её так же отвергли и сказали что это вообще не похоже на онкологию. В итоге оказалось что это и не меланома, и в тоже время онкология, но совершенно другого класса, которая слава богу была на нулевой стадии и не агрессивной формы. Но опять же, это установили уже по биопсии послеоперационного материала. И то - со второго раза. Поэтому, даже очень крупный набор исходных фото, может дать такой же большой набор ложных диагнозов, если при этом помимо фото не даются иные вводные данные, позволяющие перейти на более высокий уровень связей между конкретным случаем, и статистикой по установленным уже ранее диагнозам. А вот с этим, скорее всего и будет проблема у крупных наборов просто картинок с диагностированными опухолями.
Dynasaur
30.04.2024 14:24Так под набором данных подразумевается не просто набор картинок, а набор всех признаков, которые нужны для распознавания. Допустим, если к изображению врачу нужны ещё анализы, то и ИИ тоже нужны анализы. И возвращаясь к началу - 200 образцов это крайне мало. Причём, чем больше признаков, тем больше образцов надо.

Kanut
30.04.2024 14:24На самом деле можно просто начать с варианта когда ИИ будет просто находить и маркировать все подозрительные места. Как это сейчас делается в радиологии.
И потом уже развивать всё это дело.


belch84
Шутка как-то не очень ...
AsukaLangley02
Шутка? Вроде обычная формальность, которую во все статьи вставляют