
Практически каждый из нас слышал или читал новости о распространяющемся коронавирусе. Как и в случае любого другого заболевания, в борьбе с новым вирусом важна ранняя диагностика. Однако далеко не все заразившиеся демонстрируют одинаковый набор симптомов, и даже сканеры в аэропортах, предназначенные для выявления признаков инфекции, не всегда успешно определяют больного среди толпы пассажиров. Возникает вопрос — почему один и тот же вирус проявляется у разных людей по-разному? Естественно, первый ответ — иммунитет. Однако это не единственный важный параметр, влияющий на вариативность симптомов и тяжесть протекающей болезни. Ученые из Калифорнийского и Аризонского университетов (США) выяснили, что сила сопротивления вирусам зависит не только от того, какими подтипами гриппа человек болел на протяжении жизни, но и от их последовательности. Что именно удалось выяснить ученым, какие методики были использованы в исследовании и как данный труд может помочь в борьбе с эпидемиями? Ответы на эти вопросы мы найдем в докладе исследовательской группы. Поехали.
Основа исследования
Как мы знаем, у разных людей грипп проявляется по-разному. Помимо человеческого фактора (иммунная система, прием противовирусных препаратов, профилактические меры и т.д.) важным аспектом является сам вирус, а точнее его подтип, которым заражен тот или иной больной. Каждый подтип обладает своими особенностями, в том числе степенью поражения различных демографических групп. Ученые отмечают, что вирусы H1N1 («свиной грипп») и H3N2 (Гонконгский грипп), ставшие самыми распространенными на данный момент, по-разному поражают людей разного возраста: H3N2 является причиной большинства тяжелых случаев болезни у пожилых, ему также приписывается большинство смертельных случаем; H1N1 менее смертелен, но чаще всего поражает людей среднего возраста и молодежь.
Такие отличия могут быть обусловлены как разницей в скорости эволюции самих вирусов, так и разницей в иммунном импринтинге* у детей.
Иммунный импринтинг* — своего рода долгосрочная память иммунной системы, формируемая на базе пережитых вирусных атак на организм и его реакций на них.В данном исследовании ученые провели анализ эпидемиологических данных, чтобы выяснить, влияет ли импринтинг в детском возрасте на эпидемиологию сезонного гриппа и если да, то действует ли он главным образом через гомосубтипическую* иммунную память или через более широкую гетеросубтипическую* память.
Гомосубтипический иммунитет* — заражение сезонными вирусами гриппа А способствует развитию иммунной защиты против конкретного подтипа вируса.
Гетеросубтипический иммунитет* — заражение сезонными вирусами гриппа А способствует развитию иммунной защиты против неродственных данному вирусу суб-штаммов.Другими словами, детский иммунитет и все, что он пережил, оставляет свой след в иммунитете на всю жизнь. Ранее проведенные исследования показали, что взрослые люди обладают более сильным иммунитетом против тех типов вирусов, которыми они были заражены в детстве. Также недавно было установлено, что импринтинг защищает от новых подтипов вируса птичьего гриппа той же филогенетической группы гемагглютинина (hemagglutinin, HA), что и при первом заражении в детстве.
До недавнего времени узкий перекрестный защитный иммунитет, специфичный для вариантов одного подтипа HA, считался основным способом защиты от сезонного гриппа. Однако есть новые данные, утверждающие, что на формирование иммунитета может влиять и память других антигенов гриппа (например, нейраминидазы, NA). С 1918 года среди людей было зафиксировано три подтипа НА: H1, H2 и H3. При этом H1 и H2 относятся к филогенетической группе 1, а H3 — к группе 2.
Если учитывать тот факт, что импринтинг, скорее всего, вызывает множественные изменения в иммунной памяти, то можно предположить, что эти изменения имеют определенную иерархию.
Ученые отмечают, что с 1977 года среди населения сезонно циркулировали два подтипа гриппа A — H1N1 и H3N2. При этом отличия в демографии заражения и в симптоматике были достаточно явными, но плохо изученными. Эти отличия могут быть связаны именно с импринтингом в детстве: пожилые люди почти наверняка подвергались воздействию H1N1 в детстве (с 1918 по 1975 это был единственный подтип, циркулирующий среди людей). Следовательно, в настоящее время эти люди лучше защищены от современных сезонных вариантов вируса данного подтипа. Аналогичным образом, у молодых людей самая высокая вероятность импринтинга в детском возрасте относится к более современному H3N2 (изображение №1), что согласуется с относительно низким числом клинически зафиксированных случаев H3N2 в этой демографической группе.

Изображение №1: варианты моделей зависимости иммунитета от импринтинга в детстве и фактора вирусной эволюции.
С другой стороны, эти отличия могут быть связаны с эволюцией самих подтипов вирусов. Так, H3N2 демонстрирует более быстрый дрейф* своего антигенного фенотипа, чем H1N1.
Дрейф антигенов* — изменения иммунообразующих поверхностных факторов вирусов.По этой причине H3N2 может лучше избегать ранее сформированного иммунитета у иммунологически опытных (ранее переболевших) взрослых людей, тогда как H1N1 может быть относительно ограничен в силе своего воздействия исключительно на иммунологически неопытных (ранее не болевших) детей.
Для проверки всех вероятных гипотез ученые провели анализ эпидемиологических данных, создав функции правдоподобия для каждого варианта статистических моделей, сравнение которых было выполнено посредством информационного критерия Акаике (AIC).
Также был проведен дополнительный анализ гипотезы, в которой отличия обусловлены не импринтингом, в эволюцией вирусов.
Подготовка к исследованию
В моделировании гипотез были использованы данные департамента здравоохранения штата Аризона (ADHS), а именно 9510 случаев сезонных H1N1 и H3N2 по всему штату. Примерно 76% из зарегистрированных случаев были зафиксированы в больницах и лабораториях, остальные случаи не были уточнены в лабораториях. Также известно, что примерно половина из лабораторно установленных случаев были достаточно серьезными, потому привели к госпитализации.
Данные, использованные в исследовании, относятся к периоду в 22 года: с сезона гриппа 1993–1994 по сезон 2014–2015. Стоит отметить, что размеры выборки резко возросли после пандемии 2009 года, потому этот период был исключен из выборки (таблица №1).
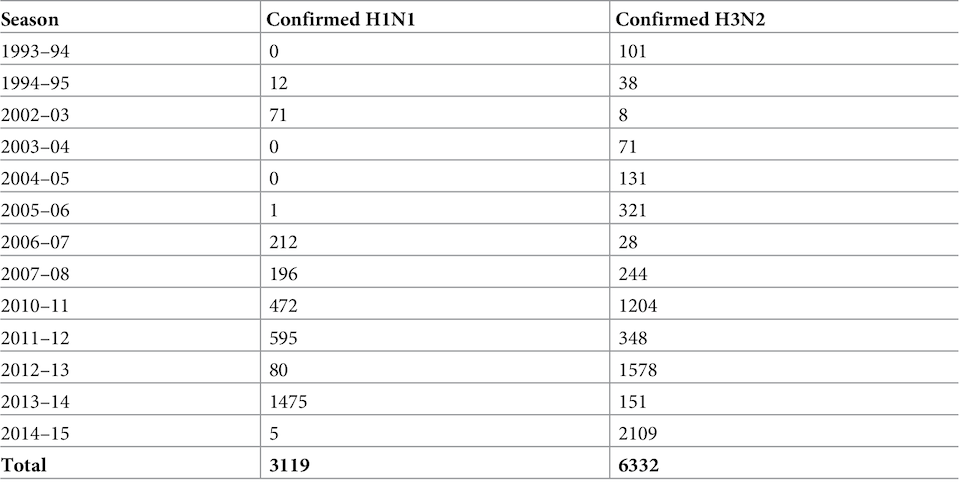
Таблица №1: эпидемиологические данные с 1993 по 2015 год касательно зафиксированных случаев вирусов H1N1 и H3N2.
Также важно учитывать, что с 2004 года коммерческие лаборатории США были обязаны передавать государственным здравоохранительным органам все данные относительно вирусного заражения пациентов. Однако большинство проанализированных случаев (9150/9451) наблюдались начиная с сезона 2004–2005, уже после того как это правило вступило в силу.
Из всех 9510 случаев было исключено 58, так как это были люди с годом рождения до 1918 (их импринтинг статус не может быть однозначно определен), и еще 1 случай из-за неверно указанного года рождения. Таким образом в модели анализа попали 9541 случаев.
На первом этапе моделирования были определены вероятности импринтинга к вирусам H1N1, H2N2 или H3N2, специфического для года рождения. Данные вероятности отражают характер воздействия гриппа А на детей и его распространенность по годам.
Большая часть людей, родившихся в период между пандемиями в 1918 и 1957 годах, впервые заразились именно подтипом H1N1. Люди, родившиеся в период между пандемиями 1957 и 1968 годов, практически все были инфицированы подтипом H2N2 (1А). А уже с 1968 года доминирующим подтипом вируса был H3N2, ставший причиной инфицирования большинства людей из молодой демографической группы.
Несмотря на распространенность H3N2, H1N1 все же сезонно циркулировал среди населения с 1977 года, вызвав импринтинг у части людей, родившихся с середины 1970-х годов (1А).
Если импринтинг на уровне подтипа НА формирует вероятность заражения во время сезонного гриппа, то воздействие НА подтипов Н1 или Н3 в раннем детстве должно обеспечить пожизненный иммунитет к более современным вариантам того же подтипа НА. Если же импринтинговый иммунитет работает по большей степени против определенных типов NA (нейраминидаза), то пожизненная защита будет характерна для N1 или N2 (1В).
Если же импринтинг основан на более широком НА, т.е. имеет место защита от более широкого спектра подтипов, то люди с импринтингом от Н1 и Н2 должны быть защищены от современного сезонного H1N1. В то же время люди с импринтингом к Н3 будут защищены только от современного сезонного H3N2 (1В).
Ученые отмечают, что коллинеарность (грубо говоря, параллельность) предсказаний различных моделей импринтинга (1D-1I) была неизбежна, учитывая ограниченное разнообразие антигенных подтипов гриппа, циркулирующих среди населения в течение прошлого века.
Важнейшую роль в дифференциации между импринтингом на уровне подтипа HA, подтипа NA или на уровне группы HA играют люди среднего возраста, которые впервые заразились именно H2N2 (1В).
Каждая из проверенных моделей использовала линейную комбинацию инфицирования, связанного с возрастом (1С), и инфицирования, связанного с годом рождения (1D-1F), для получения распределения случаев H1N1 или H3N2 (1G – 1I).
Всего было создано 4 модели: самая простая содержала только возрастной фактор, а в более сложные модели были добавлены факторы импринтинга на уровне подтипа HA, на уровне подтипа NA или на уровне группы HA.
Кривая возрастного фактора имеет форму ступенчатой функции, в которой относительный риск инфицирования был установлен как 1 в возрастной группе 0–4. Помимо первичной возрастной группы были еще следующие: 5 –10, 11–17, 18–24, 25–31, 32–38, 39–45, 46–52, 53–59, 60–66, 67–73, 74–80, 81+.
В моделях, которые содержали эффекты импринтинга, предполагалось, что доля людей в каждом году рождения с защитным импринтингом в детстве пропорциональна снижению риска инфицирования.
Также в моделирование учитывался и фактор вирусной эволюции. Для этого были использованы данные, в которых описывался годовой антигенный прогресс, который был определен как среднее антигенное расстояние между штаммами определенной вирусной линии (H1N1 до 2009, H1N1 после 2009 и H3N2). «Антигенная дистанция» между двумя штаммами гриппа используется в качестве показателя сходства антигенного фенотипа и потенциальной иммунной перекрестной защиты.
Чтобы оценить влияние антигенной эволюции на эпидемическое возрастное распределение, была проведена проверка изменений доли случаев у детей в сезоны, когда произошли сильные антигенные изменения.
Если уровень антигенного дрейфа является решающим фактором возрастного риска инфицирования, то доля случаев, наблюдаемых у детей, должна быть отрицательно связана с ежегодным антигенным прогрессом. Другими словами, штаммы, которые не претерпели значительных антигенных изменений по сравнению с предыдущим сезоном, должны быть неспособны избежать ранее существовавшего иммунитета у взрослых с иммунологическим опытом. Такие штаммы будут более активны среди населения, не имеющего иммунологического опыта, то есть среди детей.
Результаты исследования
Анализ данных по годам показал, что сезонный H3N2 был основной причиной инфицирования среди населения старшего возраста, тогда как H1N1 поражал людей среднего возраста и молодежь (изображение №2).
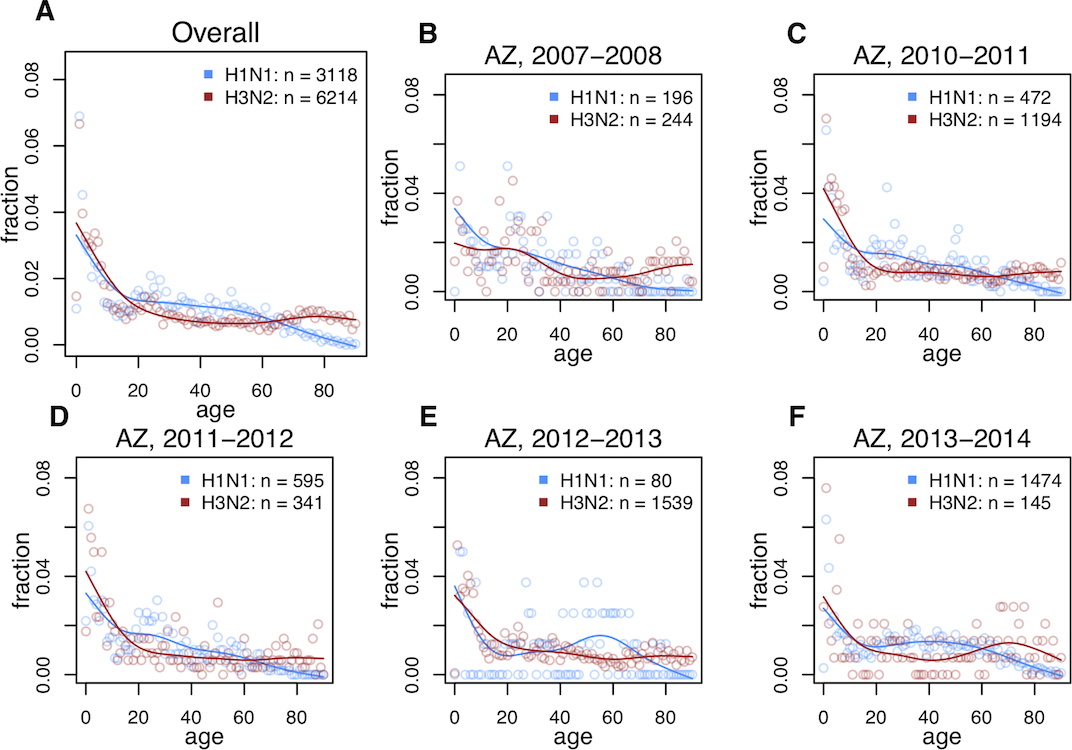
Изображение №2: распределение гриппа H1N1 и H3N2 по возрасту в разные временные периоды.
Данная закономерность присутствовала как в данных до пандемии 2009 года, так и после нее.
Данные показали, что импринтинг на уровне подтипа NA преобладает над импринтингом на уровне подтипа HA (?AIC = 34.54). При этом практически полностью отсутствовал импринтинг на уровне группы HA (?AIC = 249.06), как и полное отсутствие импринтинга (?AIC = 385.42).

Изображение №3: оценка соответствия моделей к данным исследования.
Визуальная оценка соответствия моделей (3C и 3D) подтвердила, что модели, содержащие эффекты импринтинга на узких уровнях подтипов NA или HA, обеспечивают наилучшее соответствие данным, используемым в исследовании. Факт того, что модель, в которой импринтинг отсутствует, не может быть подтверждена данными говорит о том, что импринтинг является крайне важным аспектом формирования иммунитета у взрослого населения по отношению к сезонным подтипам гриппа. Тем не менее, импринтинг работает по очень узкой специализации, то есть действует исключительно на определенный подтип, а не на целый спектр подтипов гриппа.

Таблица №2: оценка соответствия моделей к данным исследования.
После учета демографического распределения по возрасту предполагаемый возрастной риск был наивысшим у детей и пожилых людей, что соответствовало накоплению иммунной памяти в детском возрасте и ослаблению иммунной функции у пожилых людей (на 3А показана приближенная кривая из лучшей модели). Оценки параметров импринтинга были меньше единицы, что указывает на некоторое снижение относительного риска (таблица №2). В рамках наилучшей модели предполагаемое снижение относительного риска от импринтинга в детском возрасте было более сильным для H1N1 (0.34, 95% CI 0.29–0.42), чем для H3N2 (0.71, 95% CI 0.62–0.82).
Для проверки влияния вирусной эволюции на возрастное распределение риска инфицирования ученые искали уменьшение доли случаев инфицирования среди детей в периоды, связанные с антигенными изменениями, когда штаммы с высоким антигенным дрейфом более эффективно заражали взрослых иммунологически опытных людей.
Анализ данных показал небольшую отрицательную, но незначительную связь между ежегодным увеличением антигенной активности и долей случаев H3N2, наблюдаемых у детей (4А).

Изображение №4: влияние вирусной эволюции на возрастной фактор риска инфицирования.
Однако между антигенными изменениями и долей случаев, наблюдаемых у детей старше 10 лет и у взрослых, не было выявлено четкой взаимосвязи. Если бы вирусная эволюция играла основную роль в данном распределении, то в результате наблюдались бы более четкие доказательства эволюционного влияния среди взрослых, а не только при сравнении взрослых и детей до 10 лет.
Кроме того, если степень эволюционных изменений вирусов является доминирующей для подтип-специфических различий в распределении эпидемического возраста, то когда подтипы H1N1 и H3N2 показывают одинаковые степени ежегодного распространения антигена, их возрастное распределение случаев инфицирования должны выглядеть более схожими.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
В данном труде ученые проанализировали эпидемиологические данные случаев инфицирования H1N1, H3N2 и H2N2. Анализ данных показал четкую зависимость импринтинга в детстве и степени риска заражения в зрелом возрасте. Другими словами, если ребенок в 50-е годы был инфицирован, когда циркулировал H1N1, а H3N2 отсутствовал, то в зрелом возрасте вероятность инфицирования H3N2 будет гораздо больше, чем вероятность подхватить H1N1.
Основной вывод данного исследования заключается в том, что важно не только то, чем человек болел в детстве, но и в какой последовательности. Иммунная память, формирующаяся на протяжении жизни, активно «записывает» данные первых вирусных инфекций, что способствует более эффективному противодействию им в зрелом возрасте.
Ученые надеются, что их труд позволит лучше предсказывать, какие именно возрастные группы более подвержены воздействию того или иного подтипа гриппа. Эти знания могут помочь в предотвращении распространения эпидемий, особенно если нужно распределить ограниченное число вакцин среди населения.
Это исследование не нацелено на поиск супер-лекарств от гриппа любого типа, хоть это и было бы замечательно. Оно нацелено на то, что куда более реально и важно в данный момент — предотвращение распространения инфекции. Если мы не можем моментально избавиться от вируса, то мы должны обладать всеми возможными инструментами для его сдерживания. Одним из самых верных союзников любой эпидемии является небрежное отношение к ней как со стороны государства в целом, так и каждого человека в частности. Паника, естественно, не нужна, ибо от нее может быть только хуже, но вот меры предосторожности никогда не помешают.
Благодарю за внимание, оставайтесь любопытствующими, берегите себя и своих близких и отличных всем выходных, ребята! :)
Немного рекламы :)
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Equinix Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?


vassabi
интересно — там нет проектов по «как обучить иммунитет опознавать все типы таких вирусов»?
Т.е. хотя бы вирусов типа HxNy?
Doc_x800
увы, это
Doc_x800
нереально
vassabi
Хорошо, а хотя бы расширить список «вырабатываемых антител» на 1 вакцину?