
Универсального лечения от онкологических заболеваний не существует до сих пор, однако биоинформатики работают с колоссальным объемом данных, чтобы в том числе разрабатывать новые методы лечения и диагностики рака.
Но есть одна незадача: рак – это общий термин, обозначающий большую группу сложных многофакторных заболеваний, на развитие которых влияет и окружающая среда и генетика. Он может проявиться у любого человека в любой момент жизни. И да, привязанности к органам или тканям нет: в потенциальной опасности любая часть тела – от мозга до костей.
Большие надежды на борьбу с раком мировая медицина связывает с развитием биоинформатики. С её помощью исследователи смотрят на жизнь не через микроскоп, а с точки зрения огромных массивов данных. Это некая оцифровка биологии, делающая работу исследователей похожей на работу программистов.
Содержание:
Биоинформатика: слияние дисциплин

Если говорить о современных представлениях, то биоинформатика – это междисциплинарная область, изучающая молекулярно-биологические данные. Сюда могут входить структуры белков и их взаимодействие с окружением, или последовательности геномов, а также их работа или, напротив, бездействие.
В общем, данных более чем достаточно, и всё это нужно хранить, структурировать, визуализировать и анализировать, а после делать доступные выводы, которые помогают в работе традиционным биологам, химикам, математикам, врачам и другим специалистам.
Примеры тем, которые затрагиваются:
Как развивается эмбрион на ранних стадиях;
Как работает конкретный вид белка;
Как активируется конкретный ген, и что регулирует его работу;
Как устроена клеточная организация в мышечных тканях;
Как ведёт себя популяция клеток с течением времени на примере компьютерной модели;
Как быстро делятся раковые клетки у конкретного человека.
Если сильно увлечься, то список может выйти размером с “Полную историю Средиземья” Толкина. И это будет лишь малой частью прикладной биоинформатики.

Первое использование термина “биоинформатика” можно датировать 1970 годом. Бен Хеспер и Полина Хогевег собирались провести исследование по изучению информационных процессов в биотических системах.

Учёные предположили, что важнейшее свойство жизни – это хранение, обработка и передача генетической информации.
А чтобы работать с огромными массивами биологических данных необходимы компьютеры. Всё как в IT. Сложно представить жизнь, которая не накапливала бы информацию в процессе эволюции, не передавала бы её своим потомкам, чтобы те успешно адаптировались к постоянно меняющимся условиям. Изучением этих процессов занимается эволюционная биология, которая тесно связана с биоинформатикой. Чем прогрессивнее методы изучения генетической информации, тем глубже в историю можно заглянуть. Так, реконструируя последовательности ДНК и РНК, в 2010 году удалось доказать предположение Дарвина, что всё живое на планете произошло от последнего универсального общего предка (LUCA).
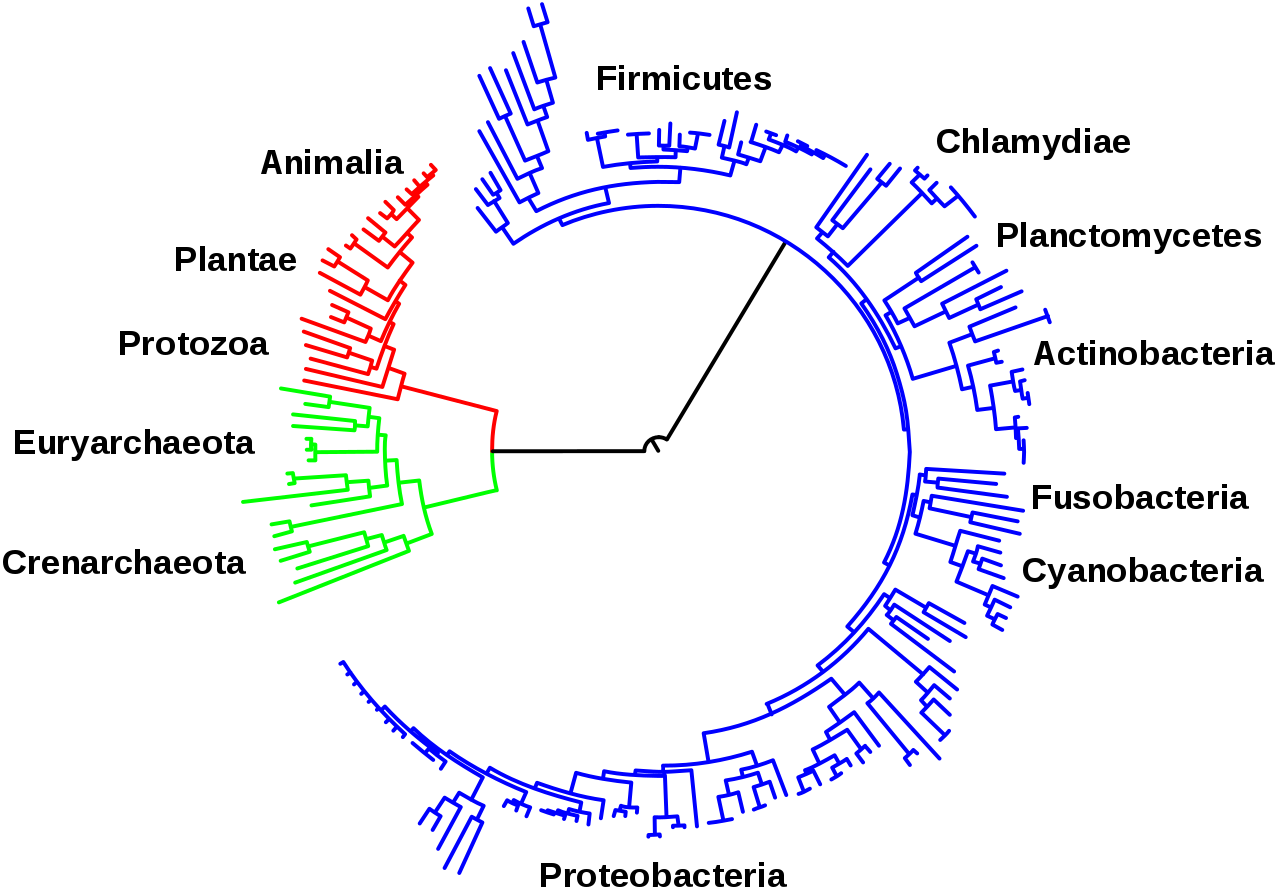
Чтобы определить, какие гены можно отнести к древнейшим – тем, что были у общего предка ещё до расхождения доменов, – биоинформатикам потребовалось обработать огромные массивы данных.
Например, чтобы найти гены, встречающиеся как минимум у двух крупных групп бактерий, и двух – архей, учёным пришлось проанализировать более 6,1 млн кодирующих белков генов из ДНК 1847 современных видов бактерий и 134 архей, объединив их в 258,5 тыс. семейств. Около 11 тыс. из них обнаруживаются у представителей обоих доменов жизни, однако лишь 355 демонстрируют структурную гомологию и имеются более чем у двух видов бактерий и архей.
Подобные расчёты (а также множество сопутствующих) возможны только на мощных вычислительных серверах и специальном софте.
Пример инфраструктуры для генетических исследований
Медицинская школа Стэнфордского университета создала Genetics Bioinformatics Service Center (GBSC) – это центр, созданный для облегчения крупномасштабной геномики.
Некоторые возможности и характеристики GBSC:
Локальный вычислительный кластер: 2800+ ядер и 7+ петабайт высокопроизводительного хранилища;
Установлено и готово к использованию более 700 пакетов программного обеспечения для биоинформатики;
«Биоинформатика как услуга (BaaS)»: консультации для получения практической помощи;
Анализ популярных типов данных NGS, таких как RNASeq, ChIPSeq, MethylSeq, Whole Genome / Whole Exome Seq, CancerSeq и Microbiome, а также анализ новых типов данных, таких как Hi-C и ATAC-Seq;
Google Cloud Gateway: для масштабируемых вычислений;
Локальный и облачный шлюз поддерживают передовые методы безопасности NIH dbGaP;
Локальная инфраструктура размещается в ЦОДах Стэнфорда, что обеспечивает аптайм > 99%.
И это даже не вершина айсберга. Впечатляет?
Как исследование генов помогает в борьбе с раком?
Чтобы понять, как бороться с раком, для начала нужно его изучить. Как пишет ВОЗ, рак – это общий термин для большой группы заболеваний. Поэтому универсальной таблетки от всех его видов ждать не стоит. На данный момент в лечении онкологических заболеваний делают упор на химиотерапию, гормональную терапию, иммунотерапию и прицельную (таргетную) терапию.
Наиболее перспективным методом кажется иммунотерапия, которая способна подтолкнуть естественные биологические процессы в нужное русло. Наш организм уже имеет механизмы для борьбы с раком, ему нужно лишь указать, где находится враг, и как не дать себя обмануть.
На таргетную терапию также возлагают большие надежды, так как она преимущественно нацелена на конкретные белки или ферменты, несущие мутации и другие генетические изменения. Это точечная борьба с раковыми клетками, чтобы минимизировать вред для здоровых клеток.
Интересный факт.
Первый таргетный препарат тамоксифен был создан в 1962 году британскими учёными под руководством биолога Артура Уолпола и химика Доры Ричардс. Тогда ещё не существовало понятия “таргетная терапия”. Изначально планировалось использовать тамоксифен для контроля над рождаемостью, однако в качестве контрацептива он оказался бесполезен. Зато и по сей день отлично помогает в лечении эстрогенально чувствительных форм рака молочной железы. Его эффективность достигает 70-80%.

Без биоинформатики невозможно представить создание баз данных ДНК отдельных людей. Помимо хранения и передачи информации её также необходимо обрабатывать, сравнивать и интерпретировать, чтобы использовать в терапии. И если многие заболевания можно изучить, а после применять отработанные методики в лечении, то рак нестабилен и больше напоминает синергетические системы.
Биоинформатика не только помогает в изучении ДНК, но и изучает механизмы белковых взаимодействий, используется в разработке препаратов, а также изучает онкогенез (зарождение рака) и многое другое.
Нейросети для работы с рентгеновскими снимками

Когда дело доходит до нейросетей, Big Data и других мегапопулярных словечек в масс-медиа, хочется закатить глаза и сказать: “Вы серьёзно?” Слишком много “белого” шума. Но, как ни странно, в последние годы получилось достигнуть реальных результатов с помощью биоинформатических методов работы с данными, например, софт Care Mentor AI. Это работающая сервисная платформа лучевой диагностики, использующая Data Mining и PACS (Picture Archiving and Communication System).
Data Mining – это методы поиска новых полезных знаний в массиве данных для практического применения.

PACS – это технология передачи и архивации DICOM изображений, использующая напрямую серверы, которые дают доступ к информации пользователям DICOM сети.
Если по-простому: человеку сделали МРТ, данные с томографа по протоколу DICOM передаются на PACS-серверы для хранения, передачи и дальнейшей обработки данных на других устройствах.

Компания Care Mentor AI в 2021 году зарегистрировала два медицинских IT-продукта с ИИ в Росздравнадзоре. Сейчас они совместно со “СберМедИИ” занимаются диджитализацией российского здравоохранения. Уже в этом году в России будут интегрироваться прогрессивные программные методы лучевой диагностики на базе ИИ.

Что это даёт на практике врачам и пациентам?
Значительно повышает эффективность лучевой диагностики в части расшифровки рентгенологических исследований флюорограмм и применяется для автоматизации диспансеризаций и повышенной нагрузки на специалистов.
Ускоряет анализ КТ-исследований, визуализируя патологически измененные области легких на аксиальных срезах нативного КТ-исследования, и c высокой точностью определяет процент и степень поражения легких.
Технологии быстро и точно диагностируют не только COVID-19 или злокачественные опухоли, но и туберкулёз, пневмонию, и другие патологии.
Оба продукта Care Mentor AI уже сейчас интегрированы в Московский Единый радиологический информационный сервис (ЕРИС) и работают с 400 медучреждениями в Москве. При этом существуют и развиваются программные продукты от других разработчиков, например, “Третье мнение” или решения от Botkin.AI.
На чём вся эта радость работает?

Поскольку биомедицинские данные обладают огромной размерностью, нужны вычислительные мощности с параллелизацией процессов. Поэтому компания Care Monitor AI для своих целей выбрала петафлопсный суперкомпьютер ZHORES.
В “Жоресе” информация между узлами передается через оптоволокно и полупроводниковые лазеры (на полупроводниковых гетероструктурах). Их открыл российский учёный Жорес Алфёров, за что получил в 2000 году Нобелевскую премию.
Некоторые характеристики суперкомпьютера ZHORES c сайта Skoltech на 27.05.2022:
Общее описание
Платформа: гибридного кластера;
Общее назначение: для исследований, требующих большого количества; гибридных вычислительных ресурсов: GPU и CPU;
Вычислительная часть
Вычислительные блейды:
Узлы CPU – 48;
Узлов MEM – 10;
Узлов GPU – 26;
Узлов виртуализации – 6;
Пиковая производительность – 1 Петафлопс;
104 графических процессора (Tesla V100-SXM2) с 16 ГБ памяти;Сеть
Сеть передачи данных: InfiniBand EDR (100 Гбит/с);
Сети обслуживания и управления: 1GbE;Система хранения данных
Параллельная файловая система хранения данных: GPFS 416T;
Домашний каталог: BeeGFS;
100T CephFS;ОС
CentOS Linux версии 7.9 (ядро 5.4.15);Менеджер рабочей нагрузки
Slurm 20;
Таким образом биоинформатика увеличивает точность и скорость диагностики, уменьшает влияние человеческого фактора, а также позволяет увеличить выживаемость пациентов благодаря раннему обнаружению опухолевых патологий.
Мы рассмотрели один из современных способов диагностировать рак с помощью ИИ, но как биоинформатика помогает бороться с обнаруженными онкологическими новообразованиями?
Борьба с раком – гонка вооружений

Прежде чем мы начнём говорить о новых методах в лечении рака, разработанных с помощью биоинформатики, давайте посмотрим, что там по цифрам на сайте ВОЗ.
Рак является одной из основных причин смерти в мире. Так, в 2020 г. от этого заболевания умерли почти 10 миллионов человек. В 2020 г. наиболее распространенными видами рака (с точки зрения количества новых случаев рака) были следующие:
Рак молочной железы (2,26 миллиона случаев);
Рак легких (2,21 миллиона случаев);
Рак толстой и прямой кишки (1,93 миллиона случаев);
Рак предстательной железы (1,41 миллиона случаев);
Рак кожи (немеланомный) (1,20 миллиона случаев);
Рак желудка (1,09 миллиона случаев).
Наиболее часто в 2020 г. смерть наступала от следующих видов рака:
Рак легких (1,80 миллиона случаев смерти);
Рак толстой и прямой кишки (935 000 случаев смерти);
Рак печени (830 000 случаев смерти);
Рак желудка (769 000 случаев смерти);
Рак молочной железы (685 000 случаев смерти).
Ну а теперь пристёгиваем ремни и отправляемся в путешествие.
Биологический блицкриг — рак атакует
Первый молниеносный ход в этом противостоянии делает рак. Он поражает некогда нормальную клетку поэтапно. Первопричина – это сбой в генах из-за мутации. Клетка начинает неконтролируемо делиться, а механизмы (апоптоз), которые должны сработать и уничтожить клетку, блокируются.
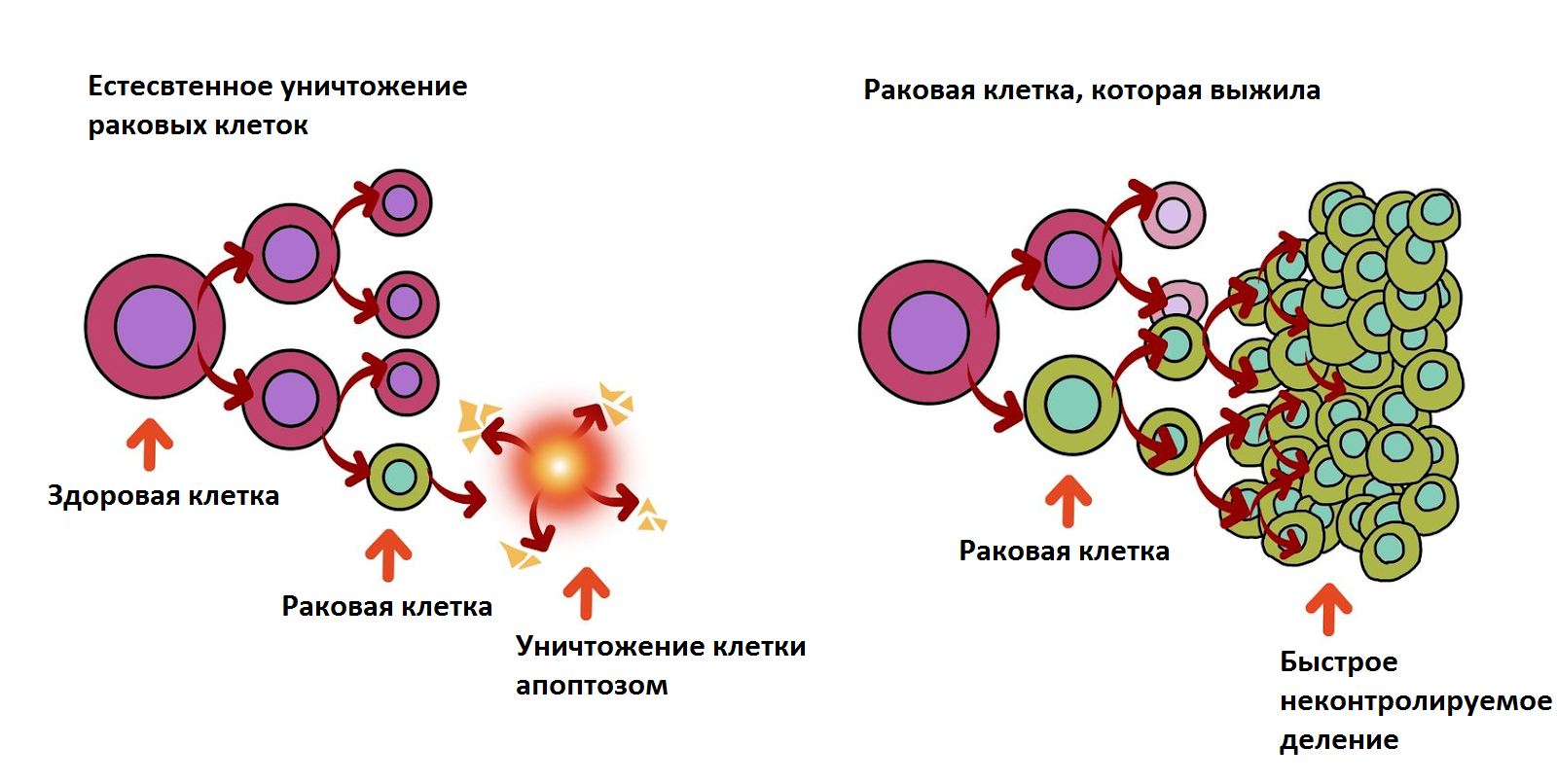
Иммунной системе раковые клетки подают сигналы, что у них на вечеринке всё отлично: “Мы тут не пытаемся вырасти в чудовище – никакого неконтролируемого роста, просто заживляем ранку”.
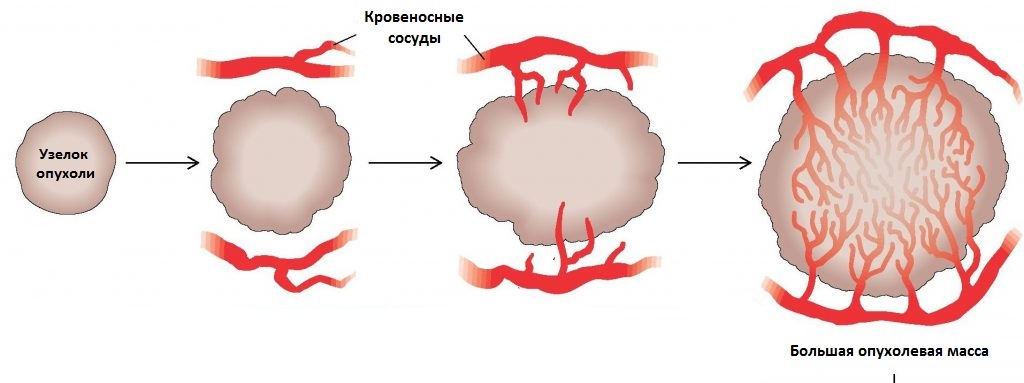
Поскольку рост протекает стремительно, опухоли требуется много питательных веществ и она эксплуатирует ангиогенез по максимуму. “Подключившись” к кровеносной системе, опухоль потребляет очень много питательных веществ, забирая еду у здоровых тканей.
Еще одна хитрость, к которой прибегает большинство раковых клеток – это удлинение теломер с помощью теломеразы. Нормальная клетка каждый раз после деления укорачивает концевые участки хромосом – так она состаривается и в конце теряет способность делиться. Среднестатистическая клетка делится около 50-70 раз, прежде чем умирает. Но раковая клетка этот механизм обходит и становится бессмертной (например, HeLa).

И вот у нас есть клетки, которые обхитрили иммунную систему, быстро, неконтролируемо и бесконечно делятся, кушают много и вкусно, а также не умирают от апоптоза. Что ещё нужно для счастья? Конечно же путешествия.
По новым кровеносным каналам, которые создала опухоль, раковые клетки начинают метастазировать. Словно подростки, окончившие школу, они хотят повидать мир организм и перестают воспринимать клеточное окружение как постоянную среду своего обитания. Поэтому они отрываются от родительской опухоли и колесят по кровеносной системе, порождая новые очаги рака. Как утверждает ВОЗ, именно метастазы являются основной причиной смерти от рака.

Лучшая защита – нападение: некоторые приёмы медицины и биоинформатики
Не хочешь умирать? Заставим!
Большинство клеток не живёт в течение всей жизни многоклеточного организма. Да, есть нейроны, которые формируются в младенчестве, а потом теряют способность делиться, и многие из них доживают с нами до конца. Однако остальные клетки запрограммированы умереть намного раньше. Сам процесс смерти очень сложен и упорядочен, так как клетка должна умереть “интеллигентно”: не просто уничтожиться и распасться, а сделать это так, чтобы продукты распада не навредили окружающим клеткам. Поэтому в организме существуют специальные белки, с помощью которых клетка сама себя аккуратно убивает.

Этот процесс называется программируемой клеточной гибелью. Например, апоптоз.
Классическим примером апоптоза считается исчезновение хвоста у головастика. Он не испаряется в никуда. Клетки, образующие хвост, начинают в нужный момент массово умирать.

Другой вариант смерти клетки – некроз, при котором клетка набухает, лопается, ферменты разрушают окружение, начинается воспаление. Зрелищно, но жутко вредно для организма.
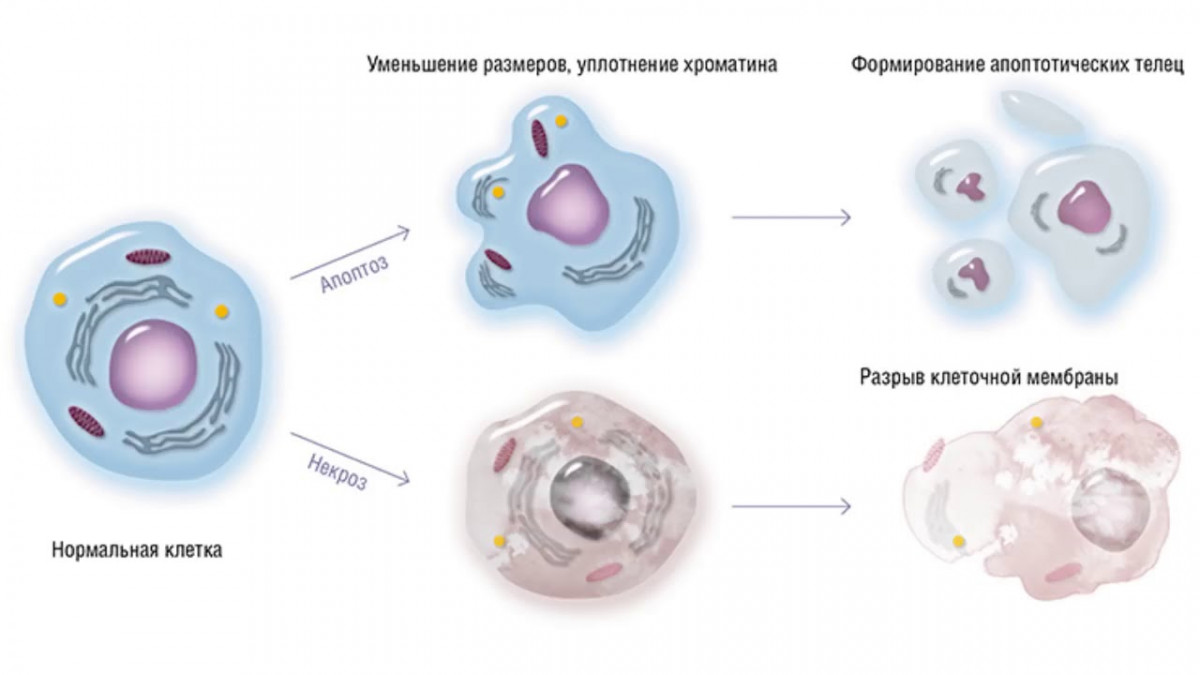
Сильно упрощенное описание апоптоза:
Сигнальная фаза.
Клетка получает сигнал (внешний или внутренний), что необходимо запустить самоуничтожение.
Эффекторная фаза.
Это активный процесс, когда сигнал переходит в действие. В ядре происходит компактизация хроматина, после чего клетка уменьшается в размере и внутри неё всё разрушается на фрагменты.
Деградационная фаза
На последнем этапе апоптоза клетка разделяется на отдельные тельца со своей оболочкой, которые приблизительно за полтора часа захватываются и перевариваются макрофагами или другими клетками. Тихо, аккуратно и без воспалений.
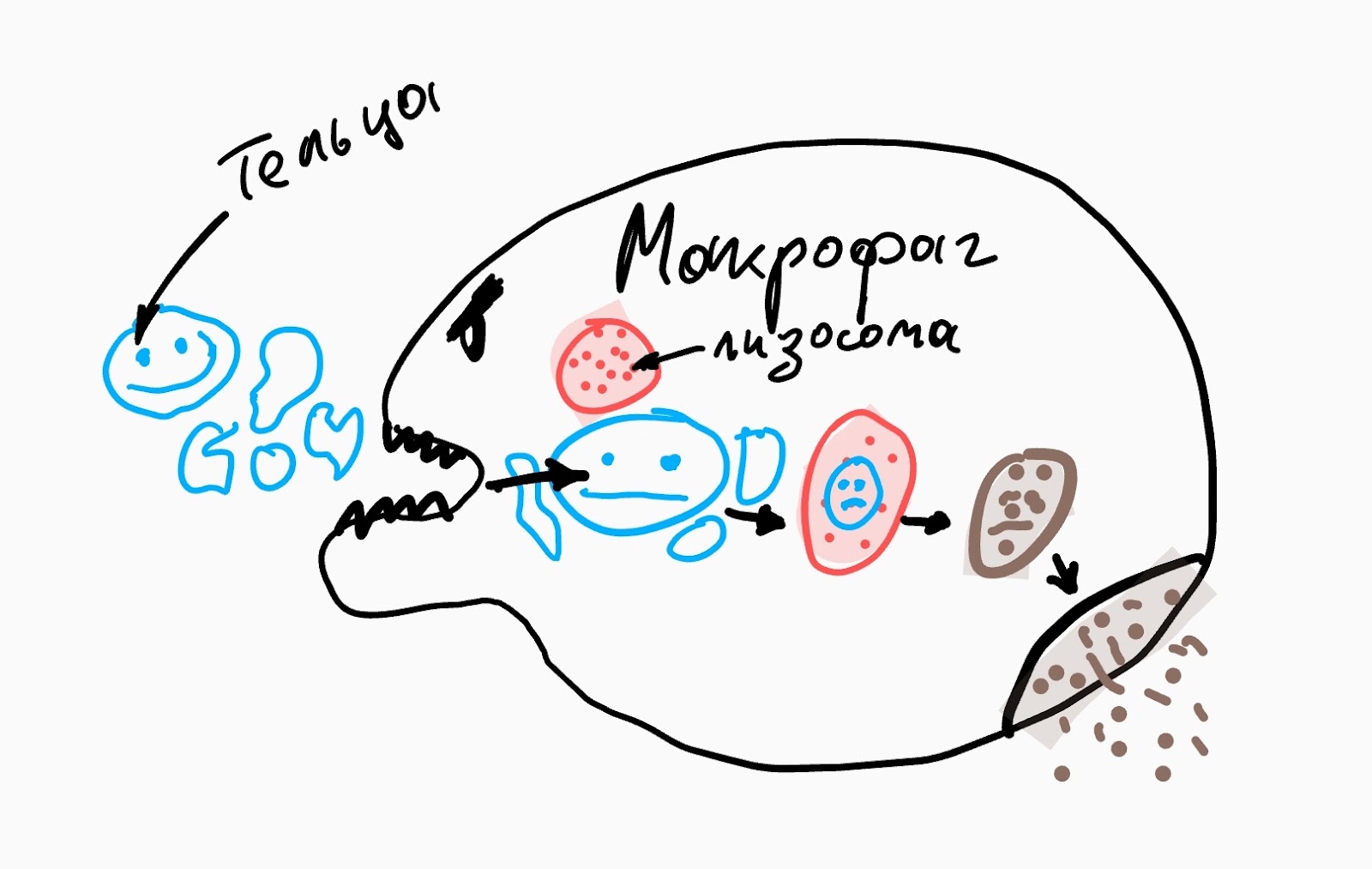
Как правило, от начала сигнальной фазы до окончательной фрагментации клеток требуется несколько часов. Однако необходимое время зависит от типа клетки, стимула и пути апоптоза.
Почему апоптоз важен для клетки?
Иногда клетка состаривается и приходит её время, а иногда в клетке происходят нежелательные процессы, например, проник вирус. Тогда клетка стремится умереть сама. Вирус же пытается сломать механизм апоптоза, чтобы не умереть в ней, а размножиться и распространиться на другие клетки. Поэтому, когда мы болеем простудой – это в том числе результат неудавшегося апоптоза.
Популярное представление о раке – это сломавшийся механизм деления клеток. Да, при онкологии у клеток действительно наблюдается избыточное деление, что приводит к быстрому росту опухолей, однако другая сторона медали – это неработающий апоптоз. Именно поломка генов, отвечающих за программируемую клеточную гибель, является одной из основных причин онкологических заболеваний.
Активация апоптоза

Очевидно, что запуск апоптоза – это идеальный сценарий разрушения опухоли. Так как раковая клетка произошла от обычной клетки, то механизм апоптоза в ней изначально заложен, а потому существуют противораковые препараты, способные его запустить.
К сожалению, раковые клетки эффективно подавляют апоптоз. Так, дефекты гена-супрессора опухолей р53 (ген для профилактики мутации клетки в раковую) связаны с более чем 50% раковых заболеваний человека. Но исследования в этой области продолжаются. Новые стратегии лечения, направленные на апоптоз, осуществимы и могут быть использованы при лечении различных типов рака. Некоторые из этих открытий носят доклинический характер, а другие уже прошли клинические испытания.
Основная проблема – активация апоптоза исключительно в раковых клетках, не затрагивая нормальные. Для этого необходимы научно обоснованные долгосрочные наблюдения за пациентами. Чем больше информации собирают исследователи апоптоза, тем больше работы у биоинформатиков. Они воспроизводят опыты и работают с данными, которые невозможно обработать вручную, ускоряя и удешевляя разработку препаратов. Например, во многих фармакологических компаниях есть целые отделы биоинформатиков – департаменты вычислительной биологии.

Эффективность в цифрах (на примере использования пембролизумаба в качестве адъювантной терапии меланомы III стадии после хирургического лечения):

Согласно результатам наблюдения на протяжении 3,5 лет, адъювантная терапия пембролизумабом обеспечивает снижение риска развития отдалённых метастазов или смерти на 40 % по сравнению с плацебо;
Выживаемость без отдаленных метастазов через 3,5 года составила 65,3 %;
Безрецидивной выживаемость (БРВ) – 59,8%.

С точки зрения маскировки раковая клетка – это волк в овечьей шкуре. Все считают его своим парнем, знают его родственников, некоторые даже общаются с ним. Однако это не более чем удачный обман. Чтобы эффективно скрываться, раковые клетки пытаются скрыть молекулы-антигены, по которым иммунная система может вычислить чужаков.
Как это происходит? Когда в клетках возникают нежелательные мутации, она приносит себя в жертву, активируя апоптоз. Однако, как мы выяснили, активация апоптоза в раковых клетках нарушена. Поэтому, активно разрастаясь, опухоль накапливает в себе множество других мутаций, некоторые из них маскируют раковые клетки от иммунитета и препаратов. Чтобы решить эту проблему, разработали адоптивную иммунотерапию (не путать с адаптивной).
Адоптивная иммунотерапия – школа для биологических киллеров
У каждого из нас есть лимфоциты – ключевые ребята в работе иммунитета. Они бывают нескольких видов: B-клетки, NK-клетки и T-клетки, они же T-киллеры.

Суть адоптивной иммунотерапии (от англ. adoptive — приёмный) заключается в обучении Т-лимфоцитов убивать раковые клетки. В целом в нашем организме уже есть Т-клетки, которые борются с раком, однако рак зачастую очень хитёр и находится в другой весовой категории.
Сложности возникают из-за разнообразия белков в организме человека – их десятки тысяч. Если выбирать жертву недостаточно тщательно, то T-киллеры могут убить нормальные клетки. Если сместить баланс в другую сторону, то болезни с радостью организуют вечеринку в городе без полиции. Поэтому есть механизмы идентификации врагов – некие триггерные системы проверки из белков.
Когда лимфоциты выбирают, кого убивать, раковые клетки для них максимально похожи на здоровые, так как мутировали из них и успешно маскируются. Если цель обозначить неправильно, то организм покалечит или убьет сам себя. Так происходит с аутоиммунными заболеваниями, когда лимфоциты начинают воевать не в ту сторону.
Ключевые преимущества адоптивной иммунотерапии:
Приводит к улучшению качества жизни онкологического пациента;
Может быть сопроводительным лечением и дополнять стандартную или комбинированную терапию, но может применяться и как самостоятельное лечение;
Позволяет улучшить переносимость стандартной химиотерапии и повышает ее эффективность;
До хирургического лечения может способствовать более гладкому течению послеоперационного периода;
После радикального хирургического лечения улучшает переносимость химиолучевой терапии;
Возможно на всех этапах лечения онкологического пациента при любой форме рака;
Эффективна даже в случае диссеминированного процесса (метастатическая болезнь, 3-4 стадии заболевания);
Не имеет противопоказаний и может применяться в параллели со стандартным лечением.
В основе адоптивной иммунотерапии лежит обучение клеток способам отличать раковые клетки от нормальных и атаковать их. На изображении ниже показана учебка для Т-киллеров.

Другой подход – адоптивный перенос естественных Т-киллеров от здорового донора. Преимущество такого подхода — отсутствие реакции "трансплантат против хозяина". Недостаток — нарушение работы трансплантированных клеток.
Рассмотрим фазы адоптивной иммунотерапии на примере CAR-T-19:
Аферез.
Во время пребывания пациента в стационаре с помощью системы экстракции (лейкаферез) из крови извлекают белые кровяные шарики, в том числе T-клетки. Эти клетки направляются на модификацию и последующую криоконсервацию.
Клеточное перепрограммирование.
Клетки (T-лимфоциты) проходят генетическую модификацию с целью распознавания раковых клеток, а также других клеток, экспрессирующих специфический антиген, который нужно разрушить. Этот процесс осуществляется в Барселоне, других центрах Европы и США.
Размножение.
Модифицированные T-клетки размножаются, замораживаются и отправляются в госпиталь, где находится пациент, после прохождения строгого процесса контроля качества.
Подготовка пациента.
Пациенту проводится предварительная химиотерапия, чтобы предупредить возможное отторжение организмом и способствовать сохранению и пролиферации CAR-T-клеток. Конечная цель заключается в помощи организму принять перепрограммированные CAR-T-клетки.
Инфузия.
Модифицированные T-клетки вводятся посредством внутривенной инфузии, подобно переливанию крови.
Атака клеток.
Если лечение работает так, как запланировано, после попадания в кровь пациента концентрат CAR-T-клеток атакует B-клетки и начинает уничтожение раковых антигенов.
Мониторинг
У 30-40% пациентов, получивших данное лечение, возможны нежелательные эффекты. В некоторых случаях они не являются тяжелыми, но иногда требуют наблюдения в отделении интенсивной терапии, где есть все условия для лечения специфических симптомов.
Наблюдение и результаты.
Результаты, уже опубликованные в научных журналах, свидетельствуют о том, что более чем у 80% детей и подростков, получивших эту новую терапию, наступила фаза ремиссии в первые три месяца после лечения.
Эффективность в цифрах (по данным работающего педиатрического госпиталя Сант Жуан де Деу Барселона):
Ответ на лечение методом CAR-T-19 был получен в 80% случаев.
Выздоровление более чем у 50% пациентов за полтора года лечения.
Также за исследования в этой области 70-летний Джеймс Эллисон (США) и 76-летний Тасуку Хондзё (Япония) получили Нобелевскую премию по медицине в 2018.
Клеточная мембрана – коллаборационист
В течение миллиардов лет клетки эволюционировали, чтобы защитить себя от враждебной окружающей среды. Так появилась мембрана – некий щит из белков и двойного слоя липидов, который обеспечивает целостность клетки. Однако клетке нужно не только защищаться от окружающей среды, но и питаться из неё, а также выкидывать продукты обмена. Для этого на мембране есть белки-переносчики.
Если проводить аналогию с квартирой, то мембрана – это пол, потолок и стены, а белки-переносчики – это дверь, через которую мы заносим продукты, а потом выносим мусор. Если у вас не жилой дом, а большой склад, то нужно много дверей, чтобы обеспечить отправку и приём товаров без простоев. Поэтому, когда развивается опухоль (склад), ей требуется как можно больше белков-переносчиков (дверей), чтобы удовлетворить свой ненасытный аппетит.
Во многих опухолях наблюдается увеличение белков-переносчиков глюкозы GLUT1, так как глюкоза – отличное питание для клеток. Все любят тортики. Казалось бы, почему просто не заблокировать GLUT1, чтобы опухоль погибла от голода?

Представьте, что организм – это многоквартирный дом, органы – это парадные, а клетки – это квартиры. Допустим, в квартире №300’000’000’042 (столько в среднем клеток в человеческой печени) круглосуточно происходят вечеринки. Играет Nirvana, на лестничной клетке то и дело ведутся разговоры о высоком, курьеры доставляют пиццу и напитки. Всё хорошо, но соседям не очень нравится. Тогда недовольной бабуле приходит идея перекрыть дверь в парадную, чтобы прекратить это безобразие.
Вечеринка быстро заканчивается вместе с едой и выпивкой, однако и добропорядочные жильцы больше не получают продукты. Дверь-то общая. Курьер с едой (глюкоза) будет пытаться доставить еду, но безуспешно. Тоже самое случится и с клетками: помимо раковых без питания пострадают и здоровые. А они лишними не будут.
Адресная доставка

Клеточная мембрана надёжно защищает клетку от внешней среды, но так как раковая клетка произошла от обычной, она унаследовала не только защиту, но и механизмы питания.
Чтобы уменьшить вред для здоровых клеток и воздействовать преимущественно на раковые, были разработаны методы доставки лекарств напрямую к опухолевым тканям и клеткам. Так, белки-переносчики превращаются в надёжных союзников. Например, белок SLC22A1 переносит через клеточную мембрану противоопухолевый препарат иматиниб, который вызывает апоптоз, что значительно увеличивает эффективность лечения миелоидного лейкоза.
Возвращаясь к аналогии с домом. Когда соседи регулярно шумят по ночам, то лучше вызвать полицию. Если у соседей прорвало трубу, то аварийную службу, если случился пожар, то пожарную бригаду и т.д.
Поэтому исследователи ищут способ, как использовать белки-переносчики для своих нужд, а не оставлять радиоактивный пепел после лечения. Например, в 2020 году адресный препарат от рака печени по этому принципу разработали учёные МГУ.
Что об этом сказала доктор химических наук, профессор кафедры органической химии в МГУ Елена Белоглазкина: “"Помощник" доставляет противоопухолевые препараты прямо к клеткам печени через псиалогликопротеиновый рецептор – одну из наиболее удобных мишеней для адресной доставки лекарственных агентов в клетку. Тем самым он позволяет существенно уменьшить вводимую пациенту дозу токсичного противоракового препарата, за счет того, что лекарство попадает только в опухолевые клетки, минуя здоровые”.
Эффективность в цифрах (на примере иматиниба):
Высокая биодоступность препарата при приёме внутрь – 98%. Этот параметр показывает, сколько лекарственного вещества дошло до места его действия в организме.
Терапия иматинибом обеспечивает высокую общую пятилетнюю выживаемость больных в поздней хронической фазе – 90,6%.
А как было до появления компьютеров и биоинформатики?

О существовании рака знали ещё до нашей эры. В древнеегипетском папирусе (ок. 1600 г. до н. э.) описаны случаи опухолей молочной железы, а также говорится, что вылечиться от этой болезни нельзя.
Попытки удаления опухоли хирургическим методом приводили к возвращению опухоли, так как раковые ткани при повреждении попадали в кровоток и метастазировали.
Так продолжалось вплоть до XIX-XX веков, пока хирургия не сделала скачок. Помимо самой опухоли стали удалять ткань вокруг, чтобы не допустить метастазирование рака.
Дальнейшим толчком для развития послужило изучение клеток с помощью новейших микроскопов. Только в 1950-х годах Сидни Фарбер разработал первые химиотерапевтические методы лечения некоторых видов рака.

В следующие десятилетия появился доксорубицин – антибиотик, нарушающий работу ДНК клеток, а также молекулярные лекарства, действующие на определённые типы рака. Но токсичность этих препаратов вызывала серьезные осложнения у пациентов.
Если подытожить, хирургический метод лечения был основным. В наши дни его также используют, но врачи пытаются не только избавиться от опухоли, но и сохранить как можно больше ткани. Поэтому биоинформатика нацелена в первую очередь на изучение первопричин рака, и только потом на борьбу с его последствиями.
Будущее биоинформатики в лечении рака и выводы

В 2000 году Билл Клинтон и Тони Блэр объявили, что глобальный научно-исследовательский проект по расшифровке генома человека выходит на финишную прямую и уже готовы черновые результаты. С этого момента в науке началась так называемая “постгеномная эра”. Полный геном был опубликован в 2003 году, но некоторые участки ДНК требуют дополнительного анализа и сегодня.
На сегодняшний день, интерпретирование полученных данных находится де-факто на начальной стадии. Достоверно удалось установить, что ДНК определяет, как клетка будет жить и функционировать. Поэтому исследования в этой области уже меняют подходы медицины в лечении людей. Врач, изучая определённую форму рака, может зайти в базы данных человеческого генома и досконально исследовать конкретный ген.

Если посмотреть на результаты, которых удалось достичь c 2003 года, то получается, что исследователи и врачи узнали, не меньше, чем за все предыдущие годы. Чтобы сделать полногеномное секвенирование в 2022 году не требуется объединения ученых со всего мира и миллиардов долларов. В России этот анализ можно сделать приблизительно за 100 тысяч рублей вместе с биоинформатической обработкой и заключением врача-генетика.

Если посмотреть на скорость развития вычислительной техники и софта, тенденции и методы секвенирования нового поколения, то можно утверждать, что секвенирование будет и дальше удешевляться и ускоряться. Возможно, в относительно недалёком будущем анализ станет доступен всем и будет проходить мгновенно на приёме у врача или в домашних условиях. Всё это позволит проводить диагностику и индивидуальную лекарственную терапию онкобольных в кратчайшие сроки и за доступные деньги.
Но до полного понимания рака и уверенного лечения всех его видов с высокой 5-летней выживаемостью ещё очень далеко. Медицине предстоит долгий путь, а на передовой будет биоинформатика — в этом нет никаких сомнений.
Комментарии (17)

PunkMachine
30.05.2022 09:55+1Очень интересная подача материала, а главное понятная. Спасибо за статью! Теперь мне интересно почитать о биоинформатике больше.

Barseadar Автор
30.05.2022 10:29+1Спасибо, когда собирал материал для статьи, смотрел интервью с интересным ученым-популяризатором биоинформатики — Михаилом Гельфандом. Если тема интересна, то с ним много контента на YouTube :)

PunkMachine
31.05.2022 06:06Огромное спасибо! Очень сильно заинтересовало. Посмотрю на досуге. Если посоветуете еще что-нибудь по общей биоинформатике на русском языке, буду признателен.

Serg79
30.05.2022 09:55Расскажите пожалуйста "на пальцах", каким образом полученные "большие" данные по ДНК опухоли и организма можно применить к определению относительного риска возникновения онкологического заболевания, его связи с профессиональной деятельностью, а также к созданию лекарств?

Barseadar Автор
30.05.2022 10:23Есть целые научные проекты по секвенированию генетического материала разных раковых опухолей. Например, проект "Раковый геном", результаты которого публикуются в огромной базе данных Catalogue of Somatic Mutations in Cancer (COSMIC). "Раковый геном" всесторонне изучает полученные большие данные, публикует программы (BioView, AutoCSA) для обнаружения мутаций в раке, занимается прогнозированием воздействия новейших онкопрепаратов для эффективного лечения и т.д.
То есть исследования "больших" данных напрямую влияет на всё: объем знаний о раке и опухолевых мутациях, диагностику, прогнозирование и лечение.

shadrap
30.05.2022 18:34Спасибо за статью, хорошая, правильно написанная.
Относительно рисков и использования "биг дата". Скажу , что в потребительском плане , увы , никак. Все успешные методики, работающие как рекомендации для лечения онкобольных, на сегодняшний день, относятся к области доказательной медицины. Те. перешли из экспериментальной по относительному количеству выживших. Успешно функционирующие антитела, то же , увы, создавались без "больших". Если именно о ранней диагностике, пока "вода на киселе" - нечего считать , если сам процесс еще не до конца понятен. В любом человеческом организме возникают сотни и тысячи мутаций и даже микро опухолей, но в здоровом организме они планомерно уничтожаются или блокируются имунной системой, а вот в больном остаются , захватывая все большие и большие пространства и в итоге перерождаются в злокачественные опухоли.Создание лекарств, конечно наверное самое широкое поле для биоинформатики.
Биоинформатика, пока, инструмент вме ж ресерч,а не клинической практики, но она должна стать таковым в будущем.
Goupil
31.05.2022 01:08+1Биоинформатика, пока, инструмент вме ж ресерч
Вы не правы, коллега. Биоинформатика активно применяется в клинике — от онкологии до диагностики генетических заболеваний. Та же CART терапия требует привлечения биоинформатики, и это уже не экспериментальное лечение. Уже давно есть прикладные биоинформатики, которые занимаются исключительно клиникой, а не наукой. Мне такие известны.
shadrap
31.05.2022 11:16Вы не представляете , как я буду рад , оказаться не правым ).
Буду так же рад услышать про успешное применение CAR T в России, не обязательно даже CAR T , а чего-то персонифицированного. Рогачева и Петрова в экспериментальном режиме работают над апробацией ТН T-CAR-19 , как у них сейчас дела ?
Только прошу сразу - давайте разделим медицинское, лечебное и информационно рекомендательное.
Я согласен, что в каждом совеременном секвенаторе есть элемент биоинформатики, но мы говорим все ж о лечении - то что исходит от доктора , как принимающей решение стороны и что немало важно , отвечающей за это решение.

Goupil
31.05.2022 15:51Я не про Россию говорю, а про весь мир, особенно про развитые страны. Секвенирование и анализ сиквенса пациентов с подозрением на наследственную патологию это конечно не совсем рутина, но близко к этому. Израильские врачи, даже просто gp, могут отправить пациента на это и не считают это что-то исключительным. И уже по результатам они смотря на терапевтические опции. Это то, что я сам наблюдал.
Про перспективы России говорить горько и неприятно, до меня информация долетает что у Рогачева и ко пока работают, так как они сами и что им нужно для работы не под санкциями, но перспективы туманны. Тут скоро с базовыми вещами в медицине будут проблемы, не до всякого биомед хайтека будет дело.

shadrap
31.05.2022 16:36+1Я согласен, Америка , Израиль более благополучно используют новые технологии, но врачи ли ? Я же еще раз обращаю ваше внимание , что мы говорим про среднего человека и среднего врача. Что делает сегодняшний врач когда (возьмем сначала Российский средний человек) приходит к нему с подозрением на онкологию - результаты в лабораторию , комиссия (из таких же как он) и дальше выбор метода лечения. В каком % случаев вот этот самый лечащий врач (а именно он теперь ответственнен за все действия с пациентом) использует генетеческий скриннинг , анализ на наследственную патологию , определяет MSi, MTB и прочие вещи ? Создает "портрет" опухоли? Я вам скажу - почти ни в каком - только когда вопрос упрется "в неизвестность". А что он делает в 99% случаев ?- правильно , смотрит рекомендации. Это же делают и 80-90% американских врачей, про Израиль не знаю , совсем.
Кто у нас делает генетический профиль опухоли? Я вам скажу - никто , кто за рубежом делает это по страховке - никто. Это все индивидуальные случаи. Почему ? - потому что прежде всего есть ответственность за пациента , есть наработанная база , что при аденокарциноме ободной кишки, например есть протокол ее лечения (что у нас, что в Америке- он почти один) - резекция , схема ПХТ , наблюдение. И только когда тут что-то идет не так , когда опухоль не пластична выбранной схеме лечения , тогда начинаются варианты.... тогда подключаются биоинформатики , химики , тогда заказываются глубокие профилирования , разбор работы имунной и тп..
Пока это не изменится...., будет много хайпа вокруг молекулярных подходов к лечению рака и мало дела.

Goupil
31.05.2022 17:30+1кто за рубежом делает это по страховке
Зависит от страховки. Вот частные страховки под это, которые покрывают генетическое тестирование при наличии наследственного риска. Вот обзор, правда 4-х летней давности. Вкратце - не все покрывается и не везде, но поддержка растет.
тогда подключаются биоинформатики , химики , тогда заказываются глубокие профилирования ,
Ваш изначальный тезис что биоинформатики не участвуют в диагностике и лечении. А тут получается участвуют, просто не в первом ряде. Это и понятно - методы относительно новые, чтобы врачи активно учитывали и применяли эти методы должно сменится их поколение и поколение их учителей.
будет много хайпа вокруг молекулярных подходов к лечению рака и мало дела.
Хайпа много, как и вокруг любой новой технологии, которая устаканивается. И уже видно "бутылочное горлышко" на стадии анализа данных - данные легко и не так дорогу получить, но тяжело интерпритировать. Это одна из причин почему я постепенно перехожу от мокрой лабы к анализу данных как своему роду деятельности.

shadrap
31.05.2022 17:57+1Я согласен, что каждый видит мир со своего "болота". Поэтому собственно и общаемся.
для меня 90% или 99% = все , а 1% или 5 % = отсутствует.
Информатика от жажды внедриться в здравку, готова считать "тонны", да но , как вы правильно говорите , бутылочное горло чуть-чуть не там , не в мощностях ЦПУ и объеме данных..
И это только топ "торта" - генетическое предсказание , увы , это всего лишь вероятность , а эпигенетика это реальность , которую мы пока только изучаем. Более того описательный процесс все время дополняется и изменяется ....

Goupil
31.05.2022 20:24+1Эпигенетика это пока темный лес, она то точно ещё не мейнстрим в практике. Посмотрим лет через 10-15. Уж я посильно буду приближать такое светлое будущее.


endpoints
Некоторые поэтому советуют голодать, чтобы победить раковые клетки до конца. Но не знаю, насколько этот способ действителен. Может есть кто, таким образом победил рак?
AlexZaharow
Если и говорить про голод, то уж лучше как о способе профилактики, а не о лечении. «Голодание» человека с лишением раковых клеток питания никак не связано. Во время голодания организм тратит свои запасы, которые раковые клетки потребляют не стесняясь. Вроде как поэтому некоторые больные раком люди выглядят худыми.
Barseadar Автор
Насчёт лечебного голодания ходят споры. Интересно, что многие врачи советуют выбирать план лечения так: идёте к первому врачу, второму, третьему (продолжаешь, пока хватает средств/терпения/времени); параллельно самостоятельно изучаешь вопрос на англоязычных авторитетных площадках; далее выбираешь из предложенных планов лечения (а они точно будут разными) тот, что считаешь правильным. Для врача нет пациента лучше, чем тот, кто сам интересуется болезнью. Так что какие-то врачи могут посоветовать лечебное голодание в конкретных случаях, но решение все равно принимать больному.
Loskechos
это бессмысленно, смерть от истощения никто не отменял