Организм человека — это удивительный механизм, способный в нужный момент заменить неисправную деталь на новую. Однако до мастерства регенерации саламандр нам еще очень далеко. Конечно, регенеративные способности нашего тела не так плохи, но они весьма ограничены и занимают долгое время. Вырастить себе новый палец, утерянный из-за неудачного использования пилы, тело не сможет, зато сможет затянуть рану, образованную на месте отсутствующего пальца. Но, будучи существами с неутолимым любопытством и рвением ответить на вопрос «а что если?», ученые со всего мира уже давно проводят исследования в области выращивания клеток, тканей и даже органов, которые могут быть использованы в трансплантологии. Некоторые из используемых методов выращивания органоидов весьма результативны, но очень сложны. Потому ученые из Токийского медико-стоматологического университета (Япония) решили разработать новую методику, благодаря которой можно получать органоиды желаемого размера с меньшими затратами сил и времени. В чем особенность нового метода, как он показал себя на практике, и какие перспективы его дальнейшего использования? Ответы на эти вопросы мы найдем в докладе ученых.
Основа исследования
Если попытаться категоризировать органы человека по сложности их структуры, то это может занять уйму времени, ведь любой орган человеческого тела можно с уверенностью назвать сложной системой, выполняющей множество функций одновременно. Ярким тому примером является система ЖКТ. К примеру, кишечный тракт представляет собой сложный орган с абсорбционными, секреторными и механическими свойствами. Воссоздать нечто подобное в лабораторных условиях является, так сказать, задачей со звездочкой.
Однако по мере развития исследований hPSC (от human pluripotent stem cells, т. е. плюрипотентные стволовые клетки* человека) и взрослых стволовых клеток* (ASC от adult stem cell) за последнее десятилетие было разработано несколько подходов к созданию кишечной ткани человека.
Плюрипотентные стволовые клетки* — потомки тотипотентных клеток и могут давать начало практически всем тканям и органам, за исключением экстраэмбриональных тканей (например, плаценты).Один из подходов заключается в создании первичных кишечных эпителиальных органоидов из кишечника человека. Эта технология позволяет культивировать стволовые клетки кишечного эпителия, полученные от донора-человека. Однако в органоидах, происходящих из ASC, отсутствуют мезенхимальные компоненты. Это указывает на то, что функционально сложные ткани кишечника не могут быть воспроизведены исключительно органоидами, происходящими из ASC.
Тотипотентные (омнипотентные) стволовые клетки могут дифференцироваться в клетки эмбриональных и экстраэмбриональных тканей, организованные в виде трёхмерных связанных структур (тканей, органов, систем органов, организма).
Взрослые стволовые клетки* — недифференцированные клетки, обнаруживаемые по всему телу после развития, которые размножаются путем клеточного деления, восполняя умирающие клетки и регенерируя поврежденные ткани.
Другим способом производства кишечной ткани человека in vitro (с лат. «в стекле», т. е. в пробирке / в лабораторных условиях) является получение ее из hPSC клеток. Это было достигнуто путем объединения методов дифференцировки hPSC с установленным методом культивирования органоидов эпителия кишечника.
Кишечные органоиды человека (HIO от human intestinal organoid) были дифференцированы от индуцированных плюрипотентных стволовых клеток человека (iPSC) через сфероиды задней кишки путем добавления нескольких факторов передачи сигнала. Данный метод обладает большим потенциалом, но и не лишен своих недостатков, к которым можно отнести использование ручного сбора свободно плавающих сфероидов задней кишки из монослойных культур iPSC. При этом для правильной дифференциации огромное значение имеют предварительное кондиционирование и клеточная плотность hPSCs. Из-за нюансов этого протокола сформированные сфероиды имеют разнообразную клеточную гетерогенность и потенциал дифференцировки в процессе индукции, что приводит к значительным изменениям в клеточном составе среди индуцированных HIO. Например, более мелкие свободно плавающие сфероиды, как правило, не могут в дальнейшем созревать в HIO. Кроме того, количество и размер генерируемых сфероидов сильно различаются между iPSC линиями.
Таким образом, разработка более простого и надежного протокола для получения гомогенных сфероидов и зрелых HIO является пока нерешенной задачей.
В рассматриваемом нами сегодня труде ученые предложили решение этой проблемы в виде нового метода дифференцировки iPSC суспензии в кишечные сфероиды, а также продемонстрировали оптимизированный протокол культивирования для роста и созревания свободно плавающих HIO.
Результаты исследования
Первым делом, чтобы индуцировать сфероиды в суспензии, ученые использовали уже известные условия индукции сфероидов, которые были модифицированы под условия суспензионной культуры (1А).

Изображение №1
Были использованы сфероидообразующие планшеты EZSPHERE/EZ-BindShut, которые имеют множество микролунок, покрытых полимером со сверхнизкой адгезией (ULA от ultra-low attachment). Чтобы адаптировать классические условия к индукции суспензии, клетки задней кишки диссоциировали на отдельные клетки и высевали на эти планшеты в течение 6 дней. Засеянные клетки культивировались в течение 24 часов, быстро сливаясь и образуя сфероиды одинакового размера в микролунках планшетов (1В; видео №1 и №2).
Видео №1
Видео №2
Этот метод агрегации оказался одинаково эффективным при использовании клеток задней кишки, дифференцированных из нескольких линий iPSC, что подтверждает надежность исследуемого протокола.
В отличие от традиционных сфероидов (t-сфероидов), которые представляют собой отдельные фрагменты индуцированных клеток, данный метод продуцировал сферические агрегаты, которые ученые назвали суспензионными сфероидами (s-сфероиды) (1C).
Чтобы подтвердить, что s-сфероиды были индуцированы в кишечные сфероиды, экспрессию CDX2 (маркер задней кишки) исследовали с помощью количественной ПЦР с обратной транскрипцией (qRT-PCR). Экспрессия CDX2 у s-сфероидов существенно не отличалась от таковой у t-сфероидов в двух независимых линиях iPSC. Это свидетельствует о том, что s-сфероиды сохраняют направленную дифференцировку в сторону кишечных клонов.
Затем было проведено иммуноокрашивание всего препарата, чтобы подтвердить его экспрессию и распределение клеток. Индуцированные сфероиды экспрессировали CDX2 и E-кадгерин, но не маркер передней кишки SOX2, что подтверждает их дифференцировку в сфероиды задней кишки.
При этом s-сфероиды показали более однородную картину экспрессии CDX2 во всех сфероидах по сравнению с t-сфероидами (1D). Это позволяет предположить, что метод индукции s-сфероидов привел к более однородной клеточной популяции.
Чтобы подтвердить, что s-сфероиды и t-сфероиды имеют сходство в транскрипции, был проведен анализ экспрессии генов во время генерации сфероидов. Как и ожидалось, оба сгенерированных сфероида показали значительное сходство (r = 0.986). Следовательно, уровень индукции, а также полученные сфероиды согласуются в обоих условиях (1E).
Кроме того, чтобы проверить разницу между линиями iPSC, было проведено сравнение экспрессии генов между двумя независимыми клонами в обоих методах индукции. В соответствии с данными уровни экспрессии генов были почти одинаковыми (r = 0.973) между двумя клонами при индукции s-сфероидов, но при использовании метода индукции t-сфероидов наблюдались большие различия в экспрессии генов (r = 0.949) (1F).
В совокупности эти данные свидетельствуют о том, что исследуемый метод индукции суспензионных кишечных сфероидов имеет более надежный процесс дифференцировки независимо от склонности клеточной линии к дифференцировке.

Изображение №2
Поскольку было подтверждено, что диссоциированные клетки объединяются с образованием плавающих сфероидов, ученые также попытались спроектировать размер сфероидов, выбрав размер микролунки. С этой целью диссоциированные индуцированные клетки высевали на три варианта специально разработанных планшетов EZSPHERE SP (диаметр микролунки: 300, 500 и 1400 мкм) и 96-луночный планшет EZ-BindShut (диаметр: 6500 мкм). Как и ожидалось, на размер сформированного сфероида влиял диаметр микролунки (2А).
В то время как размер t-сфероидов варьировался от 50 до 300 мкм, отражая случайный захват, все три варианта планшетов EZSPHERE давали s-сфероиды одинакового размера, как правило, в пределах 100 мкм в диаметре (2B).
Затем ученые попытались расширить этот метод, дабы спроектировать диаметр сфероидов, варьируя количество засеянных клеток на 96-луночном планшете EZ-BindShut. Наблюдалась четкая корреляция между количеством засеянных клеток и диаметром полученных сфероидов (2С; видео №3).
Видео №3
Этот результат предполагает, что размер сфероидов можно контролировать, выясняя корреляцию между количеством засеянных клеток и диаметром сформированных сфероидов.
Чтобы оценить точный размер сформированных сфероидов, был использован высокоточный сканер для светлого поля Cell3 iMager duos. Диаметр сфероидов соответствовал полулогарифмической зависимости от числа засеянных клеток (2D). Различные размеры сфероидов слабо влияли на траекторию дифференцировки, о чем свидетельствуют сопоставимые экспрессии CDX2. Однако, когда число засеянных клеток превысило 4 х 105, они агрегировали в двояковогнутую дискообразную структуру, а не в сферу. Потому в дальнейшем было решено использовать не более 1 х 105 клеток.
Для культивирования сгенерированных сфероидов был разработан метод суспензионной культуры, чтобы преодолеть пространственные ограничения, присущие обычному методу с применением Matrigel. С этой целью в среду добавляли Matrigel — ключевой внеклеточный матрикс для обычной культуры t-сфероидов. Затем изучалась оптимальная концентрация для s-сфероидов (0%, 3%, 5%, 10%, 20% и 100%). Как и ожидалось, образовавшиеся сфероиды не могли поддерживаться в среде без Matrigel.
Культивируемые сфероиды показали более тонкие кистозные черты в среде Matrigel 3–5%, а при более 10% сфероиды показали обширные зарождающиеся органоидные структуры, окруженные мезенхимой. Из сравниваемых концентраций именно 10% Matrigel обеспечил наилучшие результаты для работы с s-сфероидами.
Затем была исследована оптимальная комбинация факторов роста для суспензионной культуры.
Во-первых, была использована ранее описанная среда для роста кишечника (ENR от intestine growth medium), состоящая из эпидермального фактора роста (EGF от epidermal growth factor), Noggin и R-spondin1, для трехмерного созревания сфероидов. Однако эта среда оказалась непригодной для поддержания плавающих сфероидов в течение длительного времени.
Используя наработки своих коллег и изучив различные культуральные факторы, ученые подтвердили, что добавление A83-01, ингибитора рецептора трансформирующего фактора роста b (TGF-b) или комбинации инсулиноподобного фактора роста 1 (IGF-1) и фактор роста фибробластов 2 (FGF-2) приводили к усилению роста (2E и 2F). Соответственно, qRT-PCR анализ показал, что экспрессия CDX2 и PDX1 (проксимальных маркеров тонкой кишки) увеличивалась при добавлении A83-01 (E(N)RA) или IGF-1/FGF-2 (E(N)RIFA) к среде культивирования.
Что касается SOX2, маркера энтодермы передней кишки, среда E(N)RA привела к минимизации экспрессии в исследованных условиях (2G). В соответствии с тенденцией, наблюдаемой в экспрессии РНК, сфероиды, обработанные E(N)RIFA, показали рассеянную экспрессию SOX2 при иммуноокрашивании цельного препарата, в отличие от сфероидов с E(N)RA, которые не показали экспрессии SOX2 (2H).
В результате был сделан вывод, что добавление A83-01 может увеличить размер s-сфероидов при сохранении направленной дифференцировки в сторону типов клеток тонкого кишечника.

Изображение №3
Выше был описан процесс создания оптимизированного протокола индукции и продемонстрирована возможность контролировать размер сфероида. Однако поддержание более крупных сфероидов во взвешенном состоянии оказалось довольно сложной задачей из-за диффузионных ограничений биоактивных молекул, питательных веществ и газообмена.
Потому было решено попытаться культивировать s-сфероиды во вращающемся биореакторе, а результат сравнить со статической суспензией (3А).
В первую очередь были созданы сфероиды из засеянных индуцированных клеток с последующим их переносом в ULA чаши для культивирования в течение 3 дней, чтобы закрепить направленную дифференцировку. Затем сфероиды переносили в биореакторную систему культивирования клеток (CELLFLOAT CellPet 3D-iPS) и культивировали во вращающемся состоянии (3В). В этом биореакторе постоянное вращение цилиндрического сосуда, наполненного культуральной средой, создает поток внутри сосуда, позволяя сфероидам постоянно плавать на поверхности. Сфероиды в статической суспензии постепенно повреждались, а скорость роста снижалась на более поздних фазах культивирования. Напротив, сфероиды в биореакторе показали резкий рост во время культивирования (3C).
Чтобы оценить точную скорость роста культивируемых сфероидов, была проведена количественная оценка размера и количества сфероидов. В соответствии с наблюдениями, s-Spheroids в биореакторе росли без остановки в течение 4 недель. При помещении в биореактор сфероиды образовывали эпителиальные структуры, окруженные мезенхимоподобными традиционными HIO (t-HIO), и поэтому были названы культивируемыми в суспензии HIO (s-HIO).
Сравнение сфероидов, культивируемых в биореакторе, со сфероидами в статической суспензионной культуре показал, что диаметр первых постепенно увеличивался после сжатия в первые несколько дней. Сфероиды во вращающейся суспензионной культуре росли ускоренными темпами, значительно превосходя по размеру сфероиды, выращенные в статической суспензии (3D).
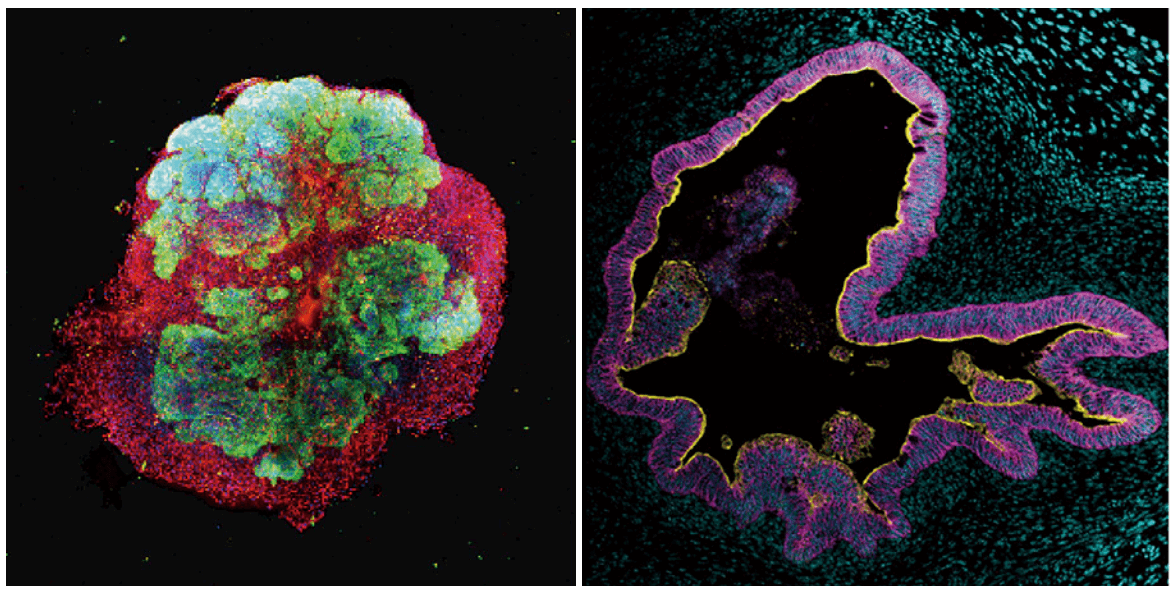
Чтобы подтвердить, обладают ли «вращающиеся» органоиды (созданные в биореакторе) теми же свойствами, что и t-HIO, был проведен анализ тканей с помощью иммуногистохимии. Анализ показал, что s-HIO состоят из CDX2/E-кадгерин эпителиальных клеток кишечника, окруженных виментин-позитивным мезенхимальным слоем (3E и 3F). Это также было подтверждено анализом экспрессии мРНК культивируемых органоидов (3G).
Тот факт, что s-HIO были окружены мезенхимой, экспрессирующей виментин (VIM), предполагает, что условия вращательного плавания подходят для созревания HIO в той же степени, что и t-HIO в трехмерном культивировании. Ученые также отмечают, что FOXF1 (маркер мезодермы), который совместно развивается и взаимодействует с дефинитивной энтодермой в передней кишке плода, сильно экспрессируется в s-HIO. Это указывает на то, что скоординированное развитие предшественников энтодермы и мезодермы происходит в культивируемых s-HIO.
В совокупности вышеописанные результаты показывают, что ротационная суспензионная культура с использованием биореактора позволяет выращивать большие s-HIO, что более полезно в качестве основы для трансляционной медицины по сравнению с обычными методами культивирования HIO.

Изображение №4
Далее ученые решили подтвердить дальнейшее созревание s-HIO путем трансплантации in vivo (с лат. «в живом») мышам с иммунодефицитом без диабета и тяжелым комбинированным иммунодефицитом (NOD/SCID) гамма-цепи рецептора интерлейкина-2 (IL2Rg) (NSG).
Недавнее исследование показало, что брыжейка* мыши является более физиологически и анатомически подходящим местом приживления для трансплантации HIO, чем подкожная область или капсула почки.
Брыжейка* — орган пищеварительной системы человека и животных, посредством которого полые органы брюшной полости прикреплены к задней стенке живота.Чтобы определить, какой участок был оптимальным для созревания больших s-HIO, ученые выполнили трансплантацию брыжеечных и подкожных органоидов и позволили привитым HIO созревать in vivo в течение 4 недель. Во время сбора привитые HIOs увеличивались в размерах с окружающей мезенхимальной структурой в обоих местах прививки (4A). Мезентериальные трансплантаты вырастали в два раза больше по диаметру, чем подкожные. Это подтвердило, что брыжейка является более оптимальным местом для трансплантации больших s-HIO.
Гистологический анализ пересаженных в брыжейку s-HIO подтвердил, что E-кадгерин-положительный слой одиночных эпителиальных клеток кишечника был построен в трансплантированных органоидах, часть которых сформировала криптоподобные* инвагинированные структуры, напоминающие зрелую кишечную ткань. Эпителиальная структура кишечника была окружена мезенхимальным слоем и слоями гладкой мускулатуры (4В и 4С).
Кишечные крипты* — трубчатые углубления эпителия слизистой оболочки кишечника, расположенные в собственной пластинке слизистой оболочки.Дальнейшие анализы иммунного окрашивания слоя эпителиальных клеток кишечника показали присутствие всех клонов эпителиальных клеток тонкого кишечника, что подтвердило рекапитуляцию* функциональной ткани кишечника (4D-4I).
Рекапитуляция* — повторение эволюционного или другого процесса во время развития или роста.Также было обнаружено, что клетки, меченные мРНК LGR5, присутствовали в привитых HIO и локализовались в эпителиальных клетках у основания криптоподобных структур в приживлении (4J).
Эти данные демонстрируют, что большие s-HIO, культивируемые во вращающемся биореакторе, могут дифференцироваться в зрелую кишечную ткань при трансплантации.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые продемонстрировали новый метод выращивания органоидов, которые являются сферическими скоплениями клеток того или иного происхождения и назначения. Органоиды используются для изучения функций органов в лабораторных условиях, а также являются многообещающими инструментами в области регенеративной медицины.
В качестве подопытного были выбраны HIO, т. е. кишечные органоиды человека, которых в классическом методе выращивали из индуцированных плюрипотентных стволовых клеток (iPSC). Проблема в том, что данный метод очень сложен, а результирующие органоиды получаются разных размеров и ограничены условиями роста, что со временем может привести к деформированным и нездоровым сфероидам.
Новый же метод позволяет выращивать органоиды контролируемого размера, а также модифицировать их, меняя количество засеянных клеток. Потом ученые перенесли сфероиды в биореактор, благодаря чему были получены сфероиды еще большего размера.
Все выращенные органоиды были окружены мезенхимой — типом ткани, находящейся между органами в организме человека. А после трансплантации их мышам они продолжали расти и дифференцироваться, развивая сложную тканевую архитектуру, отражающую структуру зрелого кишечника.
Авторы методики считают, что их разработка может быть успешно адаптирована и для выращивания органоидов более сложных тканей, таких как кишечноподобная ткань, содержащая кровеносные сосуды или нервы. Вполне очевидно, что такого рода исследования играют важнейшую роль в области регенеративной медицине и могут продвинуть ее возможности на годы вперед. Лечение какого-либо органа или тканей является важной задачей, но порой она просто невыполнима. В таком случае было бы отлично заменить ее на новую, выращенную в лаборатории, лишенную каких-либо изъянов. К тому же, данный труд, как и подобные ему, является фундаментальным для понимания того, как успешно вырастить не только органоиды, но и полноценные органы, что может радикально изменить трансплантологию и значительно снизить смертность ввиду нехватки доноров.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?


vassabi
ого!
этак и до транспланталогии поджелудочной дотянутся!