Три агрегатных состояния вещества, которые мы изучали на физике в школе, мягко говоря не отражают реальное многообразие возможных состояний материи в природе. Мы уже обсуждали такие штуки, как плазма или аморфное состояние. Говорили про невероятный конденсат Бозе‑Эйнштейна. Но на этом список не кончается!

Есть и ещё одно (или как минимум одно) очень интересное состояние вещества, которое называется сверхкритическая жидкость. Этого состояния не получится достичь простым кипячением воды в чайнике или прочими сподручными простыми методами.
Сверхкритическая жидкость может существовать только при высоких давлениях и высоких температурах.
Термин «критическая» выбран не случайно. Тут нужно вспомнить диаграммы фазового равновесия. Там, как это водится, обозначены все возможные фазы и всегда есть точка, которая называется критической. Выше этой точки и будет наблюдаться сверхкритическая жидкость. В самой точке пропадает различие между фазой жидкости и фазой газа.
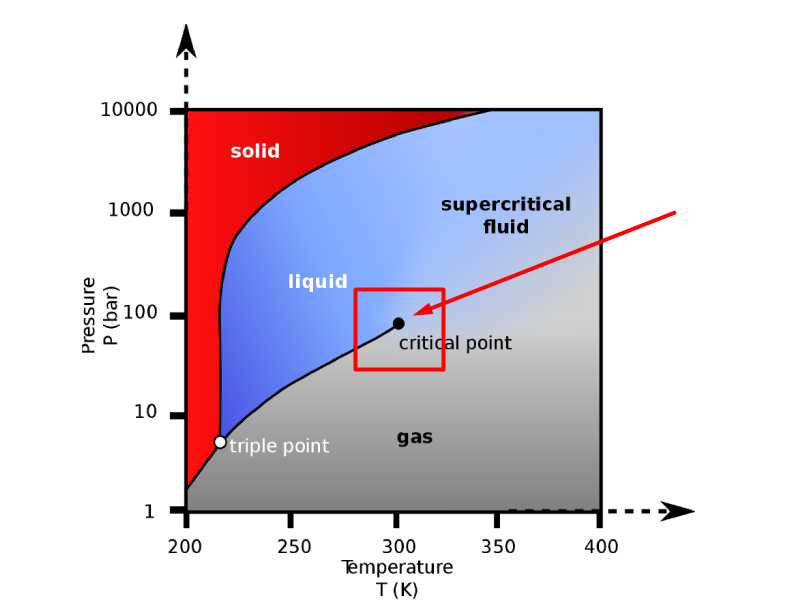
Представьте себе обычную жидкость (пусть это будет вода), которая находится в некотором герметичном сосуде. Над поверхностью этой жидкости будет находиться воздух и некоторое количество водяного пара.
Если полностью откачать воздух над поверхностью воды, то в сосуде останется только жидкость и вакуум над ней. Очевидно, что некоторая часть имеющейся воды начнет парить и над поверхностью будет ещё и водяной пар. Рассматриваемая система будет состоять из пара от воды (без примесей воздуха) и жидкой воды.
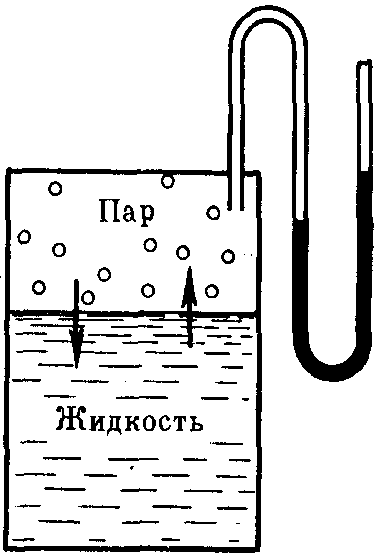
При нагревании системы будет увеличиваться количество воды в парообразном состоянии, а вода в жидком состоянии расширится. Давление в ёмкости начнёт расти. При дальнейшем нагревании мы будем наблюдать ещё больший рост количества и объема газа и ещё большее увеличение объема воды с уменьшением её количества (переходом в газ). Плотность воды будет падать, а плотность газа над водой расти.
В какой‑то момент будет установлено равновесие между водой и паром над ней. Плотность воды станет равной плотности пара над ней, а структура будет одинаковой и равномерной.
Это и будет сверхкритическая жидкость.
Сверхкритической является жидкость, у которой «стёрто» различие между жидким агрегатным состоянием и газообразным агрегатным состоянием. Она имеет среднюю плотность для всей системы, а частицы располагаются таким образом, что эта конструкция имеет общие черты и с газом, и с жидкостью. Также это состояние называется «сверхкритический флюид».
Сверхкритическая жидкость — это уже не жидкость, но ещё и не газ.
На практике и без сосуда из примера, такое состояние может быть достигнуто только при соответствующем конкретному веществу давлении и температуре. Как правило, это очень высокие температуры и давления. При этом давление должно быть ниже, чем необходимо для перехода вещества в твёрдое агрегатное состояние.
Это состояние имеет множество практических прикладных применений. Встретить в природе такое состояние вещества можно, например, на других планетах, где сочетаний условий позволило превратить атмосферу в такое состояние.
На практике такая специфическая конструкция позволяет получать весьма специфические свойства. В итоге жидкость в сверхкритическом состоянии используется, например, в химчистках, так как обладает отличной активностью и легко разрушает пятна. В лабораторных экспериментах такое состояние тоже интересно. Например, так можно «выпаривать» наночастицы и получать наноматериалы. При переходе к граничному состоянию, имеющиеся прочные включения начинают переходить в нано диапазон и их можно потом экстрагировать.
Традиционно приглашаю всех подписаться на Telegram‑канал моего проекта, где ещё больше научно‑популярных материалов.
Комментарии (10)

U235a
09.01.2024 14:53+5Если взять толстостенный стальной сосуд и заполнить его водой на 90%, допустим. После чего, закрыть и нагреть, то будет происходить следующее: в начале система двухфазная: жидкость-пар. Объем жидкой фазы будет увеличиваться, паровой - уменьшаться. В какой-то момент жидкая фаза заполнит весь автоклав (плотность 0.9, т.к. коэфициент заполнения 90%), после чего давление будет (очень резко и, примерно, линейно) увеличиваться при увеличении температуры. Т.е. до критической температуры будет просто жидкая фаза. Если коэффициет заполненения будет маленький, то произойдет переход в паровую фазу. И только при коэффициенте заполнения равному критической плотности и жидкая и паровая фаза будут находится в автоклаве до самой критической точки. Как-то так. По практическому применению:
Экстракция углекислотой ароматических и лекарственных веществ из растительного сырья.
Гидротермальный синтез минералов. Так получают синтетические кристаллы кварца, изумрудов и некоторые другие кристалллы.

frozzzen
09.01.2024 14:53+2Например, есть такой чудесный фокус, как экстракция кофеина из кофейного зерна. Экстракция никотина из табачной ботвы. Извлечение ароматических масел из растений мариванны. Всё это происходит с помощью СО2 в сверхкритическом состоянии. Давление около 80 Бар, температура 35С, или около того. Ничего "высокотехнологичного". Почти стандартные изделия из пищевой нержавейки. Китайцы делают такие аппараты тысячами и отгружают пароходами. Собственно, гаражный бизнес БАДов и аромамасел вращается вокруг этих нехитрых изделий.

Dynasaur
09.01.2024 14:53+1Тема не раскрыта. Какие вещества при каких условиях переходят в эту фазу? На каких таких других планетах какие вещества находятся в этом состоянии? Что конкретно в химчистках переходит в это состояние, что за оборудование используется?

ABRogov
09.01.2024 14:53+3Очередная подборка безграмотных перлов от узмети.
Сверхкритическая жидкость может существовать только при высоких давлениях и высоких температурах.
Как на счет кислорода? Просто как пример.

Tzimie
09.01.2024 14:53Встретить в природе такое состояние вещества можно, например, на других планетах, где сочетаний условий позволило превратить атмосферу в такое состояние.
А ещё можно встретить на нашей планете) потому что воздух - сверхкритическая жидкость)


Lainhard
Так и хочется после прочтения статьи сказать "И?"
Возьму и скажу.
- И что?
Ах да, телеграм ссылка - вот что. Я недоволен.
unclegluk
Прошел по ссылке, ответа на ваш вопрос там нет.