
Привет, Хабр! Сегодня предлагаем отправиться в увлекательное путешествие в самое сердце человеческого организма (в буквальном смысле этого слова), чтобы узнать как находят и обезвреживают источники аритмии.
Физиология
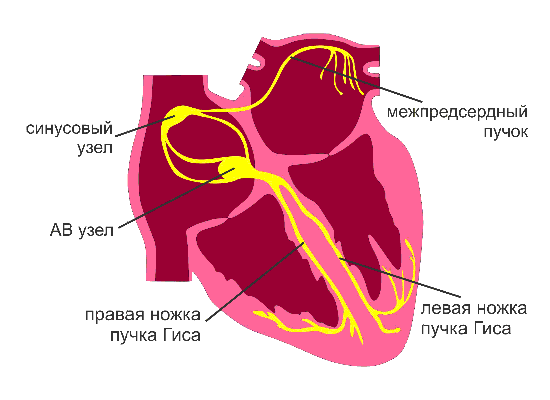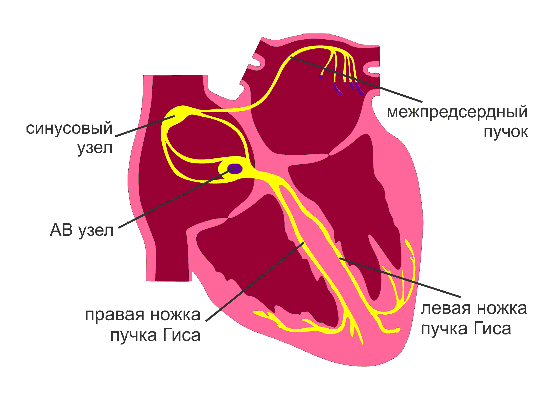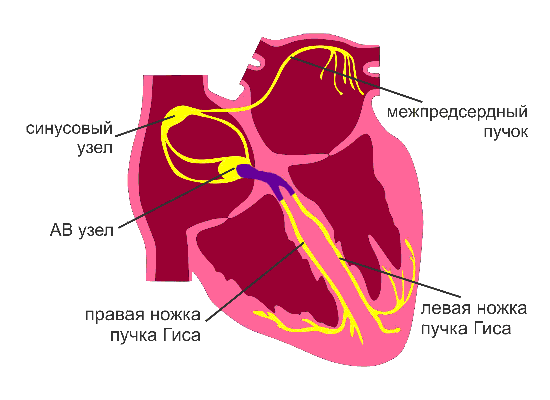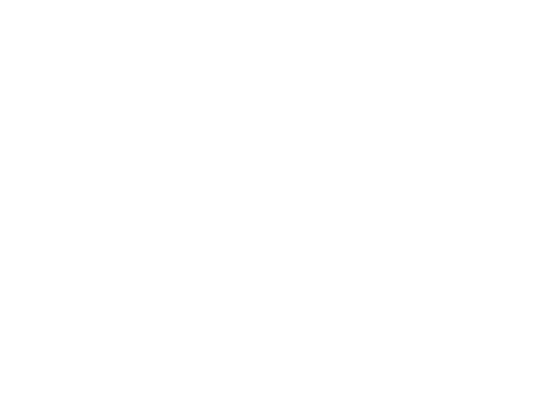
Перед тем как рассказать о самой операции и методах её проведения нужно разобраться в физиологии. Сердце обладает функцией автоматизма, т.е. способно вырабатывать электрические импульсы самостоятельно. Функцией автоматизма обладают только клетки синусового узла и проводящей системы предсердий и желудочков. Также сердце обладает функцией проводимости — это способность к проведению возбуждения. За счёт генерации электрических импульсов и их проведения происходит сокращение сердца. В норме единственным водителем ритма является синусовый узел, который подавляет автоматическую активность остальных возбудителей ритма. Расположен этот узел в стенке правого предсердия. Ниже, на рисунке, показано нормальное распространение возбуждения.
Приступаем к операции
По различным причинам, некоторые клетки сердца могут навязывать свой ритм. При этом происходит нарушение частоты, последовательности возбуждения и сокращения сердца. Это один из видов аритмии. Результатом может быть целый ряд серьезных осложнений. Однако, клетки нарушители можно обезвредить с помощью, так называемой, катетерной абляции. Это малоинвазивное вмешательство, в ходе которого в полость сердца вводятся специальные катетеры.
Используемые катетеры это тонкие гибкие трубки с несколькими электродами (полюсами) на конце. Полюса способны как проводить импульсы в сердце, так и от него. Катетеры различаются по форме и количеству полюсов.
Введение катетеров может осуществляться в паховой области, на руке, плече или шее. Место зависит от того какой отдел сердца планируется оперировать. Для проведения операции достаточно местной анестезии. На коже делается небольшой разрез и иглой производится пункция кровеносного сосуда. Затем вводиться один или несколько катетеров в сделанный разрез. Катетеры проводят по кровеносным сосудам в требуемою камеру сердца.
Существуют виды аритмии когда кардиолог может еще до операции определить местоположение проблемных зон. Но это возможно далеко не всегда. В таких случаях операции являются технически сложными и занимают много времени. Без специального обеспечения большую часть времени врачу приходиться действовать «вслепую». Обычно для навигации врачи используют рентгенологическое оборудование. Но такой подход позволяет видеть только плоскую картинку и не дает понимания пространственного положения катетера. Кроме того, пациент и персонал подвергаются лучевой нагрузке.
Рассмотрим как с помощью современных технологий можно упростить задачу и найти нежелательный источник. В качестве примера возьмем один из видов аритмии — желудочковую экстрасистолию.
Определение положения
Начнем с навигации. Существуют варианты позволяющие программно вычислять положения катетеров. Остановимся здесь на методе основанном на измерении разности потенциалов между электродами. Главное преимущество этого подхода в том, что можно использовать стандартные катетеры.
Для обеспечения наибольшей точности необходимо как минимум два катетера. У первого катетера выбирается опорный полюс, относительно которого будут выполняться все вычисления. Было установлено, что такой полюс удобней располагать в коронарном синусе (кровеносный сосуд впадающий в правое предсердие). Во-первых, эта точка наименее подвижна во время работы сердца, что позволяет минимизировать ошибки навигации. Во-вторых, из этой точки можно уловить импульс из любого отдела сердца, что будет важно при построении карты. На протяжении всей операции положение опорного полюса не должно меняться. Второй катетер называется картирующий. Именно этот катетер будет перемещаться в полости сердца и использоваться для нахождения нарушителей ритма. Для определения его положения относительно опорного на поверхности тела пациента устанавливают три пары электродов. Электроды из одной пары располагают с разных сторон тела, а пары взаимно ортогонально (грудь — спина, левый — правый бок, шея — бедро). Между электродами одной пары пускают переменный ток. Чтобы избежать наложения частот для каждой пары устанавливается своя частота.

На протяжении всей операции вычисляется разность потенциалов между полюсами картирующего катетера и опорного. Причем мы получаем разность потенциалов по трем ортогональным осям. В сердце изменение потенциала линейно зависит от расстояния катетера от источников тока. Это позволяет, умножая вольты на определенный коэффициент, перейти к определению координат в миллиметрах. Таким образом, без какой либо магии, можно определить взаимное положение обычных электродов. На изображении серый это картирующий катетер, желтый — опорный.
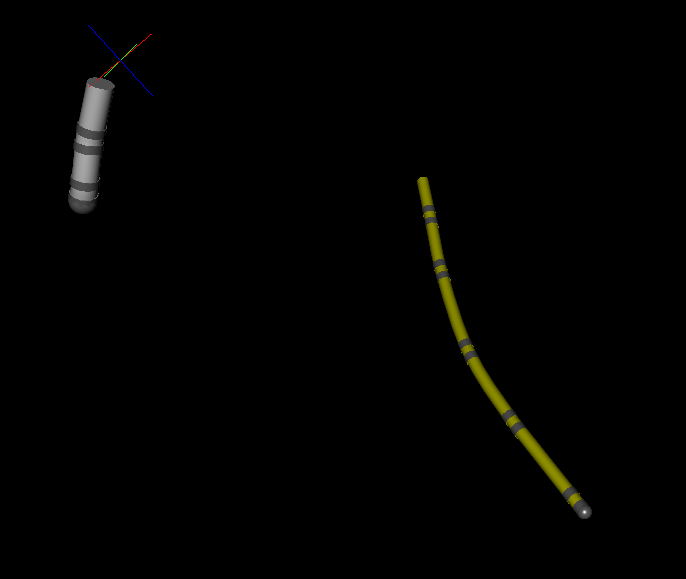
Построение модели сердца
Пока перемещение катетера относительно опроной точки для хирурга не несет важной информации. Но благодаря этому стало возможным построить 3D-модель сердца. Перед построением сетки поверхности в программе задается область реконструкции. Эта та область, в пределах которой находится оперируемый отдел сердца. Для этого нужно расположить картирующий катетер в центре сердечного отдела. Также необходимо указать размер области реконструкции. Обычно радиуса равного 10 см хватает для картирования. Далее полученный куб разбивается на воксели с заданным размером. Воксель — это элемент объёмного изображения, своего рода трехмерный аналог пикселя. Каждый воксель может содержать определенное значение. В нашем случае в качестве значения будут использоваться 0 и 1. Значение 0 говорит о том, что воксель находится за пределами отдела сердца. 1 — значение установлено, воксель внутри модели. Изначально все воксели не установлены.
После того, как начальные данные указаны, можно начинать построение модели сердца. При перемещении катетера сравниваются его координаты с координатами вокселя. Если координаты вокселя совпадают с координатами катетера, то этому вокселю устанавливается значение 1. В ходе построения модели врач поэтапно подводит катетер к стенкам сердца. Таким образом постепенно строится воксельная модель всей полости оперируемого отдела.
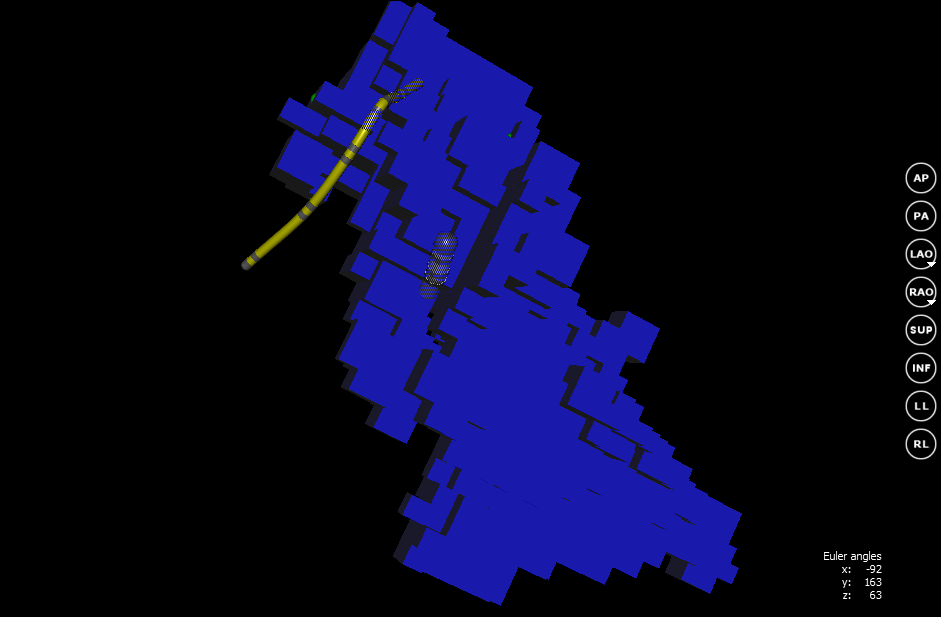
Нас в первую очередь интересует внутренняя поверхность. Для этого, на основе воксельной модели, строится сетка с помощью алгоритма Marching cubes. Суть этого алгоритма заключается в том, что для каждого вокселя, на основании его соседних, задается определенная часть поверхности. Результатом будет замкнутая поверхность «покрывающая» воксельную модель.
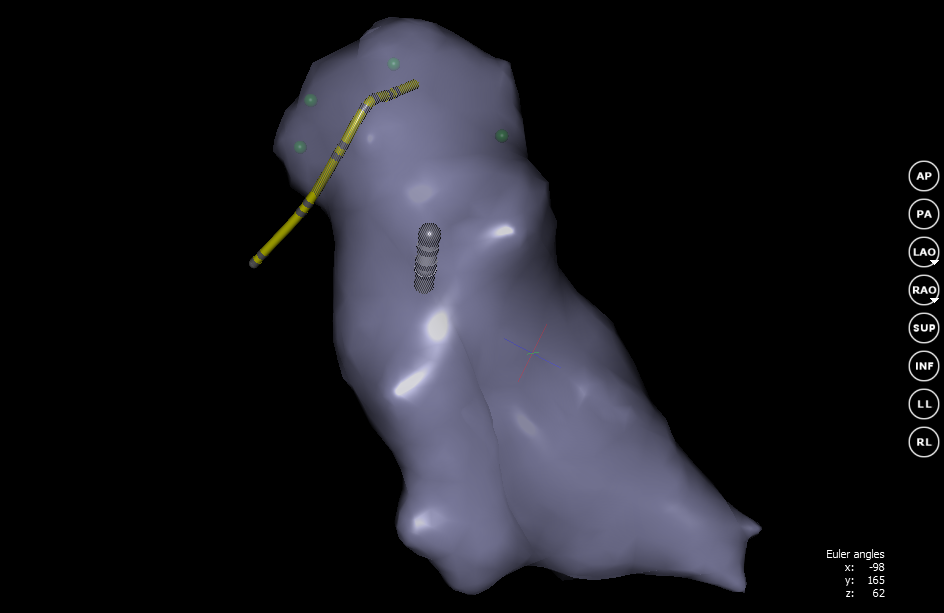
Перестроение сетки происходит постоянно в процессе изменения воксельной модели. На экране сразу отображается поверхность без воксельной модели. Когда сетка полностью готова режим создания 3D-модели выключается. Дальнейшие изменения положения катетеров не влияют на геометрию сетки.
В нашем случае для лучшего соответствия реальной картине можно вырезать часть сетки, тем самым обозначив клапан правого предсердия.
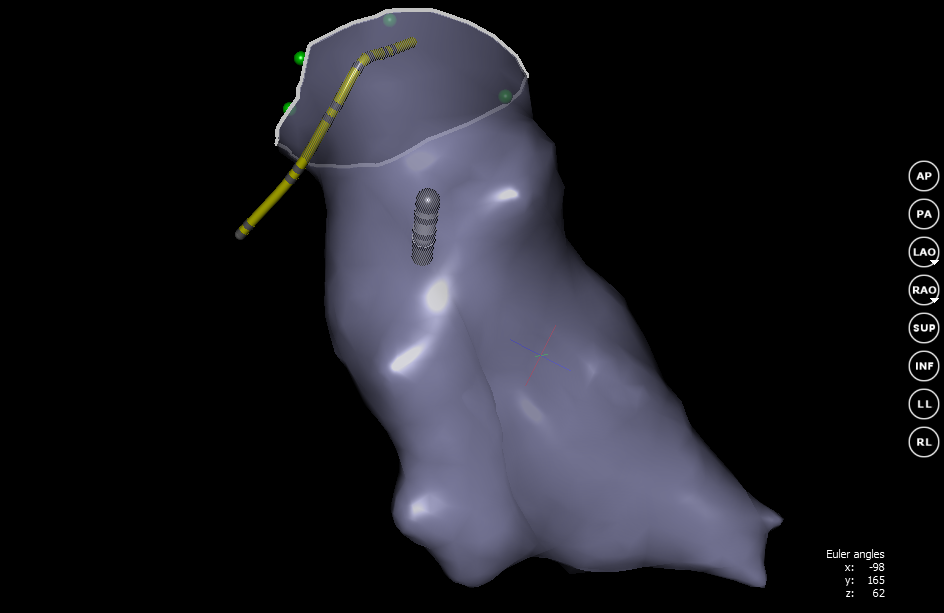
В итоге получается внутренняя поверхность нужного отдела. Теперь врач видит перемещение катетера относительно стенок сердца. Благодаря этому управлять катетером становиться гораздо проще и можно приступить к поиску нарушителей ритма.
Построение карты
Следующим этапом идет изучение распространения возбуждения по миокарду. Стоит заметить, что во время всей операции с подключенных катетеров и стандартных отведений записываются ЭКГ в одной временной шкале.
Исследование выглядит следующим образом. Врач подводит картирующий катетер к стенке сердца и снимает данные. Один из основных показателей это время активации (возбуждения) в этой точке. Определить момент возбуждения можно по электрокардиограмме от полюса картирующего катетера. Во время активации на ЭКГ будет зубец. Момент активации на графике может устанавливаться либо врачом вручную, либо определяться в автоматическом режиме.
Дальше вычисляется время запаздывания. Это разница по времени между активацией в исследуемой точке с активацией зафиксированной на одном из отведений. В качестве таких отведений могут выступать или полюса опорного катетера или нагрудные отведения. В нашем случае будем использовать стандартное отведение III. Таким образом мы сравниваем момент возбуждения в конкретной точке со средним значением возбуждения во всем сердце. На приведенном примере ниже красной точкой отмечен момент активации с отведения III, зеленой с картирующего катетера.

Кардиолог может по своему усмотрению решать какие полученные данные следует учитывать, а какие нет. Разберемся почему это важно. Для рассматриваемого типа аритмии источники нежелательного возбуждения проявляются себя с некоторым интервалом (часто непостоянным). В промежутках между внеочередным сокращением сердца импульс возбуждения распространяется обычным образом, а ЭКГ со стандартных отведений имеет нормальный вид. Распространение нормального возбуждения хорошо изучено и не представляет интереса во время операции. Врача интересует распространение возбуждения от нарушителя ритма. Определить возникновение нежелательного импульса (экстрасистолы) можно по ЭКГ со стандартных отведений. ЭКГ в этот момент имеет отклонение от нормального вида. Это то время, когда стоит брать показания с поверхности сердца.
Иногда экстрасистолы появляются слишком редко во время операции. В таких случаях хирург может искусственным образом провоцировать аритмию с помощью электрических импульсов передаваемых с катетера. Под контролем специалистов в операционной такая стимуляция достаточно безопасна.
Если получены интересующие данные, то врач фиксирует результаты и они сохраняются. На 3D-модели сердца устанавливается точка в месте где был расположен катетер. Теперь можно приступить к изучению новой точки. Так, поочередно перемещая катетер от одной точки к другой, берутся показания с внутренней поверхности картируемого отдела. В целом требуется от нескольких десятков до сотен точек в сложных случаях. На основании времени запаздывания с помощью интерполяции строится изохронная карта активации миокарда.
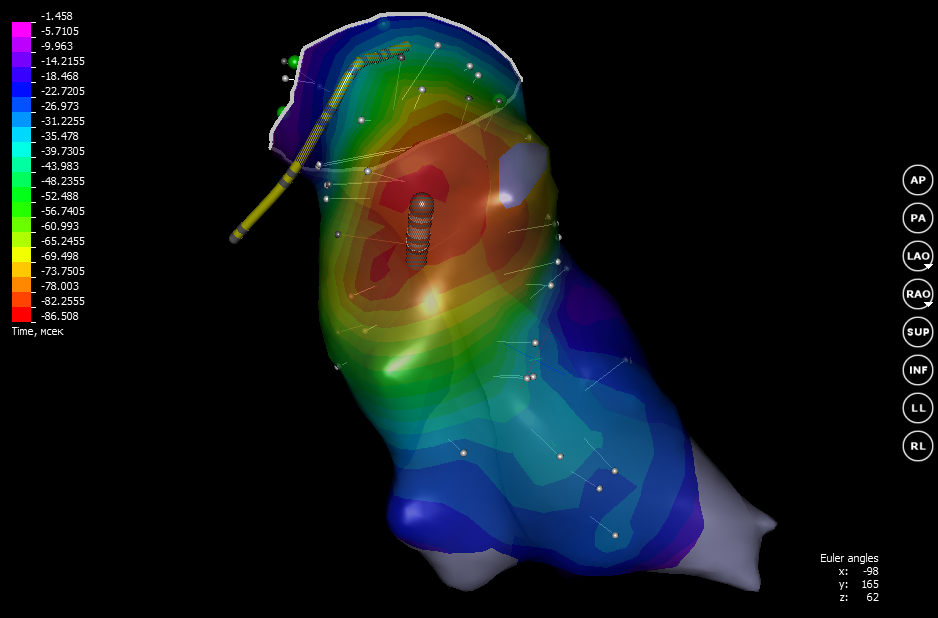
На такой карте цветом обозначается время активации. Возбуждение распространяется от красного к фиолетовому. Изохронную карту можно отобразить несколько в ином виде: показывать картину не в целом, а отобразить распространение возбуждения только в определенный момент времени. Такая карта называется активационной.
Устранение нежелательного источника
На построенных таким образом картах хорошо видно распространение возбуждения по миокарду и, что самое важное, сами источники возбуждения. В итоге врач точно знает где необходимо воздействовать для устранения аритмии. Сам процесс обезвреживания аритмогенных зон выглядит следующим образом:
- Полагаясь на построенную карту врач прижимает полюс катетера к точке на сердце, которая генерирует нежелательные импульсы
- Через катетер подается высокочастотный ток. Электрическая энергия преобразуется в тепловую. За счет высокой проводимости полюса, нагревается не сам полюс, а ткань окружающая этот электрод. Нагрев доводят до 45 градусов по Цельсию. В итоге небольшой участок сердечной ткани, в котором проходит патологический путь, разрушается. Важно: катетер, с помощью которого производится операция, должен обладать термодатчиками. Это связано с тем, что нужно постоянно контролировать нагрев, т. к. при более высоких температурах возможно нанести серьезное повреждение клеткам сердца.
- После того, как все нежелательные очаги устранены ещё раз проводятся замеры распространения импульсов для оценки эффективности операции.
Вместо заключения
Существуют и другие способы программной навигации со своими плюсами и минусами. Так, например, определение положения на основе магнитных полей имеет более высокую точность, но для таких систем требуются специальные дорогостоящие катетеры.
В данной статье был показан базовый пример операции в упрощенной форме. В рамках одной статьи невозможно описать все детали и виды операций.
Спасибо за внимание и будьте здоровы!
Комментарии (18)

synedra
27.04.2018 07:55На протяжении всей операции вычисляется разность потенциалов между полюсами картирующего катетера и опорного. Причем мы получаем разность потенциалов по трем ортогональным осям.
Не понял, как сигнал раскладывается на три оси. Разность потенциалов — это же единственная переменная? Зависящая от расстояния, электромагнитного поля в окрестностях и ещё бог весть каких хитроумных факторов типа топологии окрестных стенок, но всё равно такое ощущение, что для данной позиции опорного катетера и данной разности потенциалов будет существовать множество позиций картирующего.

Ser-V Автор
27.04.2018 10:11Попробую описать немного подробней. К телу подключаются парные электроды. Возьмем одну пару. Первый электрод фиксируется на груди, другой на спине. Между ними пускают переменный ток. Катетеры в сердце способны улавливать этот ток. Так получаем разность потенциалов в одной плоскости. Другую пару подключают к шее и бедру, измерения будут в перпендикулярной плоскости. Третья пара устанавливается на правом и левом боку. Чтобы измерения не пересекались для каждой пары берется своя частота. Другой вариант пускать переменный ток между парными электродами в разные промежутки времени. Таким образом получаем измерения в разных плоскостях.

alec_kalinin
27.04.2018 09:57Большое спасибо за интересную статью! Есть один вопрос. В этой технологии для построения 3D модели сердца используются только данные положения катетера. Но вроде бы модель сердца можно еще построить и по данным КТ/МРТ? Эти данные можно как-то использовать?

Ser-V Автор
27.04.2018 11:31Рад, что тема интересна. Да, действительно можно дополнительно использовать исследования КТ/МРТ. По этим данным в отдельном окне есть возможность построить 3D модель. Благодаря тому, что такая модель будет более точная это может помочь для навигации.

RajaKajiev
27.04.2018 11:32Каковы перспективы роботизации в этой области? (не со стороны пациентов :), а ассистентов и операторов)

Ser-V Автор
27.04.2018 11:48Роботизация вполне реальна. База для этого есть. Уже сейчас поиск точек для карт доступен в автоматическом режиме. Об оперирование без участия персонала речи пока не идет.

zelenoff
27.04.2018 14:36Какая клиника или врачи уже это используют?

Ser-V Автор
27.04.2018 15:59Из тех учреждений, которые уже используют эту систему можно выделить ГНИИ ПМ Профмедицины и Институт Вишневского. Прибор разрабатывался совместно с компанией ЗАО «Медитек», они делали аппаратную часть, мы — программную часть для навигации.

Virtual77
27.04.2018 15:54РЧА это же оно? Единственное что мне когда их делали два раза то не было вот этого всего, я себя и свои внутренности видел на мониторе. Врач в алюминиевом фартуке. Ну короче делают такие уже давно.
Второй раз мне врач предложила вместо РЧА некую криобалонную изоляцию, у РЧА процент — 50% у второй 70-80% что тахикардия не вернется. Короче два раза РЧА я пережил, это реально помогло, но все равно редкие приступы сбоя ритма есть и как правило они наступают во время гипервентиляции легких(задержка дыхания и резкий глубокий вдох-выдох) таким же методом приступ купируется но не всегда. Короче надо делать третью операцию…
Ser-V Автор
27.04.2018 16:00Да, это РЧА. Удачи Вам и здоровья!

Virtual77
27.04.2018 16:42Спасибо, про фартук наврал, он свинцовый. То есть я так понимаю с данной технологией минимизируется рентгеновское облучение мед.персонала и пациента?

Ser-V Автор
27.04.2018 17:07Использование вышеописанной технологии позволяет полностью исключить рентгеновское облучение, т.к. в данном случае в использовании рентгеноскопии нет необходимости — это является одним из основных преимуществ.

Virtual77
27.04.2018 17:38+1Желаю Вам удачи в ваших разработках. И конечно как один из пациентов могу выразить благодарность.
Сейчас конечно я уж не вспомню видел я в ГНИИ ПМ такое оборудование в операционной или нет, тем более нам их несколько и все они в мониторах, но мне однозначно помогло на порядок меньше стало приступов тахикардии/аритмии.


zartarn
Какие противопоказания к физической активности после данной операции?
И рассказали бы в каких случаях она нужна. При дыхательной аритмии вроде врачи не запариваются никогда. Даже не пытаются лечить.
Ser-V Автор
В среднем курс реабилитации составляет 2 — 3 месяца. В этот период пациенту рекомендуется воздержаться от сильных нагрузок на сердце. Так что занятия профессиональным спортом лучше отложить.
Что касается дыхательной аритмии, то это нарушение часто не вызывает ни каких проблем со здоровьем. Следовательно оперировать излишне. В любом случае нужна консультация с врачом.