
Не будет преувеличением, если сказать, что фактически у каждого в аптечке есть перекись водорода. Любой порез или царапина часто следовали одной и той же схеме обработки: перекись, зеленка, пластырь. Кто в детстве любил и умел находить приключения на одно место, а потому получал травмы разной степени тяжести, прекрасно помнит пощипывание и вспенивание перекиси на «вавке» и возмущенные причитания родителей. Помимо первой помощи H2O2 применяется и в косметологии, и в пищевой промышленности, и даже при разработке электроники. Проблема в том, что современные методы получения столь полезного вещества крайне сложны и затратны. Посему ученые из Токийского университета (Япония) предложили использовать то, что также частенько встречается в каждом доме, а именно кофе и чай. Как именно эти напитки помогают в синтезе H2O2, при чем тут бактерии, и насколько новый метод эффективен? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Первым делом ученые напоминают нам о Р450 — надсемействе гемсодержащих белков, которые вводят один атом кислорода, полученный из молекулярного кислорода (O2), в органическую молекулу. Монооксигеназы Р450 катализируют прямое окисление различных соединений регио — и стереоселективным* образом в условиях окружающей среды.
Региоселективность* — явление, при котором в химической реакции один путь разрыва и образования связей преобладает над остальными возможными путями.Фрагмент гема* в каталитическом центре P450 активирует O2, используя электроны, переданные от NAD(P)H компонентами редуктазы*.
Стереоселективность* — преимущественное образование в химической реакции одного стереоизомера над другим.
Стереоизомеры* — химические соединения, имеющие одинаковое строение, но отличающиеся пространственным расположением атомов.
Гемы* — комплексные соединения порфиринов с двухвалентным железом, несущие один или два аксиальных лиганда. Гемы выступают в роли простетических групп (небелковых частей) белков.
Редуктаза* — фермент, катализирующий окислительно-восстановительные реакции в живых клетках.Однако, поскольку монооксигеназам P450 требуется NAD(P)H в качестве кофермента (катализатор ферментов), этот биотехнологический процесс может быть сложным, поскольку требуется непрерывная поставка этого дорогостоящего кофермента для достижения эффективного производства окисленных химических веществ.
Но вот пероксигеназы P450 используют перекись водорода (H2O2) вместо O2 для образования соединения I. Поскольку для пероксигеназ Р450 не требуется NAD(P)H, эти ферменты имеют преимущество для практического применения.
CYP152A1 бактерии Bacillus subtilis является прототипом бактериальной пероксигеназы P450, которая катализирует гидроксилирование длинноцепочечных насыщенных жирных кислот.
Пероксигеназы P450, как уже было сказано, требуют H2O2 в качестве окислителя. В настоящее время H2O2 производится с помощью антрахинонового процесса, в котором антрахинон восстанавливается до антрагидрохинона газообразным водородом на палладиевом катализаторе в органическом растворителе. Полученный антрагидрохинон восстанавливает O2 с образованием H2O2, который извлекается с помощью жидкостной экстракции. Этот многоэтапный метод требует значительных затрат энергии и приводит к значительным потерям, что отрицательно сказывается на устойчивости процесса и увеличивает производственные затраты.
На данный момент уже есть исследования некоторых альтернативных методов. К примеру, глюкозооксидаза может быть использована для соединения окисления глюкозы и восстановительной активации O2 с образованием H2O2, которая запускает реакции окисления, катализируемые пероксигеназой. Также рассматривались полупроводники на основе TiO2, которые генерируют H2O2 из O2 под световым облучением с использованием расходуемых доноров электронов, таких как метанол.
Эти in situ (на месте, в естественной среде) методы, как отмечают ученые, позволяют генерировать низкие концентрации H2O2, тем самым облегчая проблему инактивации пероксигеназ P450 окислителем. Однако ферментативные и фотокаталитические методы являются более дорогими, чем прямое добавление H2O2, из-за потребности в катализаторах (например, глюкозооксидаза и TiO2-полупроводники) и донорах электронов (например, глюкозе и метаноле) для производства H2O2. Следовательно, идеальный метод пока еще не был найден.
И тут авторы рассматриваемого нами труда задаются любопытным вопросом — какой самый популярный безалкогольный напиток в мире? Кофе, конечно же. По данным на 2020 год в мире было потреблено порядка 10 миллионов тонн кофейных зерен.
Потребление кофе приводит к образованию большого количества отработанной кофейной гущи (SCG от spent coffee ground), которая в основном выбрасывается как отходы из-за отсутствия экономической ценности. Для сравнения, чай является вторым по популярности безалкогольным напитком в мире, и потребление большого количества чая также приводит к образованию большого количества остатков чайного листа (TLR от tea leaf residue), которые создают такую же проблему с отходами, что и SCG. Повышенное внимание научного сообщества к проблемам экологии и отходов привело к началу поисков возможного применения SCG и TLR.
Поскольку эти отходы состоят из большого количества органических соединений, таких как полисахариды и полифенолы, они могут служить в качестве биоресурса для топлива и синтеза ценных химических веществ. Полифенолы, такие как хлорогеновая кислота и кофейная кислота, присутствуют в больших количествах в кофе, а катехины в изобилии содержатся в чае. Это биологически активные молекулы, которые оказывают множество полезных эффектов, включая антиоксидантную и противораковую активность. Интересно, что полифенолы в кофе и чае также действуют как прооксиданты, восстанавливая O2 с образованием окислителя H2O2, что связано с антимикробной активностью этих соединений.
Учитывая вышеописанные свойства, вполне ожидаемо, что ученые решили попробовать SCG и TLR в качестве основы для синтеза перекиси водорода.
Подготовка к исследованию
Кофе и чай готовили путем экстракции кофейной гущи и листьев чая (по 0.2 г каждого) с использованием дистиллированной деионизированной воды (10 мл), нагретой до 90°С в течение 10 минут с последующей фильтрацией. Полученные SCG и TLR сушили на фильтре и по 0.02 г каждого добавляли в воду (250 мкл). Также готовили раствор пирогаллола (C6H6O3) в качестве модельного полифенольного соединения (5 мМ).
Каждый раствор кофе, чая, SCG, TLR и пирогаллола (250 мкл) добавляли в микропробирку, содержащую воду или натрий-фосфатный буфер (100 мМ [pH 7.4]; 250 мкл). Эти растворы (всего 500 мкл) инкубировали при 30°С при встряхивании в темноте в течение 48 часов. После инкубации проводилось измерение образования H2O2 с помощью реактива FOX (от ferrous oxidation−xylenol orange, т. е. окисление железа-ксиленоловый оранжевый).
Ген, кодирующий CYP152A1 в бактерии B. subtilis, клонировали в pET-28a(+) для получения генного продукта с N-концевой His-меткой. Ген CYP152A1 амплифицировали из вектора pET-21a(+), несущего ген CYP152A1, методом ПЦР. Полученную плазмиду вводили в клетки E.coli Rosetta 2(DE3).
Трансформированные клетки E. coli культивировали при 30 °C в среде LB, содержащей (на литр) триптон Bacto (10 г), экстракт дрожжей Bacto (5 г) и NaCl (10 г, pH 7.0), а также дополненный канамицином (50 мкг/мл) и хлорамфеникол (30 мкг/мл). После культивирования в течение 6 часов в среду добавляли изопропил-β-D-тиогалактопиранозид (1 мМ), 5-аминолевулиновую кислоту (0.5 мМ) и FeSO4 (0.5 мМ). Затем продолжали культивирование в течение 15 часов при 25°С. Клетки собирали центрифугированием и промывали калий-фосфатным буфером, содержащим глицерин.

Внешний вид колонок HiTrap (слева) и HisTrap (справа).
CYP152A1 с N-концевой His-меткой очищали из растворимой фракции трансформированных клеток E. coli с использованием HisTrap HP колонки. Растворимую фракцию наносили на колонку HisTrap HP объемом 1 мл, уравновешенную фосфатом натрия (20 мМ), содержащим NaCl (500 мМ) и имидазол (20 мМ). Затем колонку промывали 10 объемами колонки того же буфера. Связанный His-меченый белок элюировали фосфатом натрия (20 мМ), содержащим NaCl (500 мМ) и имидазол (500 мМ). Отдельные фракции анализировали с помощью SDS-PAGE (электрофорез белков в полиакриламидном геле), а фракции, содержащие CYP152A1, объединяли и обессоливали с использованием колонки HiTrap.
В реакции окисления 4-метокси-1-нафтола и CYP152A1 реакционная смесь (1 мл) содержала очищенный CYP152A1, 4-метокси-1-нафтол, диметилсульфоксид, гептановую кислоту в качестве молекулы-ловушки и H2O2 в натрий-фосфатном буфере. Реакции проводили в кюветах (ванночках) в течение 120 секунд, а образование C22H16O4 (4-метокси-2-(4-метокси-1-оксо-1,2-дигидронафталин-2-илиден)-1,2-дигидронафталин-1-он или синий Рассига) контролировали спектрофотометрически при длине волны 610 нм.

Схема №1
Концентрацию синего Рассига рассчитывали с использованием коэффициента экстинкции 1.45 × 104 М/см при 610 нм. Выход продукта (%) в пересчете на H2O2 выражали как (2 × полученный синий Рассига [моль])/(добавленная H2O2 [моль]) × 100. Множитель «2» в этом уравнении был необходим, потому что две молекулы H2O2 расходуются на производство одной молекулы синего Рассига (1а на схеме).
В реакции окисления стирола и CYP152A1 реакционная смесь (500 мкл) содержала очищенный CYP152A1, стирол, диметилсульфоксид, гептановую кислоту и H2O2 в натрий-фосфатном буфере. Реакции проводили в микропробирках в течение 60 секунд. Образование оксида стирола и фенилацетальдегида оценивалось с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Выход продукта (%) в пересчете на H2O2 выражали как (полученный стиролоксид [моль] + полученный фенилацетальдегид [моль])/(добавленная H2O2 [моль]) × 100 (1b на схеме).
В реакции окисления 4-метокси-1-нафтола и CYP152A1 раствор фермента и субстрата содержал очищенный CYP152A1, 4-метокси-1-нафтол, диметилсульфоксид и гептановую кислоту в натрий-фосфатном буфере. H2O2 получали путем инкубации SCG или TLR в натрий-фосфатном буфере в течение 24 часов с последующей фильтрацией. Полученный раствор H2O2 разбавляли в два раза перед смешиванием с раствором фермента и субстрата, чтобы можно было проводить спектрофотометрический мониторинг образования синего Рассига в режиме реального времени в диапазоне, в котором концентрация пропорциональна поглощению. Раствор фермента и субстрата (500 мкл) смешивали с двукратно разведенным раствором H2O2 (500 мкл) в кювете и инкубировали 180 секунд со спектрофотометрическим контролем образования синего Рассига при длине волны 610 нм.
В реакции окисления стирола и CYP152A1 раствор фермента и субстрата содержал очищенный CYP152A1, стирол, диметилсульфоксид и гептановую кислоту в натрий-фосфатном буфере. H2O2 получали путем инкубации SCG или TLR в натрий-фосфатном буфере в течение 24 часов с последующей фильтрацией. Затем раствор фермента и субстрата (250 мкл) смешивали с раствором H2O2 (250 мкл) в микропробирке и инкубировали в течение 60 секунд. Полученный раствор H2O2 (250 мкл) при необходимости повторно добавляли к смеси с интервалом в 60 секунд. Образование оксида стирола и фенилацетальдегида анализировали с помощью ВЭЖХ.
Результаты исследования
Первым делом ученые исследовали производство H2O2 из SCG и TLR. После приготовления кофе и чая полученные SCG и TLR в качестве источников отходов биомассы добавляли в дистиллированную деионизированную воду. Дополнительно был подготовлен раствор пирогаллола в качестве модельного полифенольного соединения.

Изображение №1
Растворы кофе, чая, SCG, TLR и пирогаллола смешивали с водой или фосфатно-натриевым буфером и инкубировали при 30 °C при встряхивании. Пирогаллол в воде произвел 0.16 мМ H2O2 за 48 часов (1а). SCG и TLR, а также кофе и чай также давали H2O2 (1b-1e). Продукция H2O2 с помощью SCG и TLR в воде составила 0.27 и 0.05 мМ соответственно.
Было установлено, что продукция перекиси увеличивается при использовании натрий-фосфатного буфера. В таком случае показатели продолжали расти с течением времени и достигали 0.72 и 1.64 мМ спустя 48 часов.
В совокупности эти данные указывают на то, что SCG и TLR отлично подходят в качестве доноров электронов для производства H2O2.
Прежде чем оценить окисление, катализируемое CYP152A1, с использованием H2O2, полученного из SCG и TLR, необходимо было исследовать влияние концентрации H2O2 на саму реакцию. CYP152A1 с меткой His был получен в бактерии Escherichia coli, а затем очищен от растворимой фракции клеток с использованием никелевой колонки.
Ранее было установлено, что в присутствии короткоцепочечных жирных кислот в качестве молекул-приманок CYP152A1 катализирует окисление 4-метокси-1-нафтола с образованием синего Рассига (1a на схеме). В рамках данного исследования, когда CYP152A1 инкубировали с 4-метокси-1-нафтолом и H2O2 в присутствии гептановой кислоты в течение 120 секунд в качестве модельной реакции, то смеси стали синими из-за образования синего Рассига.
Напротив, инкубация 4-метокси-1-нафтола, H2O2 и гептановой кислоты без добавления CYP152A1 не привела к изменению цвета. Это указывает на то, что образование продукта зависит от окисления, катализируемого CYP152A1. По мере увеличения исходной концентрации H2O2 CYP152A1 демонстрировал более высокое число оборотов* (TOF от turnover frequency) и продуцировал большее количество синего Рассига (таблица №1).
Число оборотов* — количество субстрата, которое фермент может преобразовать в продукт реакции в единицу времени.
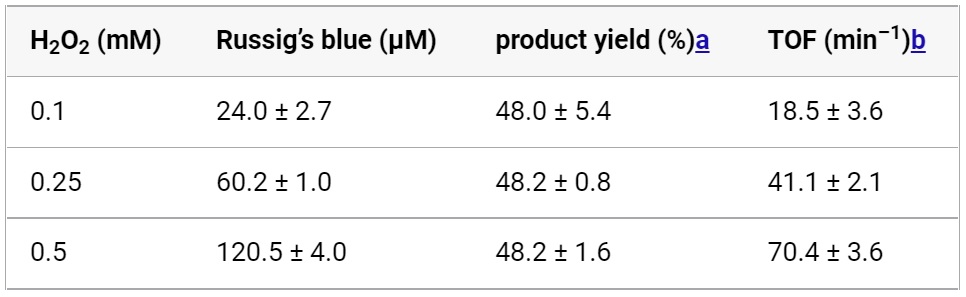
Таблица №1
Расчетный выход продукта в пересчете на H2O2 составил около 48% независимо от исходной концентрации H2O2. Относительно низкие выходы продукта могут быть связаны с разъединением потребляемого H2O2 от окисления, катализируемого CYP152A1. Анализ показал, что H2O2 не осталось в реакционной смеси после инкубации CYP152A1, H2O2 и гептановой кислоты в течение 120 с как в присутствии, так и в отсутствии 4-метокси-1-нафтола. Напротив, в реакционной смеси без CYP152A1 почти не наблюдалось изменений количества H2O2.
Также было исследовано влияние концентрации H2O2 на окисление стирола, катализируемое CYP152A1 (1b на схеме). Инкубация CYP152A1 со стиролом и H2O2 в присутствии гептановой кислоты в течение 60 секунд приводила к образованию оксида стирола и фенилацетальдегида. По мере увеличения исходной концентрации H2O2 CYP152A1 продуцировал больше стиролоксида и фенилацетальдегида (таблица №2).

Таблица №2
Расчетный выход продукта составил около 14% независимо от исходной концентрации H2O2. Было подтверждено, что H2O2 поглощается каталазной активностью CYP152A1 даже в реакции со стиролом. Эти результаты показывают, что количество стиролоксида и фенилацетальдегида, продуцируемых CYP152A1, также зависит от исходной концентрации H2O2.
Далее ученые провели исследование окисления 4-метокси-1-нафтола до синего Рассига с использованием H2O2, полученного из SCG и TLR, в качестве модельной реакции. Как H2O2, полученный из SCG, так и H2O2, полученный из TLR, способствовал окислению 4-метокси-1-нафтола, катализируемому CYP152A1. При этом 56.2 и 91.8 мкМ синего Рассига образовывалось в течение 180 секунд реакции в смесях, содержащих H2O2, полученный из SCG и TLR соответственно (2b, 2c).
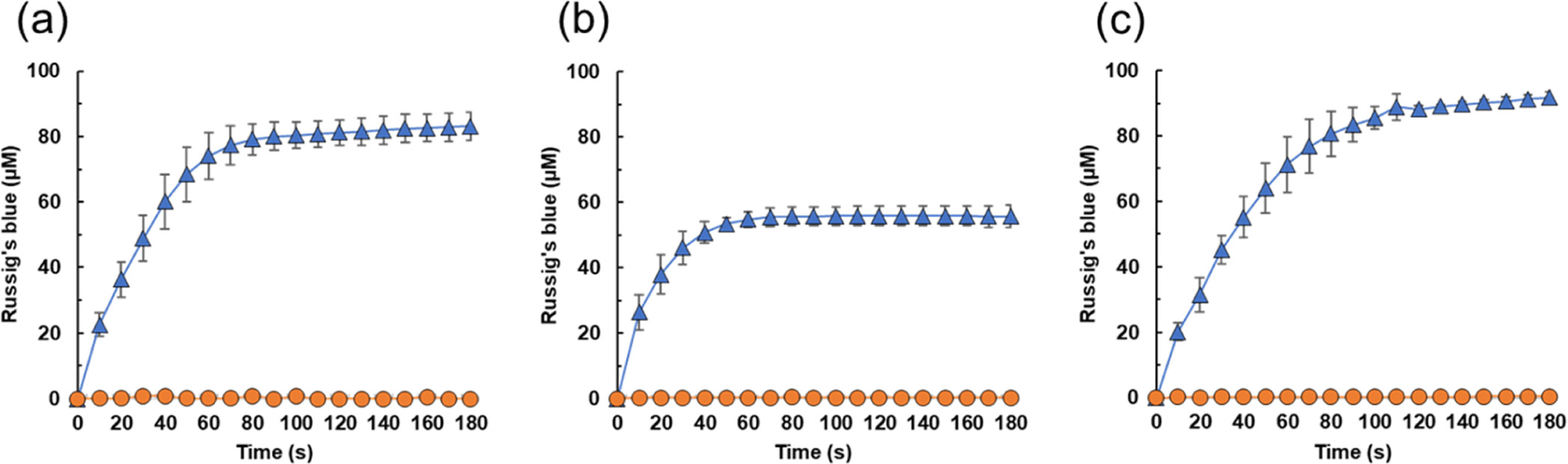
Изображение №2
Следует отметить, что в отсутствие CYP152A1 образования продукта не наблюдалось. Раствор H2O2, приготовленный из пирогаллола, также действовал как окислитель (2а).
Начальная концентрация H2O2, полученного из SCG, была ниже, чем концентрация H2O2, полученного из пирогаллола, что привело к меньшему количеству синего Рассига (таблица №3).
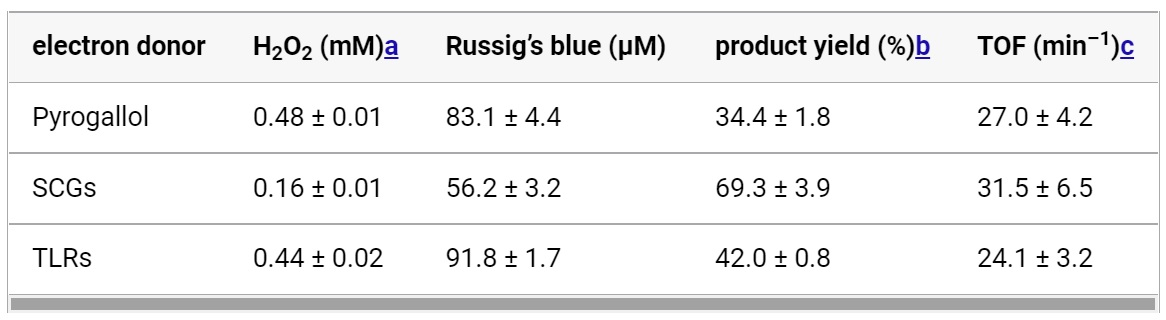
Таблица №3
Почти такое же количество синего Рассига было получено с H2O2 из TLR, как и с H2O2 из пирогаллола. Эти результаты свидетельствуют о том, что компоненты растворов SCG и TLR не ингибируют реакцию, катализируемую CYP152A1. Расчетные выходы продуктов в пересчете на H2O2 составили 69.3 и 42.0% для SCG и TLR соответственно.
Выход продукта для SCG (69.3%) был значительно выше, чем для реагента H2O2 (48%). Ученым не удалось полностью объяснить такую разницу. Но есть свидетельства того, что различные компоненты SCG могут ускорять синтез синего Рассига. Тем не менее эти результаты ясно демонстрируют, что биомасса SCG и TLR способствует биокатализу окисления.

Изображение №3
Далее ученые провели анализ окисления стирола до стиролоксида и фенилацетальдегида. CYP152A1 инкубировали со стиролом, гептановой кислотой и H2O2, полученным из SCG и TLR. SCG способствовал синтезу 13.9 мкМ стиролоксида и 9.8 мкМ фенилацетальдегида в течение 60-секундной реакции (таблица №4). Раствор TLR содержал большее количество H2O2 по сравнению с раствором SCG и, следовательно, способствовал синтезу большего количества стиролоксида и фенилацетальдегида (63.6 и 44.1 мкМ соответственно).

Таблица №4
Расчетный выход продукта составил 7.3 и 12.3% для SCG и TLR соответственно. Эти значения были практически такими же (или несколько ниже) значений для реагента H2O2 (14%). Это еще раз подтверждает, что растворы SCG и TLR хорошо функционируют в качестве источников H2O2 для запуска синтеза стиролоксида и фенилацетальдегида, катализируемого CYP152A1.

Изображение №4
Также ученые попытались получить оксид стирола и фенилацетальдегид путем многократного добавления H2O2 из SCG в реакционную смесь, поскольку H2O2 в смеси быстро расходуется каталазной активностью CYP152A1. В присутствии раствора SCG CYP152A1 продуцировал 0.93 мкг (7.7 нмоль) оксида стирола и 0.81 мкг (6.7 нмоль) фенилацетальдегида в течение 60-секундной реакции (4а).
После реакции к смеси снова добавляли раствор SCG. CYP152A1 сохранил свою активность, что привело к синтезу 1.31 мкг (10.9 нмоль) стиролоксида и 1.03 мкг (8.6 нмоль) фенилацетальдегида. В последующих реакциях при добавлении раствора SCG количество продукта не увеличивалось, вероятно, за счет инактивации фермента.
Используя аналогичную методику, повторное добавление TLR к реакционной смеси привело к получению 6.63 мкг (55.2 нмоль) и 4.18 мкг (34.8 нмоль) оксида стирола и фенилацетальдегида соответственно (4b).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
H2O2 является важным и универсальным промышленным химическим соединением, используемым во многих областях. Современные методы производства H2O2 по большей степени основаны на антрахиноновом процессе, обладающим рядом недостатков.
В рассмотренном нами сегодня труде ученые продемонстрировали, что использование биомассы отходов кофе и чая может быть отличным источником перекиси водорода. Разработанный метод отличается своей экономичностью из-за отсутствия необходимости в катализаторах, экологичностью и простотой реализации.
Кроме того, полученная из кофейной/чайной гущи перекись может использоваться для синтеза других полезных химических соединений. Это было подтверждено на практике, когда ученые смогли синтезировать оксид стирола, применяемый в медицине.
Конечно, метод пока неидеален, а потому требует доработок, нацеленных на повышение производительности и снижение затрачиваемых ресурсов. Тем не менее это исследование показывает, что даже отходы, которые на первый взгляд кажутся бесполезными, могут принести пользу, если их внимательно изучить.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Комментарии (3)

shifted83
15.06.2022 10:143% от 100мл = 3мл. За 32 руб. То есть почти 1000 руб. за литр. Плюс от опытного производства до промышленного — пропасть, и в итоге может оказаться как на порядок дешевле существующего метода, так и на порядок дороже. На вскидку предположу проблемы с логистикой (то же, что с раздельным сбором мусора и сдачей макулатуры/стеклотары и т.п.). Ученые дали инженерам возможность попытаться сделать производство перекиси дешевле и «экологичнее», на этом их задача завершена.

Bedal
15.06.2022 13:05+1в итоге может оказаться как на порядок дешевле существующего метода
отсутствие необходимости в палладиевом катализаторе само по себе может сделать технологию перспективной.На вскидку предположу проблемы с логистикой
Да ладно, любое предприятие по производству растворимого кофе даст этой гущи с избытком. Не говоря уж о старбаксах всяких, где сбор наладить тоже проще простого.


ugsm
хмм, это дешевле, чем флакон 100мл за 20 рублей?