
Организм человека — это удивительный механизм, способный выполнять множество сложнейших функций одновременно. Многие аспекты строения, функционала или химического состава той или иной части нашего тела кажутся обыденными вещами, но лишь благодаря колоссальному исследовательскому труду, который длится уже много веков. Нам удалось не только установить пределы возможностей нашего организма, но и во многом преодолеть их. Однако далеко не всегда удается обыграть природу. К примеру, регенеративные способности человека достаточно скудные, особенно если сравнивать с саламандрами. Одним из самых ярких примеров ограниченности регенеративных способностей является невозможностью полноценно восстанавливать нервные окончания, без которых та или иная часть тела не сможет функционировать, даже если другие ткани не повреждены. Ученые из Кембриджского университета (Великобритания) в попытках решить эту проблему разработали метод восстановления ампутированного периферического нерва с использованием биогибридной регенеративной биоэлектроники. Что лежит в основе данного метода, как он реализуется, и насколько он эффективен? Ответы на эти вопросы мы найдем в докладе ученых.
Основа исследования
Как отмечают авторы исследования, основным препятствием в устранении последствий повреждения периферической нервной системы является врожденная неспособность нейронов регенерировать и восстанавливать нарушенные нейронные цепи. Следовательно, пока мы не научили свои нейроны регенерировать, нам необходимо найти им замену. В последнее время большое внимание научного сообщества привлекают имплантируемые нейротехнологии и клеточная терапия. Эти методы пытаются восстановить функцию, либо минуя место повреждения и электрически взаимодействуя с существующими нейронами, либо создавая новые клетки для замены поврежденных. К сожалению, оба метода имеют недостатки, которые тормозят процесс перехода от лабораторных исследований до клинических.
В контексте поврежденной ткани в зрелой нервной системе трансплантированные нейроны изо всех сил пытаются восстановить функциональные связи в существующих цепях без надлежащего руководства. Точно так же электроды не могут работать без взаимодействия со здоровыми рабочими клетками, потому что эти клетки повреждены травмой или скрыты образованием плотной рубцовой ткани вокруг имплантата (FBR от foreign body reaction / реакция на инородное тело). Более того, современным нейротехнологиям не хватает избирательности и специфичности для взаимодействия с разными подтипами нейронов, отвечающих за разные функции.
Критическим ограничивающим фактором является разрешение, с которым нервные импульсы отображаются на импланты. Это определяется различными факторами, такими как близость между электроактивными клетками и электродами, а также амплитуда их сигналов. Биогибридная стратегия, включающая клетки в качестве промежуточного слоя на электронике, позволяет осуществлять «управляемую» синаптическую интеграцию между имплантированными клетками и существующей нейронной схемой. Биогибридные импланты имеют потенциальную возможность принимать, взаимодействовать и контролировать поведение трансплантированных клеток; способствовать организованной, функциональной интеграции клеток с живой тканью; и снижать образование рубца (т.е. FBR).
Ученые предположили, что использование масштабируемого клеточного источника, который можно интегрировать в биоэлектронное устройство в качестве биологической мишени для импульсов периферических нервов, может обеспечить запись с выбранных подмножеств нервных волокон, уменьшить расстояние между аксоном и электродом и улучшить амплитуду сигнала. Взяв за основу вышеупомянутые принципы, ученые создали биогибридный нейронный интерфейс, объединяющий скелетные миоциты человека, происходящие из индуцированных плюрипотентных стволовых клеток (iPSC от induced pluripotent stem cell), и гибкую электронику в модели хронического сенсомоторного нерва крысы.
Результаты исследования
Изображение №1
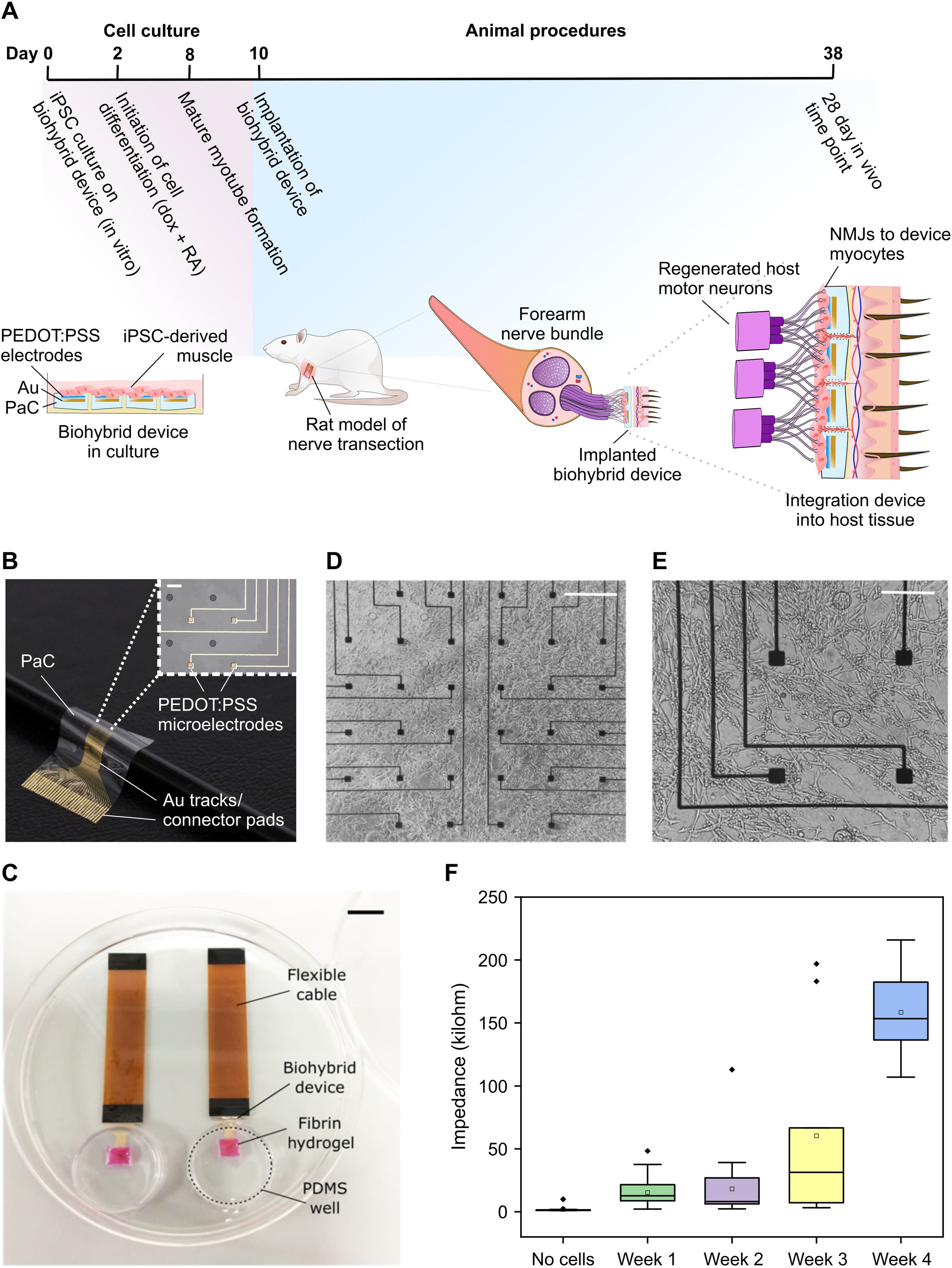
Первым шагом в разработке биогибридного устройства был выбор подходящей временной шкалы для культивирования и достаточно зрелых клеток in vitro (в пробирке) перед имплантацией устройства in vivo (в живой организм). Скелетные миоциты, полученные из iPSC человека с помощью клеточного репрограммирования OPTi-OX, были выбраны в качестве биогибридной клеточной популяции, поскольку эта система стабильно продуцирует высокочистые миоциты после 8 дней культивирования. Это сделало их подходящими для размещения сенсомоторных нервов, двигательные аксоны которых обычно иннервируют мышечную ткань, в то время как клетки, полученные из iPSC человека, потенциально могут предоставить готовый клеточный материал для будущих клинических применений. На основании свойств миоцитов, полученных из iPSC, и поврежденных нервов, которые обычно регенерируют в течение 3 недель после повреждения, был определен временной график для проверки способности биогибридных устройств интегрироваться с нервами хозяина (1A).
Культивация iPSC проводилась на тонких гибких массивах микроэлектродов (MEA от microelectrode array) на основе парилена. MEA были изготовлены с использованием стандартных методов фотолитографии и содержали 32 электрода из проводящего полимера [поли(3,4-этилендиокситиофен) полистиролсульфонат (PEDOT:PSS)], расположенных в симметричной сетке. MEA занимал площадь размером 2х2 мм внутри большего париленового устройства, внутри которого были сделаны круглые отверстия, чтобы обеспечить рост сосудистой сети с задней стороны устройства и поддержать выживаемость клеток после имплантации (1B).
Процесс культивирования состоял из кластеров iPSC, высеянных на слой фибринового гидрогеля, нанесенного на поверхность MEA, чтобы помочь инкапсулировать клетки на устройстве (1C). После индукции репрограммирования через 48 часов на поверхности биогибридного устройства к 8-му дню формируются зрелые многоядерные миотрубочки (1D и 1E), которые вместе с ацетилхолином индуцируют сокращения, демонстрирующие зрелость миоцитов. Биогибридные устройства показали хорошую стабильность в течение всего времени исследования, демонстрируя увеличение импеданса в течение 4 недель культивирования in vivo (1F).
Затем биогибридные устройства, содержащие зрелые мышечные трубки, имплантировали крысам. Биогибридные устройства были имплантированы под кожу животного, при этом MEA и клетки были обращены к подлежащей мускулатуре.
Изображение №2
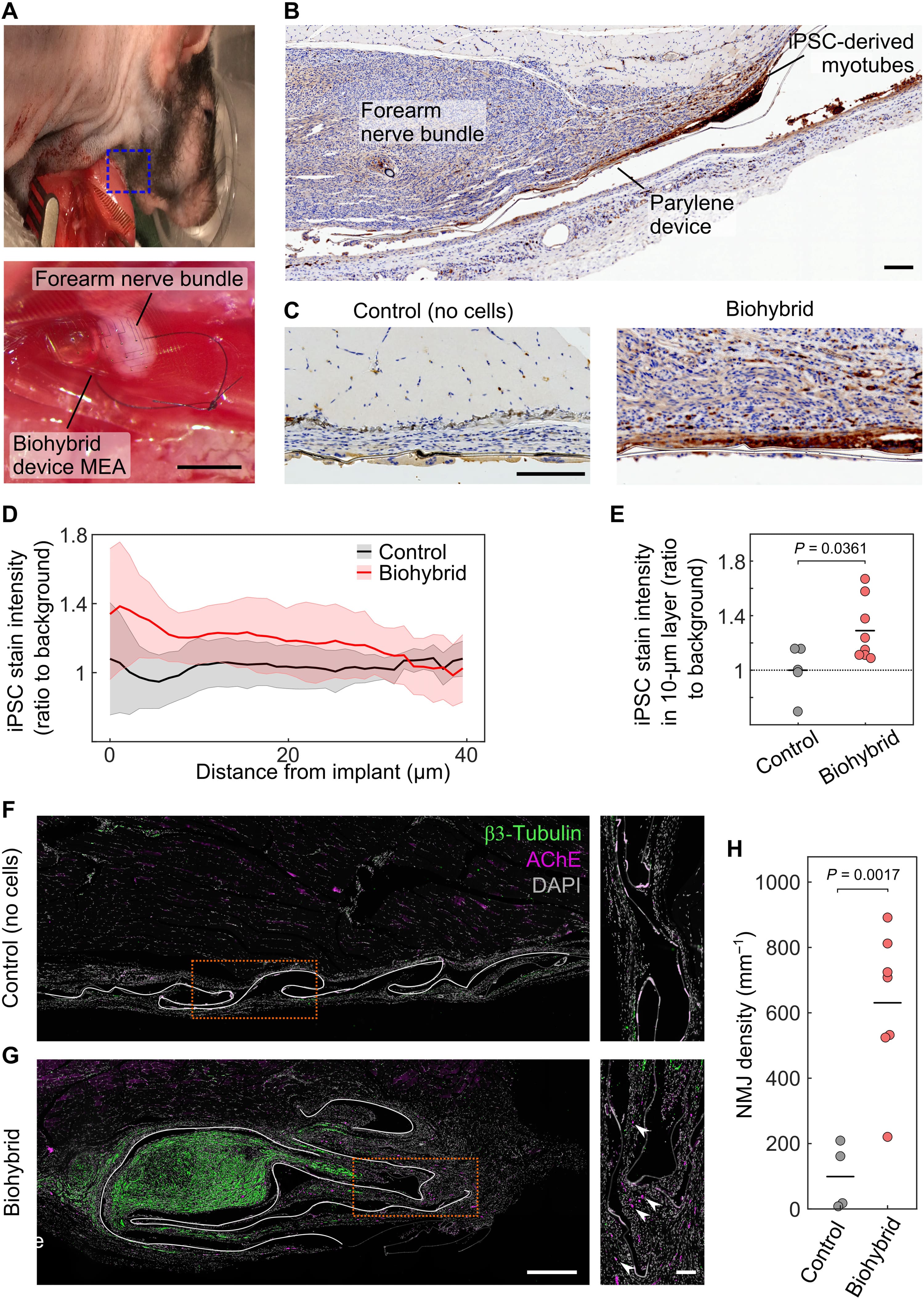
Затем ученые изучили способность биогибридных устройств интегрироваться с регенерирующим нервом. Были выбраны локтевой и срединный нервы, которые контролируют сенсорную и моторную функции лапы и проходят вместе через руку животного (далее нервный пучок предплечья). Этот выбор был обусловлен клинической значимостью повреждения нервов верхних конечностей и более высокой степенью мелкой моторики и сенсорных функций. Имплантацию проводили путем пересечения нервного пучка на уровне локтя и пришивания проксимальной культи нерва к нагруженной клетками стороне биогибридного устройства. Затем устройство перемещали на несколько сантиметров к средней линии животного и закрепляли подкожно над широчайшей мышцей спины (2A и 2B). Было обнаружено, что клетки, полученные из iPSC, выживают после 4 недель имплантации с нервом (2C-2E). Трансплантированные клетки оставались плотно прикрепленными к биогибридному устройству в течение этого периода (2D и 2E).
Иммунофлуоресцентное окрашивание ткани, окружающей биогибридные устройства, указывало на наличие нервно-мышечных соединений (NMJ от neuromuscular junction) на поверхности биогибридных устройств, но не на контрольных устройствах, лишенных миоцитов (2F-2H), и свидетельствовало об иннервации устройства моторными аксонами носителя (т. е. крысы). Хотя между биогибридными и контрольными устройствами не наблюдалось существенных различий во внешнем виде ткани хозяина и плотности клеток (2B и 2C), нерв, к которому пришивалось устройство, часто обнаруживался в непосредственной близости от биогибридных устройств (2B, 2C и 2G), но не контрольных (2C и 2F).
Изображение №3
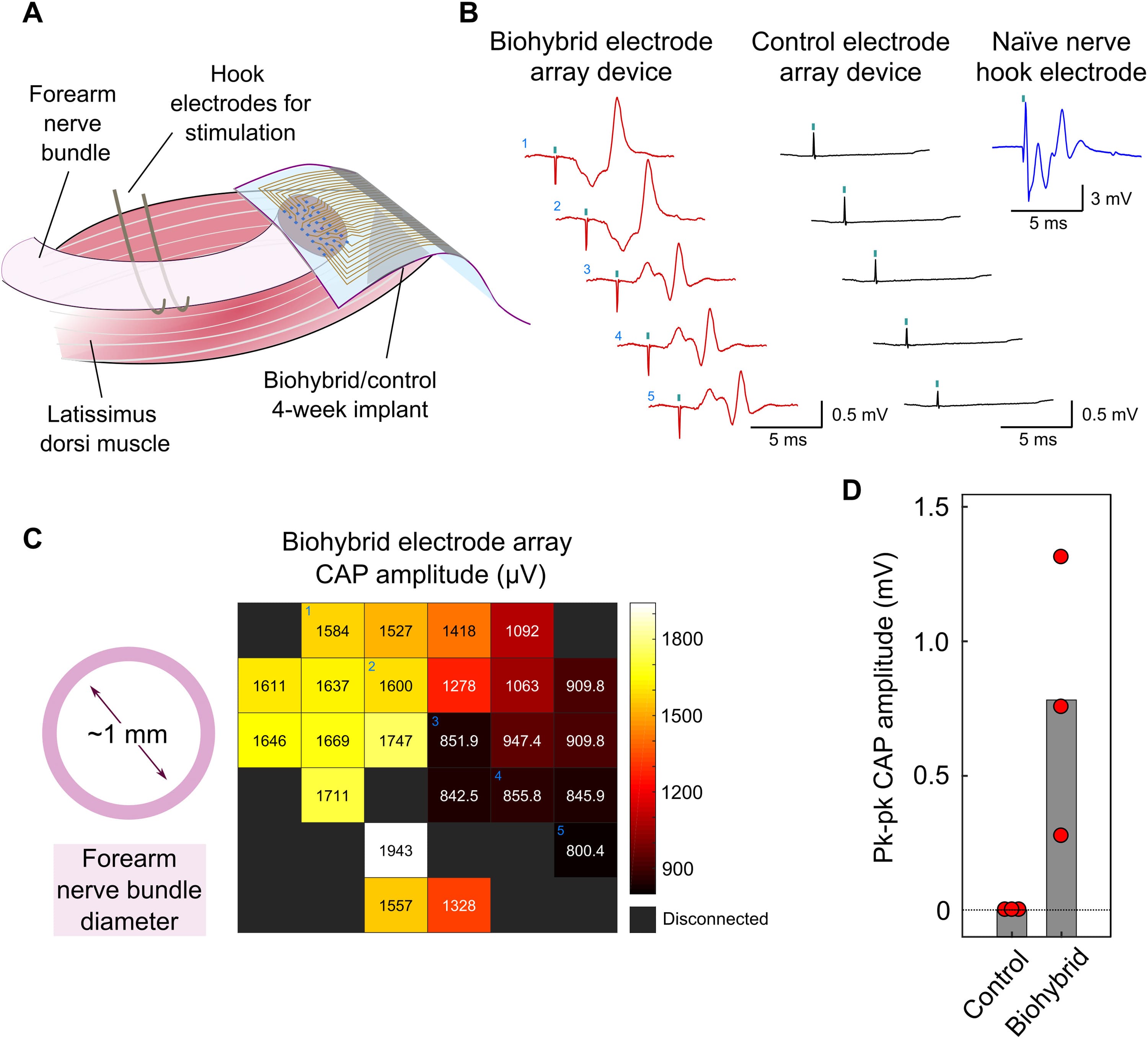
Ожидалось, что хорошая интеграция нервного пучка предплечья с трансплантированной популяцией мышечных трубок, полученных из iPSC, приведет к улучшению качества нервного сигнала, зарегистрированного биогибридным имплантатом. Чтобы это проверить, ученые записали сигналы от нервов, имплантированных биогибридными устройствами и контрольными устройствами, через 4 недели после имплантации. В этот момент времени ученые обнажили соединения MEA и поместили пару электродов-крючков вокруг нервного пучка предплечья примерно на 4 см выше точки пересечения. Электроды-крючки позволяли электрически стимулировать нерв и регистрировать ответ с помощью имплантированных устройств (3A). Стимуляция осуществлялась за счет импульса длительностью 0.1 мс, для которого предварительно был измерен порог активации 100 мкА в контралатеральном нервном пучке предплечья.
Во время стимуляции был обнаружен составной потенциал действия (CAP от compound action potential) биогибридных, но не контрольных имплантатов (3B). Этот CAP состоял из пика с задержкой приблизительно 2 мс (что соответствует скорости проводимости ~ 20 м/с), соответствующего активации волокон Aα/β, за которым следовал более поздний пик, вероятно соответствующий рефлекторной активности, инициированной активацией сенсорных волокон. Подобная картина наблюдалась и в интактных сенсомоторных нервах. Другими словами, разрезанные нервы, имплантированные биогибридным устройством, работали так же, как и неповрежденные нервы.
CAP, зарегистрированные на всем биогибридном MEA, достаточно различались по амплитуде. MEA были разработаны с размерами 2х2 мм, т.е. больше, чем нервный пучок предплечья (диаметр ~ 1 мм). Такие габариты были использованы, чтобы идентифицировать различные особенности в записях электродов под нервом по сравнению с электродами вокруг него (2A). Пики амплитуды CAP в MEA соответствовали по размерам диаметру нерва предплечья (3C). Это еще раз подтверждает, что нерв полноценно интегрировался с биогибридным устройством в течение периода имплантации. Хотя все нервы, имплантированные биогибридными устройствами, продуцировали CAP в ответ на импульсы стимуляции, их средние амплитуды различались. Это свидетельствует об определенной степени вариабельности интеграции биогибридных устройств у животных (3D).
Изображение №4
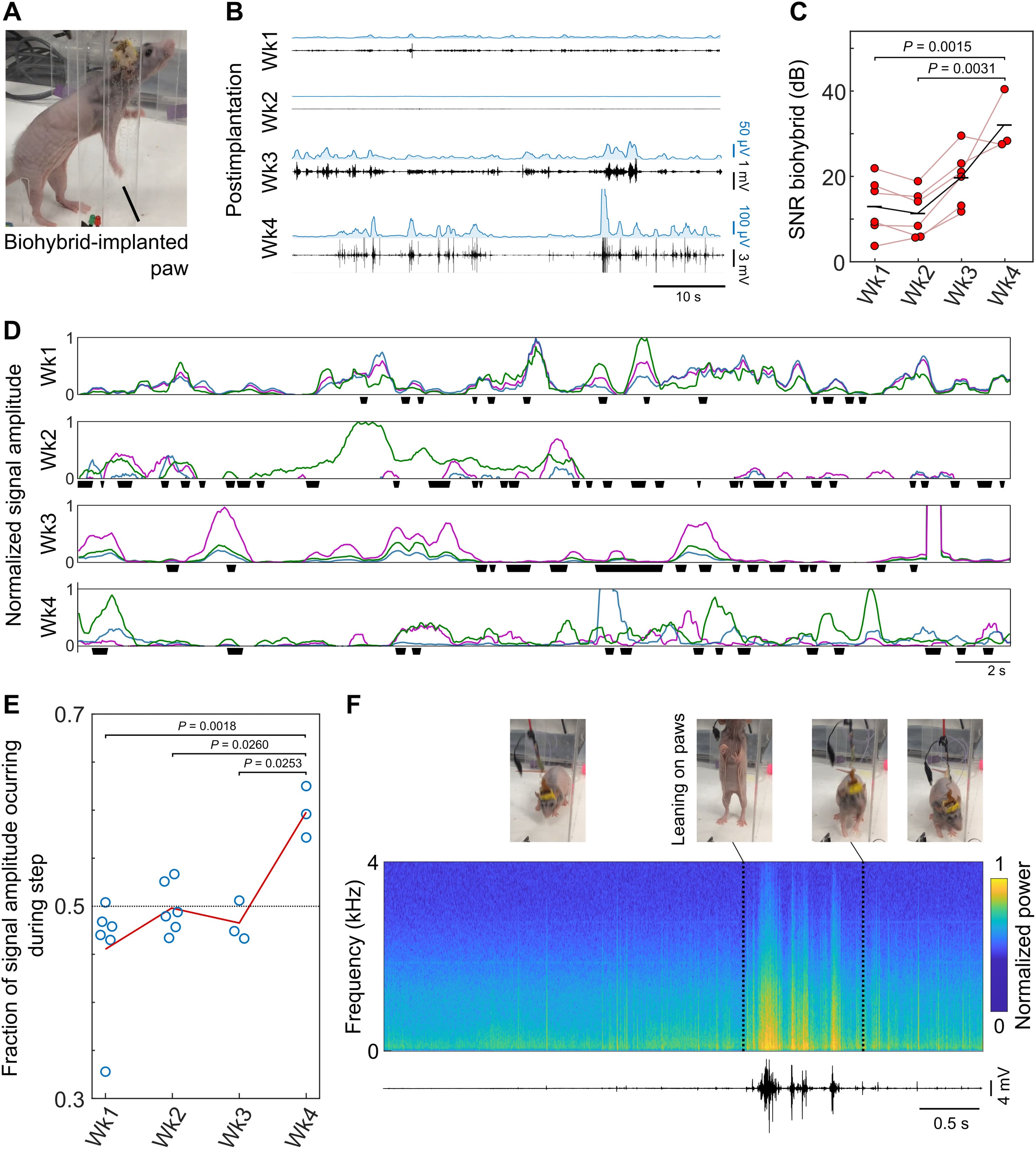
Чтобы отследить интеграцию нерва с биогибридным устройством, ученые имплантировали двум животным биогибридные устройства и вынесли MEA соединения через наголовник. В течение 4 недель проводились еженедельные записи через имплантированное биогибридное устройство, пока животное свободно перемещалось по клетке (4A).
В течение первых 2 недель после имплантации наблюдалась незначительная активность у бодрствующих животных. К третьей и особенно к четвертой неделе сигналы значительно увеличились по амплитуде (недели 1-4: среднее отношение сигнал/шум — 12.9, 11.3, 19.7 и 32.0 дБ соответственно) (4B и 4C). Улучшение было последовательным и равномерным для каждого устройства, при этом каждый исследованный электрод показал увеличение SNR (отношение сигнал/шум) к 3-й неделе (4C). Поскольку отрастание аксонов обычно начинается через 4 дня после травмы, и с учетом небольшого расстояния между нервом и биогибридным устройством, зарегистрированное увеличение амплитуды сигнала соответствует ожидаемой временной шкале врастания аксона в биогибридное устройство.
Ожидалось, что интеграция пучка нервов предплечья в биогибридное устройство приведет к активности, которая коррелирует с функцией лапы, обычно управляемой этим нервом. Потому необходимо было оценить степень этой корреляции между электрической активностью, регистрируемой устройством, и функцией лапы при движении животного по клетке.
Нервный пучок предплечья контролирует функцию лапы, однако, поскольку он был рассечен как часть процедуры имплантации, движение лапы или пальца нельзя было использовать в качестве индикатора активности нерва. Вместо этого ученые идентифицировали шагающие движения, которые обычно заканчиваются разгибанием пальцев, когда лапа приближается к поверхности, и сопоставили эти события с записью электрической активности (4D).
В ходе наблюдений было установлено, что в ранние моменты времени имплантации зарегистрированная активность оказалась независимой от движений рабочей конечности. Однако к 4-й неделе после имплантации электрическая активность все больше коррелировала с движением лапы (4D-4F). Также наблюдалось, что к 4 неделе разные пары электродов часто регистрировали активность независимо друг от друга (4D). Это может указывать на то, что разные пучки аксонов нервного пучка предплечья, которые обычно иннервируют разные группы мышц вокруг лапы, вросли в разные области MEA. Эта гипотеза согласуется с обнаруженными нервно-мышечными синапсами в биогибридных устройствах (2F). Это также подтверждается значительным увеличением амплитуды активности, появившемся в этот момент времени (4B и 4C). Все эти наблюдения подтверждают, что после 4 недель имплантации нерв крысы врос в биогибридное устройство и интегрировался с ним, что значительно улучшило качество записи сигналов.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде описывается биогибридное устройство, способное интегрироваться с нервными окончаниями, тем самым восстанавливая коннективность нервной системы и передачу сигналов.
Представим себе пациента, который лишился руки. Отсутствие конечности не означает, что мозг перестает посылать к ней нейронные сигналы, по крайней мере пытаться. Если использовать современный протез, то необходимо информацию из нервных цепей передать на электроды протеза, тем самым давая пациенту возможность им управлять. Обычно это осуществляется посредством имплантации нерва в крупные мышцы плеча и прикрепление к нему электродов. Проблема с этим подходом заключается в том, что вокруг электрода образуется рубцовая ткань, к тому же с электрода можно извлечь информацию только на поверхностном уровне. Проще говоря, таким электродам не хватает чувствительности. Чтобы ее увеличить нужна система, способная работать в масштабе одного нервного волокна или аксона.
Для этого ученые создали биогибридное гибкое электронное устройство, толщина которого достаточно мала, чтобы прикрепить его к концу нерва. Затем на электрод помещали слой стволовых клеток, перепрограммированных в мышечные клетки.
В ходе опытов ученые имплантировали устройство в предплечье парализованной лапы крысы. Стволовые клетки, которые перед имплантацией были преобразованы в мышечные, интегрировались с нервами в предплечье. Хоть подвижность конечности и не была восстановлена, но устройство смогло уловить сигналы от мозга, которые контролируют движения. Следовательно, если при подключении к остальной части нерва или протезу устройство может помочь восстановить движение.
По мнению авторов разработки, их устройство может быть использовано не только для восстановления подвижности парализованных конечностей, но и для получения более широкого контроля над умными протезами. Малые габариты устройства, позволяющие проводить малоинвазивную имплантацию, дают возможность устанавливать связь с различными аксонами, регулирующими определенные движения. На данный момент разработка находится на ранней стадии развития и нуждается в совершенствовании, особенно в аспекте масштабируемости. Однако уже сейчас можно сказать, что эта технология будет чрезвычайно полезна для большого числа людей.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?


vassabi
эээ ... я правильно понял, что вместо "подтягивания нервов к мышцам" - они "подтянули мышцы к нервам" (и внедрили электроды) ?
Vizmaros
Создали искуственную мышцу для использования в качества адаптера.