
Одним из самых острых вопросов современности является экология, а точнее ее состояние, которое далеко от идеала ввиду техногенного влияния. Помимо зеленой энергетики, о которой мы слышим чаще всего, существует масса исследований, направлены на решение проблемы загрязненности среды. Когда речь идет, например, об очистке большого объема воды, то мы невольно представляем себе какую-то огромную установку, но порой самыми эффективными оказывается самые маленькие. Ученые из Калифорнийского университета в Сан-Диего (США) разработали новый тип живого материала, созданный из природного полимера и генетически модифицированных бактерий, который был запрограммирован выделять специальный фермент, перерабатывающий различные органические загрязнители в безвредные соединения. Из чего именно состоит очиститель, по какому принципу он работает, и с какими типами загрязнения воды может справиться? Ответы на эти вопросы мы найдем в докладе ученых.
Основа исследования
В основе данного исследования лежит достаточно молодая область синтетической биологии, а именно создание синтетических живых материалов. В состав таких материалов входят живые клетки или даже организмы (к примеру, бактерии), которые настраиваются учеными на выполнение тех или иных функций.
Сейчас уже существуют реагирующие на раздражители синтетические полимерные материалы, которые способны воспринимать и реагировать на различные условия окружающей среды (определенные химические вещества, pH, свет и температура). Такие полимеры используются в терапии, доставке лекарств, биомедицинских устройствах, биосенсорах, электронике и в мягкой робототехнике. Однако в большинстве случаев способность этих материалов реагировать с высокой специфичностью и давать желаемый результат ограничена природой доступных стимулов и спецификой химически обусловленного ответа. Поэтому разработка чисто синтетических материалов ограничена сочетанием доступных внешних сигналов, а также степенью и характером реакции материала.
В отличие от традиционных синтетических материалов, биологические системы естественным образом реагируют и адаптируются к окружающей среде и могут генерировать биопродукты с широким спектром функций. Недавний прогресс в синтетической биологии позволяет создавать и манипулировать клеточными сигнальными путями для регуляции экспрессии генов для конститутивного или индуцированного (в ответ на стимул окружающей среды) производства желаемого биосинтетического продукта.
Одной из достаточно молодых областей синтетической биологии является разработка ELM (от engineered living material), т. е. синтетических живых материалов. По сравнению с синтетическими материалами, реагирующими на раздражители, в ELM используются генетически модифицированные биологические компоненты, интегрированные в композитный материал для получения функциональных результатов в ответ на сигналы окружающей среды. В разработке ELM используются разнообразные микроорганизмы, включая бактерии, дрожжи, грибы и водоросли. Некоторые примечательные примеры включают изготовление кожных пластырей для заживления ран, чувствительных к поту биогибридных тканей, биоразлагаемого аквапластика, включение хлоропластов в самовосстанавливающиеся гидрогели и фотосинтетические генераторы O2 для повышения жизнеспособности клеток млекопитающих.
Хотя потенциал ELM огромен, существуют серьезные проблемы в их разработке, включая необходимость создания генетически стабильных сконструированных штаммов, разработку материалов для поддержки роста и жизнеспособности сконструированных клеток в течение длительных периодов времени, а также программирование клеток быть чувствительными к раздражителям на границе материала. Таким образом, подходящее сочетание биологических компонентов и полимерных материалов имеет решающее значение для разработки любого ELM, реагирующего на стимулы.
В рассматриваемом нами сегодня труде ученые описывают создание новых чувствительных к стимулам ELM, которые обеззараживают химические загрязнители, регулируя выработку фермента лакказы. Кроме того, ученые создали цианобактерии, которые имеют «выключатель уничтожения» и демонстрируют индукцию литической гибели клеток при активации рибопереключателя, ограничивая биообрастание в случае выщелачивания клеток из ELM. Как заявляют авторы разработки, ELM, представленный в этом исследовании, реагирует на химические стимулы с фенотипически сложными результатами, превосходящими те, которые могут быть достигнуты в полностью синтетической системе.
Результаты исследования
Для данного исследования было изготовлено несколько ELM, содержащих сконструированные штаммы S. elongatus, экспрессирующие гетерологичные белки. Также были исследованы свойства материала, жизнеспособность клеток и биологическая активность композиционных материалов.
ELM были сконструированы так, чтобы содержать штаммы S. Elongatus, сконструированные для экспрессии различных белков под регуляцией теофиллин-чувствительного рибопереключателя, чтобы продемонстрировать фотосинтетические биоматериалы, реагирующие на стимулы.

Изображение №1
Выше представлена схема изготовления ELM, в котором генно-инженерные клетки цианобактерий сочетаются с альгинатным полимером для создания гидрогелевого композитного материала, напечатанного на 3D-принтере. Интересующий ген в клетках активируется присутствием индукторной молекулы (вход), продуцирующей конкретный интересующий белок (выход).
Чтобы создать сложные геометрические клеточные каркасы, ученые изготовили наполненные клетками полимерные гели, используя методы аддитивного производства с прямым чернильным письмом (DIW от direct-ink-writing). Наряду с прозрачностью и пористостью гидрогелевого материала, еще одним важным преимуществом использования гелевых чернил является способность защищать клетки от механического напряжения сдвига во время процесса экструзии. Эта стратегия сводит к минимуму повреждение клеточных мембран, повышая жизнеспособность клеток.
Идентификация биосовместимого и пригодного для печати полимера имеет решающее значение при инкапсуляции микроорганизмов в любую матрицу, напечатанную на 3D-принтере. Первоначальные эксперименты по оптимизации были проведены для определения подходящего материала для инкапсулирования клеток цианобактерий, который будет поддерживать рост и жизнеспособность клеток при температуре и уровнях освещенности окружающей среды. Было протестировано несколько природных и синтетических полимеров, способных образовывать гидрогели. В результате был выбран альгинатный гидрогель.
Прозрачность гидрогеля обеспечивает проникновение света, а наличие относительно крупных пор внутри матрицы облегчает диффузию газа и питательных веществ. Эти свойства и способность удерживать воду делают альгинат отличным кандидатом для фотосинтетических ELM. Альгинат — это природный полисахарид из морских водорослей, состоящий из β-D-маннуроновой кислоты и α-L-гулуроновой кислоты, который физически сшит с помощью двухвалентных катионов.
Оптимальным условием для сшивки альгината и возможности печати при комнатной температуре была определена смесь 4% (масса/объем) раствора альгината по массе с суспензией 50 мМ CaSO4 в соотношении 2:1, в результате чего в конечном итоге получилось 2.67% раствор альгината в 16.67 мM CaSO4.
Важным шагом в DIW печати является получение материала с подходящей вязкостью, чтобы печатная структура могла сохранять свою форму после печати. Это свойство было достигнуто путем добавления раствора 100 мМ CaCl2 к гидрогелевому каркасу после печати на 15 минут для укрепления и стабилизации структуры геля. Состав чернил был достаточно стабильным, чтобы сохранять свою форму для различных паттернов и состоял из 5–17 слоев биочернил.
Далее были проведены реологические измерения для проверки механических свойств гидрогеля, напечатанного на 3D-принтере, с клетками S. elongatus дикого типа (WT от wild type) и без них. Гели продемонстрировали способность к истончению при сдвиге, что является ключевым требованием для DIW печати.
Хотя чернила с высокой вязкостью благоприятны для повышения разрешения печати, слишком высокая вязкость может привести к засорению печатающей иглы и снижению жизнеспособности клеток. В этом исследовании засорение иглы наблюдалось, когда концентрации альгината превышали ~3% мас./об., что подчеркивает необходимость баланса между пригодностью для печати, целостностью гидрогеля, а также ростом и жизнеспособностью клеток.

Изображение №2
За семь дней роста биомасса клеток WT S. elongatus в различных гидрогелевых конструкций становилась заметно плотнее (на что указывает темно-зеленая окраска). Однако конструкции с низким соотношением площади поверхности к объему, такие как конструкция диска (диаметр 2 см), приводили к уменьшению биомассы по направлению к центру гидрогеля, что указывает на ограничение обмена газа и/или питательных веществ (2a). По этой причине последующие эксперименты были проведены с использованием гидрогелей, напечатанных с сеткой 29 × 29 мм, чтобы добиться более высокого соотношения площади поверхности к объему и улучшения массопереноса.
FESEM (от field emission scanning electron microscopy) снимки геля показали пористую природу гидрогелевого каркаса (2b-i и 2b-ii) с видимыми размерами пор от менее 40 мкм до более 60 мкм. Микрофотографии гидрогелей, напечатанные биочернилами, иллюстрируют комбинацию отдельных клеток и колоний клеток, прикрепленных к поверхности гидрогеля (2b-iii и 2b-iv).
Учитывая, что средний размер клеток S. elongatus составляет примерно 2 мкм, а размеры пор часто превышает 60 мкм, диаметр пор не является ограничением роста цианобактерий внутри матрицы.
Видео №1
Чтобы визуализировать соотношение жизнеспособных и мертвых клеток в биопечатной матрице, полученные гидрогели визуализировали с помощью конфокальной микроскопии для определения автофлуоресценции хлорофилла и гибели клеток с использованием SYTOX Blue, синего красителя нуклеиновой кислоты, который проникает в клетки с поврежденными клеточными мембранами (2c). Красные флуоресцентные пятна, указывающие на здоровые колонии цианобактерий, были видны по всему гидрогелю в течение семи дней роста, тогда как синие пятна, указывающие на мертвые клетки, были распределены в гидрогеле неоднородно. Оценка жизнеспособности клеток на основе анализа конфокальных изображений гидрогеля, содержащего WT S. elongatus, показала, что 94.9 ± 2.2% и 76.8 ± 8.2% от общего числа клеток являются жизнеспособными на день 0 и день 7 после печати соответственно.
Для оценки фотосинтетической активности живых гидрогелей микроокружение О2 и оборот О2 измеряли на свету и в темноте с помощью микросенсоров О2. Выделение O2 было обнаружено у устойчивого к антибиотикам штамма S. Elongatus (SpRSmRGmR), который используется в качестве контрольной группы. Микросенсоры O2 выявили активно фотосинтезирующее и гипероксическое микроокружение на поверхности живых гидрогелей. Для гидрогеля, содержащего клетки дикого типа (SpRSmRGmR), средняя концентрация O2 вблизи поверхности составляла 346 ± 4.9 мкМ SE при падающем излучении 80 мкмоль фотонов на м2 в секунду. Чистый фотосинтез (2d), наблюдаемый для штамма дикого типа (SpRSmRGmR), составил 0.031 нмоль O2 на см2 в секунду. В гидрогеле без клеток выделения кислорода не было.
В темноте гидрогели, инкапсулирующие штамм дикого типа (SpRSmRGmR), демонстрировали ограниченную дыхательную активность, а концентрации O2 были близки к значениям окружающей морской воды.
Измерения переменной флуориметрии хлорофилла были выполнены для определения фотосинтетической эффективности живых гидрогелей в диапазоне режимов облучения. Для штамма S. elongatus дикого типа (SpRSmRGmR) фотосинтез был насыщен между 200 и 250 мкмоль фотонов на м2 в секунду с интенсивностью излучения в начале насыщения ~ 85 мкмоль фотонов на м2 в секунду, что указывает на адаптацию к низкой освещенности. Транспорт электронов с фотонами выше 250 мкмоль на м2 в секунду был полностью ингибирован.
Хотя гидрогели, содержащие S. elongatus, могли расти при низкой начальной плотности клеток при слабом и умеренном освещении, рост останавливался в образцах, выращенных при облучении более 300 мкмоль фотонов на м2 в секунду. Поскольку уровень солнечной радиации на поверхности Земли может достигать примерно 2000, свеженапечатанные биокомпозиты, скорее всего, пострадают в естественных условиях высокой освещенности. Однако водная среда, такая как озера и реки, часто содержит большие концентрации цветных растворенных органических веществ, которые быстро ослабляют свет с глубиной, обеспечивая благоприятную среду для исследуемых ELM.

Изображение №3
Чтобы выяснить, могут ли клетки, выращенные внутри гидрогеля, реагировать на внешний химический стимул, S. elongatus трансформировали плазмидами pAM4909, pAM5027 и pAM5057, чтобы получить штаммы YFP+ (положительный контроль конститутивной экспрессии YFP), YFP- (отрицательный контроль) и RiboF-YFP+ (экспрессия YFP, регулируемая рибопереключателем).
Схема генетической цепи RiboF-YFP+ показана на 3a: сконструированный штамм S. elongatus реагирует на химический индуктор теофиллин из окружающей среды конформационным изменением мРНК, несущей Riboswitch-F, которая регулирует трансляцию репортерного белка YFP. Конструкция YFP+ содержит конститутивный промотор conII, управляющий экспрессией YFP.
После обработки 1 мМ теофиллина в диметилсульфоксиде (DMSO) или контрольном носителе 1% DMSO в течение 24 часов экспрессию YFP определяли качественно внутри гидрогеля с помощью флуоресцентной микроскопии (3b). Никакой флуоресценции YFP не наблюдалось в гидрогелях, содержащих штамм YFP-. Конститутивную флуоресценцию YFP наблюдали в гидрогелях, содержащих штамм YFP+, в среде, содержащей либо 1 мМ теофиллина, либо 1% DMSO. Для гидрогелей, содержащих штамм RiboF-YFP+, рост в 1 мМ теофиллина давал такие же уровни флуоресценции, как и у гидрогелей, содержащих контрольный штамм YFP+, тогда как флуоресценция YFP не была обнаружена в гидрогелях с добавлением 1% DMSO.
Чтобы оценить, могли ли жизнеспособные сконструированные клетки просочиться из гидрогеля в окружающую среду, среду из 5-дневных гидрогелей, содержащих штаммы YFP-, YFP+, RiboF-YFP+ или WT, инкубировали с 1 мМ теофиллина или 1% DMSO в течение 24 часов, а флуоресценцию YFP определяли количественно с помощью флуоресцентного планшет-ридера. В супернатантах образцов RiboF-YFP+, индуцированных теофиллином, было обнаружено ~16.8-кратное увеличение флуоресценции по сравнению с неиндуцированным образцом (3c). Никакой существенной разницы не наблюдалось между индуцированными и неиндуцированными образцами супернатантов всех других гидрогелей.
Присутствие жизнеспособных клеток в окружающей среде можно объяснить низким уровнем диффузии клеток посредством механического перемешивания в водном растворе по всему гидрогелю и на границе раздела гидрогель-среда, что приводит к медленному высвобождению клеток.
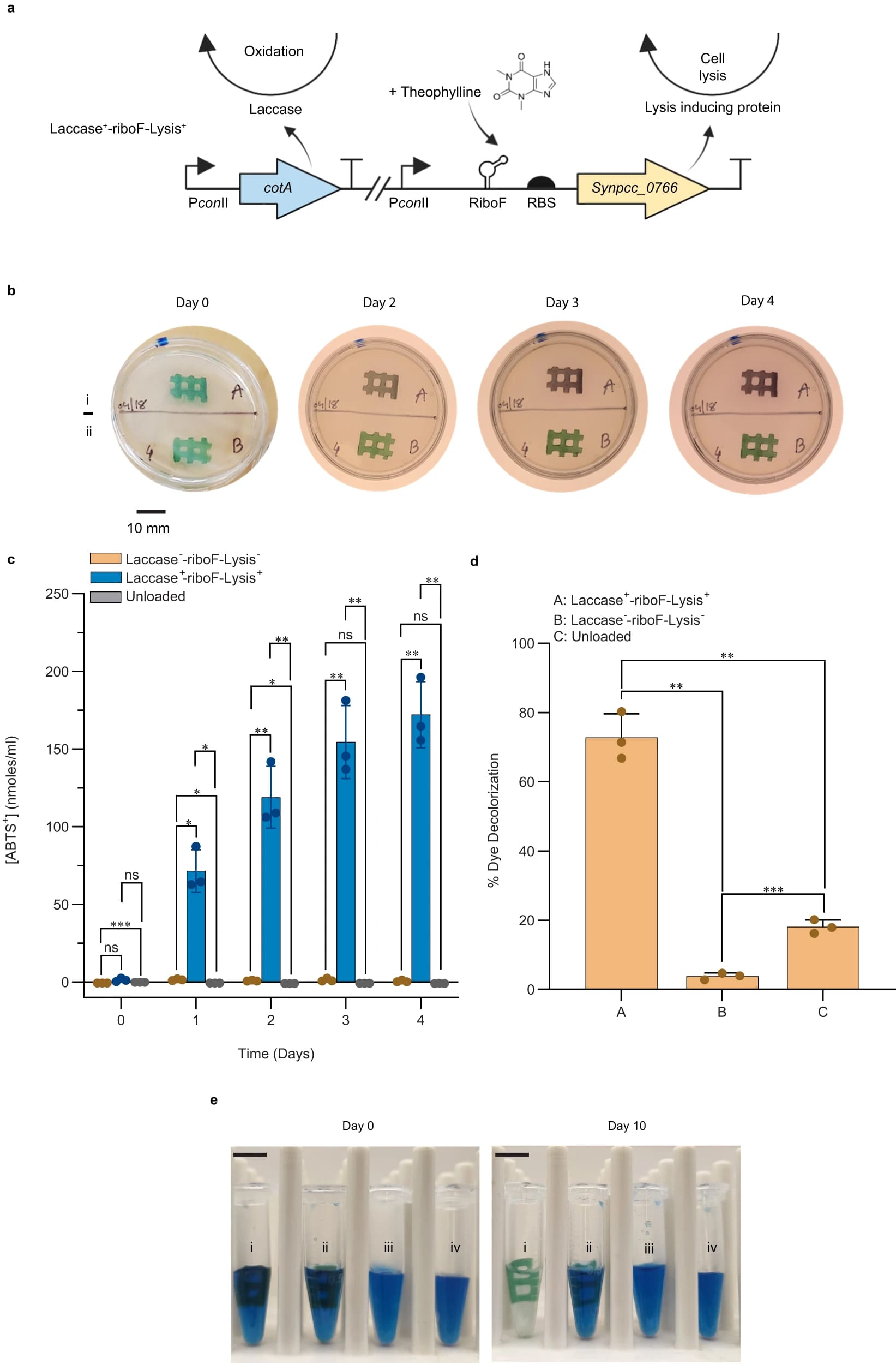
Изображение №4
Для создания живых гидрогелей, пригодных для биоремедиации, был сконструирован штамм, способный конститутивно продуцировать фермент лакказу с дополнительной особенностью индуцируемой гибелью клеток. Лакказа CotA из Bacillus subtilis была выбрана, поскольку обширные исследования по характеристике медь-зависимого фермента продемонстрировали ее способность окислять синтетические красители.
Была сконструирована плазмида интеграции хромосомы нейтрального сайта 2 (NS2) (pAM5825), которая кодирует фермент лакказы (CotA), экспрессируемый конститутивным промотором conII, и эта конструкция была вставлена в хромосому S. Elongatus. В ответ на наблюдаемый базальный уровень утечки клеток из гидрогелей с течением времени была разработана система для индуцируемой гибели клеток как механизма, позволяющего минимизировать возможность загрязнения и биообрастания ELM. Сверхэкспрессия нативного гена S. elongatus Synpcc7942_0766 приводит к удалению профага из генома S. elongatus, вызывая клеточный лизис.
В дополнение к pAM5825 была сконструирована и вставлена в хромосому S. Elongatus плазмида интеграции нейтрального сайта 1 (NS1) (pAM5829), содержащая рибопереключатель, реагирующий на промотор conII и теофиллин, расположенный выше копии гена S. elongatus Synpcc7942_0766 на NS1. В результате был получен штамм Laccase+-riboF-Lysis+ (4a).
Концентрации O2 на поверхности гидрогеля, а также выделение кислорода и скорость дыхания гидрогелей, заключенных в Laccase+-riboF-Lysis+, были аналогичны гидрогелям, заключенным в штамм дикого типа (SpRSmRGmR). Также были подтверждены генотипическая характеристика и экспрессия фермента CotA массой 52 кДа.
Далее ученые провели тест активности ABTS-лакказы для напечатанных моделей Laccase+-riboF-Lysis+ и контрольных моделей Laccase--riboF-Lysis-.
Лакказную активность тестировали по отношению к ABTS как внутри гидрогеля ELM, так и из окружающего раствора. Гидрогели сначала отделяли от окружающей их среды (BG-11) и погружали в реакционную буферную смесь с 2 мМ ABTS. После 1 часа инкубации набор гидрогелей, содержащих Laccase--riboF-Lysis- и Laccase+-riboF-Lysis+, насыщенный раствором ABTS, удаляли, помещали на поверхность стерильных агаровых чашек LB и оставляли инкубироваться на 4 дня (4b).
В течение 4-дневного периода в гидрогеле Laccase+-riboF-Lysis+ развивалась фиолетовая окраска, свидетельствующая об окислении ABTS, в то время как гидрогель, содержащий штамм Laccase--riboF-Lysis-, сохранял естественный зеленый оттенок, вырабатываемый цианобактериальными пигментами.
Для количественной оценки лакказной активности ELM в окружающем растворе набор гидрогелей (Laccase--riboF-Lysis-, Laccase+-riboF-Lysis+ и незагруженные гели) погружали в буферный раствор, содержащий ABTS, и инкубировали в течение 4 дней с ежедневным отбор проб для количественного определения окисления ABTS в реакционном буфере (4c).
Через 24 часа 71.5 ± 13.6 нмоль/мл ABTS было окислено гидрогелем Laccase+-riboF-Lysis+. Небольшой, но значимый уровень активности наблюдался и в Laccase--riboF-Lysis- по сравнению с контрольным ненагруженным гелем. В течение 4 дней инкубации уровень окисленного ABTS из гидрогеля Laccase+-riboF-Lysis+, увеличился до 172.0 ± 21.3 нмоль/мл, что значительно превышало показатели двух других типов гелей.
Чтобы оценить, выходит ли фермент CotA из гидрогеля посредством секреции или лизиса клеток внутри геля, лакказную активность супернатанта среды, окружающей гидрогели, измеряли в образцах, взятых через пять дней после печати. Активность, наблюдаемая в супернатанте, окружающем гидрогели, содержащие Laccase+-riboF-Lysis+, была значительно выше, чем активность либо содержащих Laccase--riboF-Lysis-, либо ненагруженных гелей.
Чтобы оценить, могут ли гидрогели, содержащие сконструированные штаммы Laccase+-riboF-Lysis+, служить инструментом для биоремедиации, образцы были проанализированы на их способность обесцвечивать обычный загрязнитель из текстильных красителей, а именно индигокармин. Гидрогели через 5 дней после печати погружали в раствор BG-11, содержащий 0.1 мг/мл индигокармина. Обесцвечивание индигокармина впоследствии контролировали в течение 10 дней и количественно оценивали по поглощению при 612 нм (4d, 4e). Образцы Laccase+-riboF-Lysis+ гидрогеля показали среднее обесцвечивание 72.8 ± 6.8%, в то время как Laccase--riboF-Lysis- и незагруженный гидрогель показали 3.8 ± 1.0% и 18.1 ± 2.0% соответственно.
Гидрогель, содержащий Laccase+-riboF-Lysis+, успешно обесцвечивал ~70% индигокармина в течение 10 дней с дополнительным преимуществом, заключающимся в физическом удалении из системы без необходимости энергоемких шагов по очистке жидкой культуры, таких как центрифугирование.

Изображение №5
Как отмечают ученые, при разработке ELM следует учитывать непредвиденные последствия загрязнения окружающей среды биологическим компонентом ELM. Ген Synpcc7942_0766 при сверхэкспрессии приводит к удалению дефектного профага из генома S. elongatus, что приводит к клеточному лизису (5a). Гидрогели, содержащие штаммы Laccase+-riboF-Lysis+ или Laccase--riboF-Lysis- (контрольные), переносили в свежую среду после 5 дней начального роста и инкубировали еще 12 дней с добавлением 1 мМ теофиллина в DMSO, 1 % ДМСО или без добавок (5b).
После 12 дней роста визуальный осмотр показал, что накопление биомассы в окружающей среде отсутствовало в колбе, содержащей штамм Laccase+-riboF-Lysis+, дополненный 1 мМ теофиллина.
Временную шкалу ответа на индукцию гибели клеток в окружающей среде оценивали путем добавления свежих гидрогелевых супернатантов, содержащих клетки штаммов Laccase+-riboF-Lysis+ или Laccase--riboF-Lysis-, в 1 мМ теофиллина или 1% DMSO. Мониторинга роста культур проводился в течение четырех дней (5c).
В течение 48 часов эктопическая индукция Synpcc7942_0766 в штамме Laccase+-riboF-Lysis+, дополненном 1 мМ теофиллина, привела к снижению OD750, первоначально наблюдаемому в виде скоплений стареющего клеточного вещества, которые продолжали распадаться с образованием бледной мутной среды, что указывает на гибель культуры (5c, 5d).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые продемонстрировали новый тип синтетических живых материалов, созданные из полимера на базе морских водорослей и бактерий, которые были генетически модифицированы для производства фермента, преобразующего различные органические загрязнители в безопасные молекулы. Модификация бактерий заключалась в том, что они постоянно вырабатывали фермент, называемый лакказой. Ранее исследования показали, что лакказу можно использовать для нейтрализации различных органических загрязнителей, включая бисфенол А (BPA), антибиотики, фармацевтические препараты и красители.
В ходе практических испытаний ученые показали, что их разработка прекрасно справлялась с обеззараживанием загрязняющего вещества на основе красителя индигокармина, широко применяемого в текстильной промышленности для окраски джинсов.
Кроме того, данные бактерии были модифицированы таким образом, чтобы спустя определенное время «самоуничтожаться» в присутствии молекулы под названием теофиллин. Эта особенность позволяет удалить данный материал из водной среды, где он может применяться для очистки, после того как он выполнит свою задачу. В будущем ученые намерены улучшить данную систему, чтобы бактерии уничтожались без добавления каких-либо химических веществ.
Как отмечают авторы труда, данная разработка показывает, что совмещение усилий ученых, специализирующихся на материаловедении и биологических наук, позволяет создать нечто действительно уникальное. Не говоря уже о том, что подобного рода исследования обладают колоссальным потенциалом для улучшения экологической картины мира.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Комментарии (5)

vassabi
08.09.2023 07:15Для создания живых гидрогелей, пригодных для биоремедиации, был сконструирован штамм, способный конститутивно продуцировать фермент лакказу с дополнительной особенностью индуцируемой гибелью клеток.
вот так всё просто (плачет от счастья)


KonstantinSerov
Пост опубликован15 минут назад, и уже +10 к карме
placidity_master
очень странно, ведь после фразы:
дальше читать желание пропадает.
Чем обратный осмос не угодил ?
vassabi
давлением и материалом мембран?
placidity_master
можно чуть подробнее ? обратный осмос при 4 бар даёт неплохой поток даже на дешёвых вариантах, материал вроде типичный полимер, коих в бутылках и тетрапаках полно.