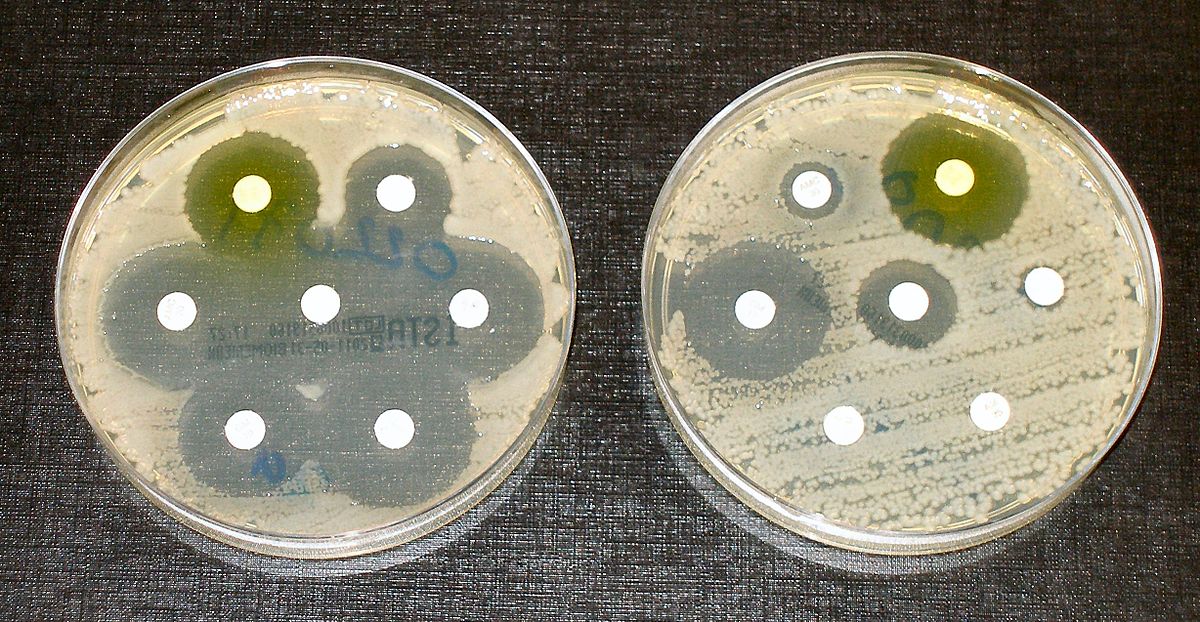
Ну что, ребята, порадуемся новому достижению, которое, как поговаривают, стало светом в конце туннеля?
Проблема антибиотикорезистентности не раз обсуждалась на geektimes, в том числе и мной.
Широкое, неоправданное применение этих лекарственных препаратов как в клинической практике, так и в сельском хозяйстве привело к появлению микроорганизмов, устойчивых ко всем типам существующих антибиотиков.
Люди, не имеющие отношения к медицине, не знают, что в стационарах таких стран, как, к примеру, Беларусь и Российская Федерация, катастрофа происходит прямо сейчас. Из-за отсутствия должного эпидемиологического надзора, неумелого применения лекарственных средств, недостатка финансирования, отсутствия грамотного микробиологического сопровождения (нет нормальных микробиологов и оборудования для определения минимальных ингибирующих концентраций (МИК)*), и, что важно, из-за всеобщего преступного сокрытия существующей проблемы, люди то тут, то там гибнут от внутрибольничных инфекций** (ВБИ), вызванных такими микроорганизмами.
Пока ВБИ не вырвались за пределы больничного порога, а мы — не попали на него, можно делать poker face и не замечать этот надвигающийся пиздец, который подкрался совсем не незаметно.
Тем не менее, те самые ненасытные фармацевтические компании, движимые исключительно алчными максимизаторами прибыли, совершили
Об этом я и хочу вам немного рассказать.
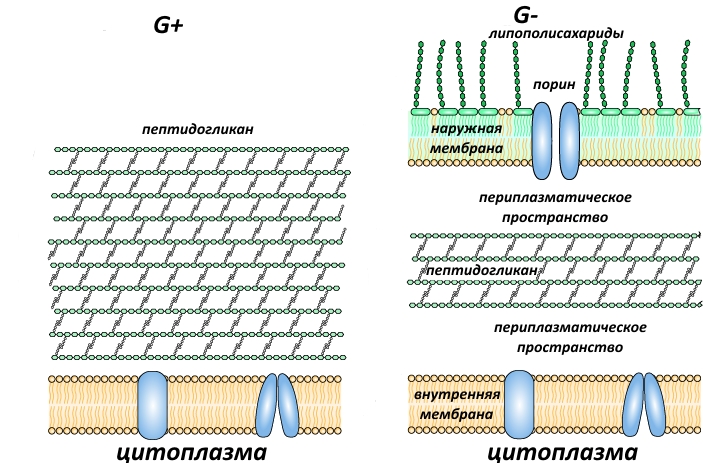
Среди важных устойчивых к антибиотикам микроорганизмов, которые легко запоминаются аббревиатурой ESKAPE, наибольшую сложность для клиницистов представляют грамотрицательные микроорганизмы (далее G-).
Особенностью этих бактерий является наличие у них 2 мембран, внешней и внутренней, которые затрудняют проникновение антибиотиков внутрь их клеток. Все те антибиотики, что в последние 50 лет выходили на рынок, являлись перепевами, то есть модификациями тех давно открытых классов, которые, как уже было сказало, на микробную клетку действовать перестали. И потребность в новых решениях не просто назрела, а даже перезрела.
Одной из распространённых стратегий по разработке лекарственных средств является поиск подходящего природного соединения с хотя бы минимальной активностью и последующая его модификация для усиления нужных свойств. В данном случае так и поступили.
Внимание было обращено на так называемые ариломицины — класс макроциклических липопептидов, которые ингибируют бактериальную сигнальную пептидазу 1-го типа (СП I). Надо сказать, этими ариломицинами интересовались уже как 20 лет, но это не вылилось в какие-либо существенные успехи. Вероятно потому, что исследователи занимались преимущественно CП I грамположительных микроорганизмов (далее — G+).

Прежде чем продолжить, надо сделать несколько пояснений для неискушённой публики, составляющей, как я понимаю, 99,9 % моей аудитории.
Что такое макроциклический липопептид?
Макроциклами в химии называют соединения, в которых есть циклы, образованные не менее 12 атомами. Пептид — это соединение, которое состоит из небольшого количества аминокислот. Корень липо-, как можно догадаться, означает наличие в молекуле некой липидной части, остатка жирной кислоты в данном случае.


Что такое сигнальная пептидаза?
Пептидаза — это фермент класса гидролаз, расщепляющая белки. Результат работы гидролаз полностью аналогичен неферментативному гидролизу, то есть процессу, протекающему под действием воды.
Итак, СП I расщепляет белки. Но почему она называется сигнальной?
В любой клетке, не обязательно бактериальной, есть множество белков, которые для выполнения своей функции должны находиться не непосредственно в цитоплазме, а в самой клеточной мембране или даже за её пределами. Для того, чтобы отличить их от других белков, которым за пределами цитоплазмы находиться не требуется, клетка в процессе трансляции помечает их специальной сигнальной последовательностью аминокислот, которая служит для мишенью для транспортных механизмов, которые помогают перемещать белок в мембрану или за её пределы. Соответственно СП отрезают это сигнальные последовательности в ходе такого перемещения, превращая «недобелок» в зрелый функциональный полипептид.
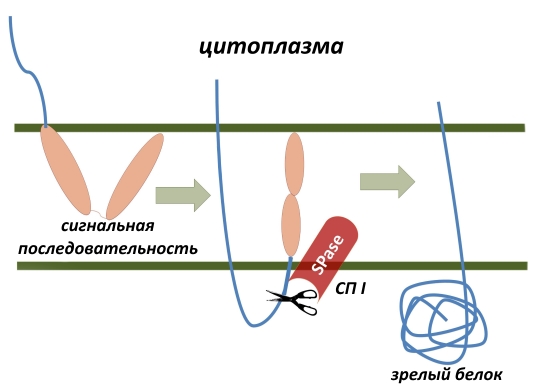
Собственно, отсюда и понятен интерес к СП как к мишени лекарственных препаратов. В случае, если сигнальная часть аминокислотной последовательности не будет во время отрезана, нормальной белковой молекулы клетка так и не получит со всеми вытекающими последствиями в соответствии с определением жизни по Энгельсу.
Итак, СП I расщепляет белки. Но почему она называется сигнальной?
В любой клетке, не обязательно бактериальной, есть множество белков, которые для выполнения своей функции должны находиться не непосредственно в цитоплазме, а в самой клеточной мембране или даже за её пределами. Для того, чтобы отличить их от других белков, которым за пределами цитоплазмы находиться не требуется, клетка в процессе трансляции помечает их специальной сигнальной последовательностью аминокислот, которая служит для мишенью для транспортных механизмов, которые помогают перемещать белок в мембрану или за её пределы. Соответственно СП отрезают это сигнальные последовательности в ходе такого перемещения, превращая «недобелок» в зрелый функциональный полипептид.

Собственно, отсюда и понятен интерес к СП как к мишени лекарственных препаратов. В случае, если сигнальная часть аминокислотной последовательности не будет во время отрезана, нормальной белковой молекулы клетка так и не получит со всеми вытекающими последствиями в соответствии с определением жизни по Энгельсу.
В G+ СП I находится в цитоплазматической мембране таким образом, что её часть торчит наружу и вполне доступна ариломицинам. Однако в G- она находится в периплазматическом пространстве, и долго исследователи считали, что ариломицины проникать через наружную мембрану не могут, поэтому нечего и пытаться. Не будьте как исследователи!
Оказалось, что ариломицины всё же могут проникать через наружную мембрану, просто СП I G- имеет мутацию в одном из своих доменов (часть белковой молекулы с определённой функцией или определённым положением относительно остальных доменов), что делает её мало уязвимой для данного класса ингибиторов.
Поэтому возникла идея путём модификации природной молекулы добиться 2 вещей:
а) улучшить проникновение ариломицина через наружную мембрану;
б) усилить связывание молекулы модифицированного антибиотика с СП I для усиления бактерицидного эффекта.
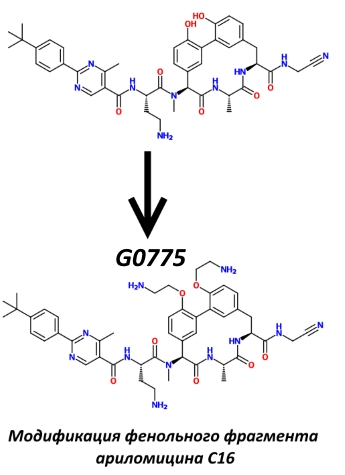
Посмотрим, как это удалось достичь команде из фармацевтической компании Genentech, взявшей в качестве прототипа ариломицин С16 (А-С16).
Во-первых, после изучения рентгенограмм комплекса СП I с А-С16 стало ясно, что макроциклическая часть А-С16 связывается с консервативной частью белковой молекулы СП I, что привело исследователей к выводу о том, что «трогать» её не следует.
Во-вторых, было известно, что природные ариломицины, отличающиеся жирнокислотными хвостами, обладают разной антимикробной активностью, да и в А-С16 он не оптимален для взаимодействия с СП I. Таким образом, было решено модифицировать этот фрагмент А-С16. Часть аминокислотных звеньев заменили диаминомасляной кислотой, а остаток пальмитиновой кислоты — сложным ароматическим заместителем. В итоге этих манипуляций активность в отношении G- несколько улучшилась.
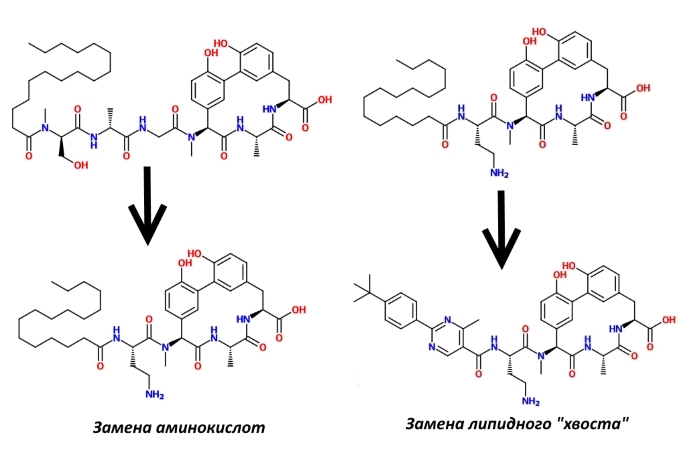
В-третьих, также было известно, что на бактерицидную активность влияет и С-конец ариломицинов, то есть последняя аминокислота в цепочке. Химики Genentech заменили в модифицированной на втором этапе молекуле карбоксильную группу на 2-аминоацетонитрильную. Это привело к тому, что, как полагают исследователи, аминокислота лизин, находящаяся в активном центре СП I, теперь связывается с ингибитором прочной ковалентной связью, в результате активный центр фермента надолго остаётся заблокированным. Таким образом, контакт двух молекул, белка и низкомолекулярного ариломицина, удлиняется, а бактерицидная активность последнего повышается.
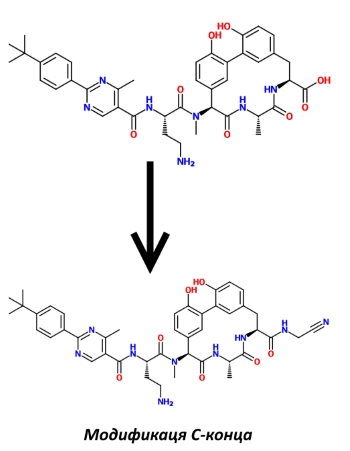
И, наконец, в-четвёртых, было решено пожанглировать гидроксильными группами фенольных остатков, так как, опять же, по литературным данным, их модификация изменяла активность родственных соединений. В итоге на них были навешаны диметиленаминовые группы, что ещё больше снизило минимальную ингибирующую концентрацию не только в отношении G-, но и в отношении G+ группы ESKAPE.
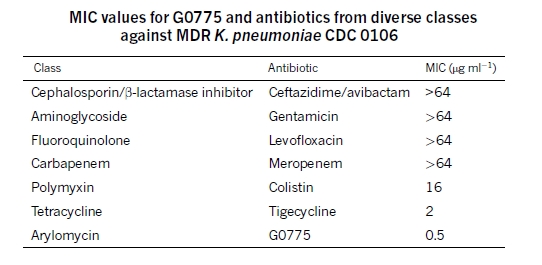
Как оказалось, полученное соединение под кодовым номером G0775 оказалось высоко активным и по отношению к обитающим в клинике зубастым зверушкам (а не только лабораторным штаммам), обладающим устойчивостью ко многим классам известных антибиотиков. Иллюстрацией может служить следующая табличка по сравнению МИК разработанного соединения с МИК других антибиотиков в отношении антибиотикорезистентного штамма клебсиеллы:
Помимо микробиологических данных в статье приведены исследования разработанного антибиотика на инфицированных мышках, которые подтверждают безопасность и эффективность нового лекарственного препарата и, будем надеяться, послужат отправной точкой для его внедрения в клиническую практику.
Теперь немного собственных размышлений в заключении.
Безусловно, как я и писал метафорически во введении, новый класс антибиотиков, если он и будет внедрён в клиническую практику (а идти на регистрацию благодаря творящемуся в Америке пиздецу с ВБИ он будет явно по сокращённой программе), не станет панацеей. Мутационную изменчивость никто не отменял. В самой статье, кстати, было продемонстрировано образование устойчивых к G0775 штаммов при длительном контакте бактерий с высокими дозами антибиотиков. И боюсь, если ничего из той разрухи, которая творится в головах власть придержащих и тех, кто находится на верхних этажах управленческой пирамиды в здравоохранении, не изменится, G0775 так и останется в памяти клиницистов как непродолжительная светлая полоса в череде тщательно скрываемых смертей от ВБИ.
С химической точки зрения, на мой взгляд, статья не представляет собой ничего сверхъестественного. И тем не менее, несмотря на то, что использованный подход является в drug development классикой, смею утверждать, что, к примеру, в многих странах такого рода разработка по многим причинам просто невозможна.
Во-первых, думаю, что сам бюджет компании Genentech превышает бюджет некоторых стран в несколько раз. Во-вторых, как это следует из моего краткого изложения, для разработки новых лекарств нужно использовать мультидисциплинарный подход, который невозможен в напрочь забюрократизированной среде. Конкретно в данном случае исследованиями занималось 9 различных подразделений компании: микробиологи, химики, фармацевты, структурные биологи, биоинформатики и другие.
Обратите внимание: фактически Genentech использовал для своей работы по направленной модификации ариломицинов данные, уже известные из литературы. Увы и ах, в постсоветских странах найдётся не так много научные коллективов, которые могут следить за тем, что происходит в их области на международном уровне и успешно интегрировать мировой опыт в свои достижения в том числе и по банальной причине: не могут читать специализированную литературу на английском.
Да, мне хочется надеяться, что такие слагаемые успеха Genentech, как упорство в достижении цели и вера в свои силы, за пределами биг-фармы ещё остались, но абсолютно очевидно, что в современном динамичном мире система, пытающаяся всеми силами жить прошлым, обречена на неудачу.
*минимальная игибирующая концентрация (МИК) — минимальная концентрация антибиотика, которая подавляет размножение микроорганизма.
**внутрибольничные инфекции (ВБИ) — клинически выраженные заболевания микробного происхождения, поражающие больного в результате его госпитализации или посещения лечебного учреждения с целью лечения, либо в течение 30 дней после выписки из больницы, а также больничный персонал в силу осуществления им деятельности, независимо от того, проявляются или не проявляются симптомы этого заболевания во время нахождения данных лиц в стационаре.
Для знакомства ситуацией по антибиотикорезистентности в Российской Федерации можно посмотреть ролик.
Резюме обсуждаемой статьи смотрите здесь.

