Не так давно нашей пресс-службой был подготовлен материал по исследованиям Ведущего ученого член корр. РАН, д.ф. – м.н. Хазанова Ефима Аркадьевича. Интервью ведущего ученого было опубликовано на множестве ресурсов, с некоторыми из них можно ознакомиться, пройдя по следующим ссылкам: Диагностировать и лечить рак поможет лазер и Профессор Хазанов: «скоро мы научимся лечить раковые клетки лазером». Речь шла об инновационном способе диагностики и лечении онкозаболеваний при помощи лазерно-плазменного ускорителя протонов. Для полноценного погружения в суть исследования мы попросили ведущего научного сотрудника Константина Юшкова рассказать, как и на каком оборудовании происходит сам процесс исследования и создание прототипа.
Под катом Вы найдете много информации о проекте, оборудовании, уникальности исследования. Мы подготовили фоторепортаж, который описывает систему гиперспектрального анализа и лазерного исследования микроскопических препаратов и раскрывает её значение.

Лаборатория «Физические методы акустооптическая и лазерная аппаратура для задач диагностики и терапии онкологических заболеваний»
На базе новой лаборатории НИТУ «МИСиС» под руководством доктора физико-математических наук, член-корреспондента РАН Ефима Хазанова, Институт прикладной физики РАН, разрабатываются способы диагностики и терапии онкологических заболеваний с помощью лазерных технологий и создается компонентная база для лазерно-плазменного ускорителя протонов, одним из приложений которого является терапия рака.
Научный коллектив лаборатории объединил усилия ведущих специалистов в области акустооптики и систем обработки изображений (НИТУ «МИСиС»), лазерной физики (ИПФ РАН, г. Нижний Новгород), онкологии (ЭНЦ РАМН, Биологический факультет МГУ им. М.В. Ломоносова), кристаллофизики (ТвГУ, г. Тверь). В рамках реализации проекта был создан уникальный комплекс научно-исследовательской аппаратуры, позволяющий проводить исследования в области биомедицинской оптики.
Своей основной целью лаборатория ставит создание новых акустооптических систем гиперспектральной лазерной флуоресцентной диагностики онкологических заболеваний и акустооптических приборов для фемтосекундных лазерных комплексов адронной терапии онкологических заболеваний. Данный проект представляет уникальное сочетание современных разработок в области оптики и лазерной физики с применениями в биомедицинской области (онкологии). Актуальность поставленных задач обусловлена направленностью на создание ключевых компонентов нового поколения установок адронной терапии онкологических заболеваний, основанных на компактных лазерных источниках и ускорителях заряженных частиц высоких энергий. Также в проекте решается задача формулирования новых диагностических критериев при дифференциальной диагностике и определении злокачественности опухолей человека.
Результаты, которые были достигнуты коллективом лаборатории:
1. Создан экспериментальный прототип акустооптической гиперспектральной системы с возможностью пространственной фильтрации и оконтуривания изображений.
2. Создан лазерный драйвер фотокатодов для инжекции электронов с акустооптической системой управления ультракороткими лазерными импульсами.
3. Исследования в области акустики и оптики анизотропных сред позволили определить оптимальные конфигурации широкоапертурных и квазиколлинеарных акустооптических фильтров на основе монокристаллов парателлурита.
4. Проведены гиперспектральные исследования флуоресцентного излучения опухолевых тканей щитовидной железы человека.
5. Разработаны методы формирования произвольных спектральных функций пропускания акустооптических фильтров.
Система гиперспектрального анализа и лазерного исследования микроскопических препаратов
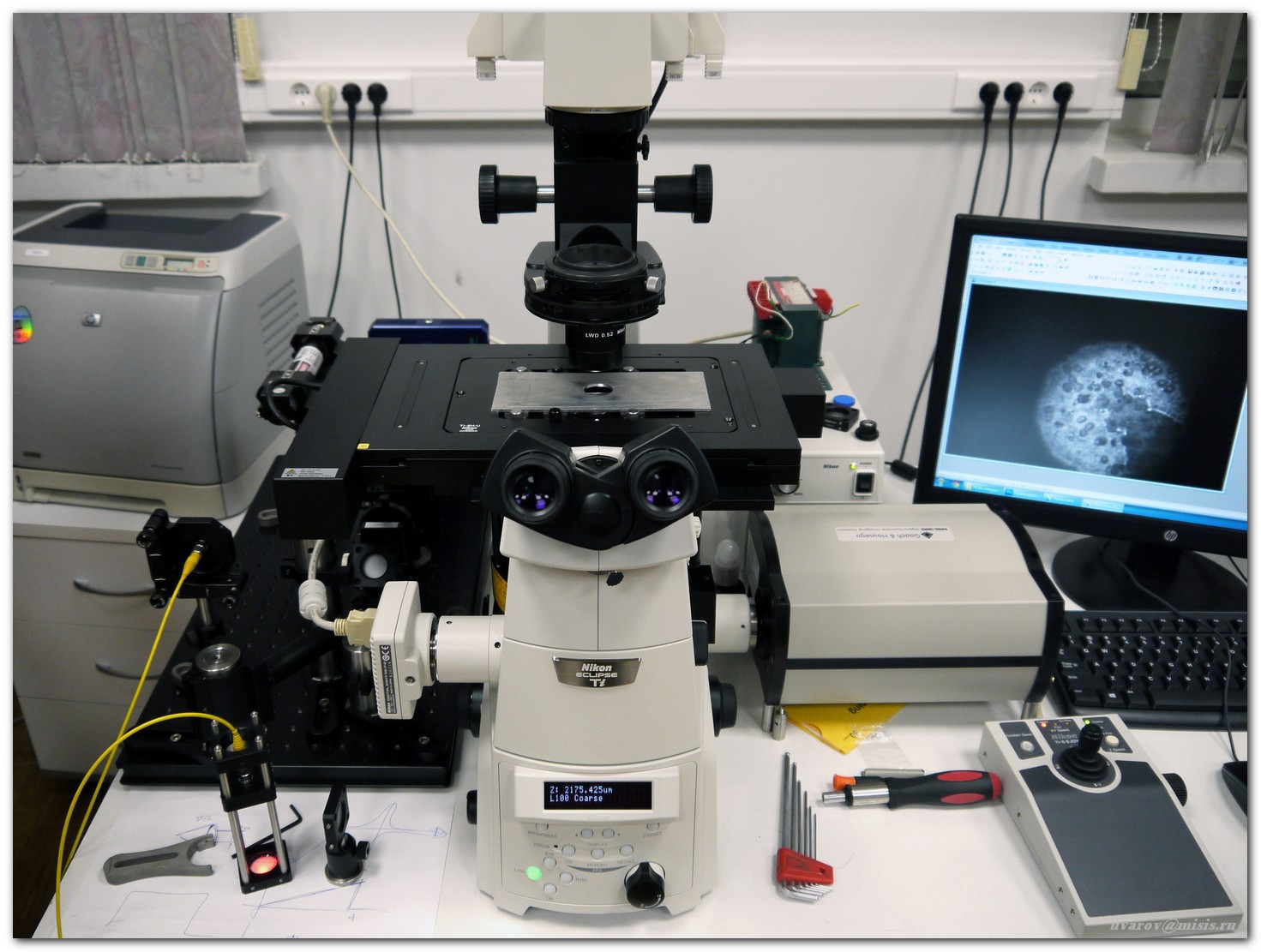
Система построена на базе инвертированного микроскопа Nikon Ti-E с набором объективов от 4x до 100х
 Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры
Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры
 Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа
Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа
 Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)
Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)
 Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект
Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект
 Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов
Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов
 В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром
В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром
 Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра
Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра
 Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображений
Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображений
 Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора
Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора
 Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.
Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.
 Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм.
Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм.
 Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа)
Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа)
 В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock
В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock
 Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе
Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе
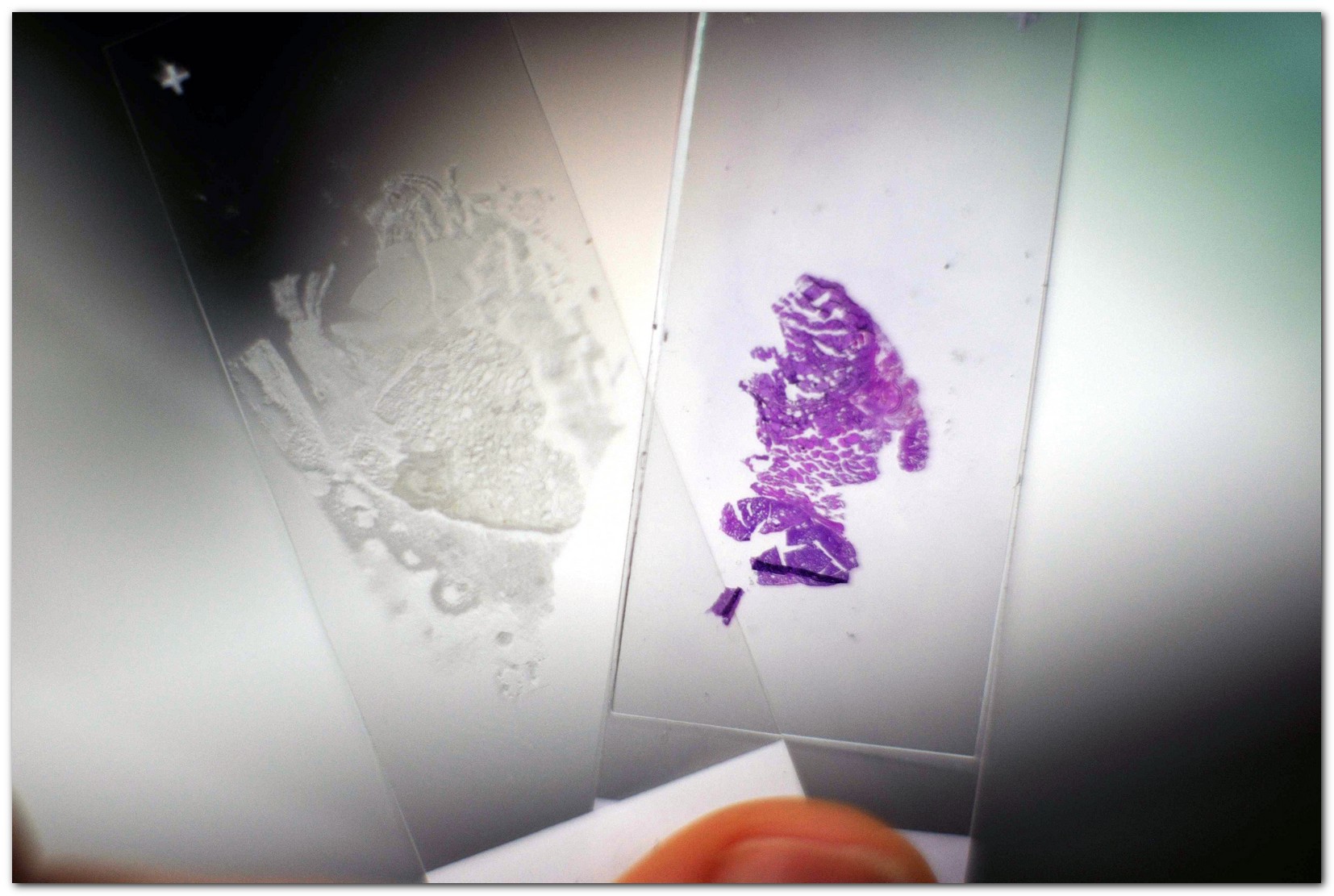 Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека
Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека
 Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной ткани
Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной ткани
Под катом Вы найдете много информации о проекте, оборудовании, уникальности исследования. Мы подготовили фоторепортаж, который описывает систему гиперспектрального анализа и лазерного исследования микроскопических препаратов и раскрывает её значение.

Лаборатория «Физические методы акустооптическая и лазерная аппаратура для задач диагностики и терапии онкологических заболеваний»
На базе новой лаборатории НИТУ «МИСиС» под руководством доктора физико-математических наук, член-корреспондента РАН Ефима Хазанова, Институт прикладной физики РАН, разрабатываются способы диагностики и терапии онкологических заболеваний с помощью лазерных технологий и создается компонентная база для лазерно-плазменного ускорителя протонов, одним из приложений которого является терапия рака.
Научный коллектив лаборатории объединил усилия ведущих специалистов в области акустооптики и систем обработки изображений (НИТУ «МИСиС»), лазерной физики (ИПФ РАН, г. Нижний Новгород), онкологии (ЭНЦ РАМН, Биологический факультет МГУ им. М.В. Ломоносова), кристаллофизики (ТвГУ, г. Тверь). В рамках реализации проекта был создан уникальный комплекс научно-исследовательской аппаратуры, позволяющий проводить исследования в области биомедицинской оптики.
Своей основной целью лаборатория ставит создание новых акустооптических систем гиперспектральной лазерной флуоресцентной диагностики онкологических заболеваний и акустооптических приборов для фемтосекундных лазерных комплексов адронной терапии онкологических заболеваний. Данный проект представляет уникальное сочетание современных разработок в области оптики и лазерной физики с применениями в биомедицинской области (онкологии). Актуальность поставленных задач обусловлена направленностью на создание ключевых компонентов нового поколения установок адронной терапии онкологических заболеваний, основанных на компактных лазерных источниках и ускорителях заряженных частиц высоких энергий. Также в проекте решается задача формулирования новых диагностических критериев при дифференциальной диагностике и определении злокачественности опухолей человека.
Результаты, которые были достигнуты коллективом лаборатории:
1. Создан экспериментальный прототип акустооптической гиперспектральной системы с возможностью пространственной фильтрации и оконтуривания изображений.
2. Создан лазерный драйвер фотокатодов для инжекции электронов с акустооптической системой управления ультракороткими лазерными импульсами.
3. Исследования в области акустики и оптики анизотропных сред позволили определить оптимальные конфигурации широкоапертурных и квазиколлинеарных акустооптических фильтров на основе монокристаллов парателлурита.
4. Проведены гиперспектральные исследования флуоресцентного излучения опухолевых тканей щитовидной железы человека.
5. Разработаны методы формирования произвольных спектральных функций пропускания акустооптических фильтров.
Оборудование:
• Фемтосекундный лазер Femtosource Synergy (Femtolasers, Австрия).
• Фемтосекундный автокоррелятор Femtometer (Femtolasers, Австрия).
• Усилитель регенеративный RAP-2000 (Авеста-проект, Россия).
• Система диагностики ультракоротких лазерных импульсов MIIPSBox-640 (Biophotonic Solitions, США).
• Генератор сигналов произвольной формы N8241A (Agilent, США).
• Генератор сигналов произвольной формы 33622А (Keysight, США).
• Оптический анализатор спектра 86142В (Agilent, США).
• Аргоновый лазер 488 нм (Melles Griot, США).
• Твердотельный лазер 532 нм (Laser Quantum, Великобритания).
• ВЧ-усилители (Amplifier Research, США).
• Анализатор спектра радиосигналов FSH3 (Rhode&Schwarz, Германия).
• Измеритель мощности радиосигналов NRT-Z14 (Rhode&Schwarz, Германия).
• Рентгеновский дифрактометр (Rigaku, Япония).
• Автоматизированная установка для резки кристаллов и пластин APD2 (Logitech, Великобритания).
• Шлифовально-полировальный оптический станок OLP 200/C (AKM, Германия).
• Интерферометр OptoTL-60 (Оптико-технологическая лаборатория, Россия).
• Ультразвуковая линия отмывки (Selecta, Испания).
• Установка вакуумного напыления (Torr, США)
• Установка термокомпрессионной сварки (Kulicke&Soffa, США).
• Векторный анализатор цепей E5061A (Agilent, США).
• Микроскоп медико-биологический Ti-E (Nikon, Япония).
• Гиперспектральная система HSi-300 (Gooch & Housego, США).
• Охлаждаемая ПЗС-Камера Alta U32 (Apogee Instruments, США).
• Прецизионные оптические столы (Thorlabs, США).
• Оптическая станция (Thorlabs, США).
• Фемтосекундный автокоррелятор Femtometer (Femtolasers, Австрия).
• Усилитель регенеративный RAP-2000 (Авеста-проект, Россия).
• Система диагностики ультракоротких лазерных импульсов MIIPSBox-640 (Biophotonic Solitions, США).
• Генератор сигналов произвольной формы N8241A (Agilent, США).
• Генератор сигналов произвольной формы 33622А (Keysight, США).
• Оптический анализатор спектра 86142В (Agilent, США).
• Аргоновый лазер 488 нм (Melles Griot, США).
• Твердотельный лазер 532 нм (Laser Quantum, Великобритания).
• ВЧ-усилители (Amplifier Research, США).
• Анализатор спектра радиосигналов FSH3 (Rhode&Schwarz, Германия).
• Измеритель мощности радиосигналов NRT-Z14 (Rhode&Schwarz, Германия).
• Рентгеновский дифрактометр (Rigaku, Япония).
• Автоматизированная установка для резки кристаллов и пластин APD2 (Logitech, Великобритания).
• Шлифовально-полировальный оптический станок OLP 200/C (AKM, Германия).
• Интерферометр OptoTL-60 (Оптико-технологическая лаборатория, Россия).
• Ультразвуковая линия отмывки (Selecta, Испания).
• Установка вакуумного напыления (Torr, США)
• Установка термокомпрессионной сварки (Kulicke&Soffa, США).
• Векторный анализатор цепей E5061A (Agilent, США).
• Микроскоп медико-биологический Ti-E (Nikon, Япония).
• Гиперспектральная система HSi-300 (Gooch & Housego, США).
• Охлаждаемая ПЗС-Камера Alta U32 (Apogee Instruments, США).
• Прецизионные оптические столы (Thorlabs, США).
• Оптическая станция (Thorlabs, США).
Система гиперспектрального анализа и лазерного исследования микроскопических препаратов
 |
Константин Юшков, Ведущий научный сотрудник |
Гиперспектральный анализ заключается в получении и массива изображений исследуемого объекта на различных длинах волн и последующем изучении спектральных особенностей различных фрагментов изображения. Основы технологии гиперспектрального анализа, называемые также спектрозональной съемкой, были разработаны для решения задач астрофизики, космических исследований и дистанционного зондирования Земли. В последние годы эти методы стали внедряться и в биомедицинских исследованиях, в частности в диагностика рака. Получаемый при гиперспектральном анализе объем информации об объекте существенно превосходит цветные изображения: спектральное разрешение современных гиперспектральных систем составляет несколько сот линий в видимом диапазоне спектра, в то время как цветная (RGB) камера выделяет только три широких спектральных диапазона (красный, зеленый и синий). Одним из физических приборов, позволяющих реализовать спектрометр изображений, являются перестраиваемые акустооптические фильтры.

Система построена на базе инвертированного микроскопа Nikon Ti-E с набором объективов от 4x до 100х
 Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры
Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа
Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)
Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)Наблюдаемое при этом изображение объекта содержит информацию о спектральных кривых пропускания образца, которая, однако, теряется при регистрации обычной ПЗС-камерой. Кроме того, при наблюдении объекта в белом свете можно увидеть только амплитудную модуляцию, то есть различие между более и менее прозрачными фрагментами изображения. Фазовая модуляция, обусловленная вариациями толщины образца или его показателя преломления, может быть визуализирована только в когерентном освещении и с помощью специальных систем пространственной фильтрации. Один из классов таких систем – акустооптические фильтры изображений, неоспоримым достоинством которых является адаптивность, то есть возможность изменять характеристики в ходе эксперимента в зависимости от поставленной задачи.
 Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект
Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов
Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром
В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра
Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображений
Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображенийАкустооптический фильтр является ключевым звеном данной системы и позволяет осуществлять обработку изображений в двух принципиально различных режимах:
• при белом освещении осуществляется гиперспектральный анализ, то есть последовательное выделение различных длин волн из спектра пропускаемого объектом излучения и регистрация массива спектральных изображений (т.н. «гиперспектральный куб»);
• при лазерном освещении осуществляется адаптивная пространственная фильтрация изображений, позволяющая реализовать такие режимы аналоговой обработки, как оконтуривание (подчеркивание градиентов интенсивности) и визуализация фазы (то есть наблюдение вариаций оптической плотности объекта, не регистрируемых при освещении белым светом).
Для повышения чувствительности в качестве детекторов используются черно-белые охлаждаемые ПЗС-камеры с низким уровнем шумов, а длина волны сохраненного изображения, то есть его цвет, определяются настройкой акустооптического фильтра. При постобработке из гиперспектрального массива изображений может быть восстановлено цветное изображение или использована цветовая схема false color для повышения визуальной контрастности деталей.
 Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора
Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.
Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.  Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм.
Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм. Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа)
Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа) В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock
В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе
Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека
Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной ткани
Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной тканиСравнение изображений, полученных различными методами: обычное цветное изображение, гиперспектральные черно-белые изображения, флуоресцентное изображение,– позволяет подробно исследовать особенности различных тканей и получить дополнительную информацию об их строении. Исследование спектров флуоресценции позволяет наблюдать некоторые особенности тканей, не определяемые при обычной световой микроскопии.
Сочетание в одной оптической схеме двух физических различных методов обработки изображений: гиперспектрального анализа и пространственной фильтрации является основным преимуществом разработанной в НИТУ «МИСиС» системы для исследования гистологических срезов опухолевых тканей. Эта аппаратура открывает новые возможности визуализации внутриклеточных структур и разработки новых диагностических критериев в онкологии. В перспективе система позволит реализовать дополнительные режимы визуализации объекта и интегрировать новые модули, такие как фемтосекундная система возбуждения многофотонной флуоресценции.


viktorpanasiuk
Не понятно причем тут лечение лазером, который глубже чем на пару микрон в тело пациента пройти не может. Разве что меланомки выжигать, но тут мощный инфракрасник. Или же у вас некая модуляция лазерного излучения более низкочастотным сигналом? Также ни слова о протонах и плазме, хотя начальное описание предполагает… Стало интересно чем ваша протонная терапия отличается от общеизвестной мировой. Ну и почему бы не привести характеристики спектрального анализа, разрешение от и до какой длины волны возможна регистрация. И чем линейная CCD матрица + призма не устраивает в качестве спектрометра? И чем ваш метод гистологии лучше/хуже других? Все что я увидел это расширенный диапазон + постобработка, которая теоретически поможет лучше визуализировать клетку, а следовательно дифференциировать и определить тип рака. Или же вы классифицируете тип по спектру? Неужели метод хромотографии будет менее точен, например?
flerant
Статья ужасна, если честно. Но кое-что я вам могу объяснить, как человек, непосредственно работающий с Хазановым в ИПФ РАН.
1. Речь в статье об акусто-оптическом методе диагностике, который никакого прямого отношения к протонной терапии не имеет. Я с этой темой знаком плохо, поэтому прокомментировать никак не могу.
2. Протонная терапия, о которой говорится в начале статье, отличается от традиционной методом получения протонов. Вместо обычных снихротронных и т. п. ускорителей предлагается применять значительно более эффективный метод лазерного ускорения ионов. Главное преимущество метода заключается в том, что лазером можно создавать значительно более сильные ускоряющие поля, что значительно сокращает дистанцию, на которой может быть достигнута необходимая энергия (речь, фактически, идёт о долях миллиметра). Это положительно отражается и на стоимости соответствующей установки, потому что на данный момент центры протонной терапии требуют огромных ускорителей (диаметром до километра), и поэтому их число невелико, стоимость лечения велика, а пропускная способность мала.
fundov
Подскажите, пожалуйста, Вы имеете ввиду статьи, содержащие интервью с Хазановым в МК и на Роснауке, или наш репортаж о системе гиперспектрального анализа и лазерного исследования микроскопических препаратов, который мы с Константином совместно подготовили специально для читателей GT?
flerant
Если вы про «Статья ужасна, если честно», то я имею ввиду эту статью на GT. Могу ответить развёрнуто:
1. Первые три абзаца только запутывают, поскольку остальная часть имеет общее с ними только фамилию Хазанова
2. Заявленное «создается компонентная база для лазерно-плазменного ускорителя протонов» никак в дальнейшем тексте не раскрывается (что конкретно из созданного является компонентной базой ускорителя?)
3. Часть из результатов не имеет отношения ни к ускорению протонов, ни к биомедицинской оптике (например, лазерный драйвер фотокатодов для инжекции электронов)
4. В целом статья написана чересчур академическим, я бы даже сказал каким-то канцелярским языком. Читать очень тяжело, выделять главное ещё сложнее. Похоже на технический отчёт для заказчика, а не на статью для научно-популярного сайта.
fundov
Постараюсь ответить на Ваши вопросы и замечания.
Так как данные вопросы не совсем по теме публикации, пожалуйста, прячьте под спойлер большие комментарии.
Также хотелось бы сказать, что это публикация, которая содержит в себе несколько подзаголовков.
Она раскрывает лишь малую часть исследования, и, на мой взгляд, было бы некорректно не рассказать о лаборатории, частью которой является система ЛФГМ.
До «cut» был приведен анонс, в котором говорилось, о чем именно пойдет речь в этой публикации. Дальше прослеживается четкая структура по анонсу:
— О проекте (коротко о лаборатории и составе),
— О целях, в одной из которых говорится о системе ЛФГМ, указанной в заголовке, в анонсе и по сути в самом фоторепортаже.
— Об уникальности и актуальности исследования.
— О результатах исследования на данный момент и оборудовании, которое находится в распоряжении сотрудников лаборатории.
Сам фоторепортаж четко описывает систему гиперспектрального анализа и лазерного исследования микроскопических препаратов
с комментариями ведущего научного сотрудника лаборатории.
2. Это словосочетание в разделе о проекте, а в заголовке и в анонсе об этом ни слова.
«…и создается компонентная база…», а также диагностика онкологических
заболеваний при помощи лазерных технологий, о которых, собственно говоря, и повествует сам
фоторепортаж с комментариями эксперта, о чем свидетельствует заголовок.
3. Ускорение протонов — это одна из целей лаборатории, а результаты относятся ко всем целям лаборатории,
в компетенцию которой входит ускорение протонов.
4. Рассказывать о том, как устроен лазерный флуоресцентный гиперспектральный микроскоп в свободной форме достаточно сложно, так как многие термины не имеют синонимов, в этой научной области узкоспециализированная терминология. Сам фоторепортаж поэтапно описывает систему ЛФГМ, и это нельзя считать научно популярной статьёй.
flerant
1. Задумывалось, может быть, и нормально, а реализовано так, что как минимум меня (поначалу, пока не разобрался, владея, правда, большим количеством дополнительной информации) и участника viktorpanasiuk (судя по его первому комментарию) текст запутал.
2. Не знаю, у кого как конечно, а у меня глаз за эту фразу зацепился, и я был разочарован, что далее об этом ни слова. И это, кстати, тоже одна из частных причин, почему текст запутывает. Ну нельзя во введении описывать две разные вещи через запятую, а потом говорить только об одной из них.
3. Для ускорения протонов не нужен инжектор электронов. Эта задача вообще из другой области выросла. Такие инжекторы нужны для лазеров на свободных электронах.
4. Вам виднее, конечно, но я считаю, что любую тему можно описать так, чтобы её понял если не 5-летний ребёнок, то по крайней мере человек с базовым профильным образованием. Ну или по крайне мере с интересом прочитал. Но это только моё мнение, конечно.
viktorpanasiuk
Акусто-оптический метод наверное предполагает сканирующий метод, при котором частота фильтра перестраивается. Но опять-таки, в чем преимущество такого метода перед CCD + призма?
qbertych
С АОМ быстрее и нет движущихся частей. Задача — получить трехмерный массив данных (координата по XY и спектр по Z) при помощи двумерной ПЗС, то есть надо сканировать один из параметров. Это делается либо АОМ со сканированием частоты, либо призмой/дифрешеткой с механическим сканированием одной из координат.
viktorpanasiuk
ну так в методе линейная ПЗС + призма также нет движущихся частей. Призма разбивает взодящий пучок на спектр, а линейная ПЗС регистрирует амплитуды каждой линии. Такой метод является параллельным. Главное чтобы линейного разрешения ПЗС хватило.
qbertych
Так ведь интересен спектр каждого отдельного участка образца, попиксельно. Призма+линейная ПЗС даст усредненный спектр по всему образцу, тут микроскоп не нужен.
kby
В отличие от спектрометров на дифракционных решетках или призмах акустооптический спектрометр на основе перестраиваемого фильтра действительно осуществляет анализ последовательно, меняя пропускаемую длину волны, но главным отличием является то, что при этом на ПЗС-матрице целиком регистрируются изображения объекта, в то время как спектрометр, состоящий из ПЗС-линейки и призмы/решетки регистрирует параллельно спектр, но только от одной точки на объекте. Чтобы организовать спектральный анализ изображений и приходится дополнять призмы сканирующей системой. Другой особенностью акустооптических фильтров, является возможность осуществлять пространственную фильтрацию, например, оконтуривание, при лазерном освещении образца, что и рассмотрено вкратце в репортаже.
viktorpanasiuk
Я работал с медицинским циклотроном для производства 18F из которого синтезировался ФДГ для ПЭТ/КТ. Размеры его весьма скромны и не превышают 2 х 2 х 3 м при выходной энергии 18 МэВ, правда за интенсивность ничего не скажу. Но 10 Кюри нарабатывал за 2 часа. Навскидку такой метод производства протонов мне чем-то напомнил линейный ускоритель, попроавьте если не так. Ну и все-равно было бы интересно услышать о нем. Как производятся ионы, как отсеиваются электроны.
flerant
Да, для ПЭТ нужны энергии до 20 МэВ и достаточно простых и относительно недорогих циклотронов. Но для протонной терапии требуются протоны с энергией более 200 МэВ. На таких энергиях начинают существенно проявляться релятивистские эффекты, требующие наличия в циклотроне механизмов синхронизации магнитного поля и пучка ионов — эту проблемы решают синхроциклотроны (фазотроны). Они, однако, сильно дороже обычных циклотронов. И хотя размеры их, действительно, невелики (про километры это я наврал вам, перепутав с коллайдерами, обычно это несколько метров по каждому измерению), это их не спасает.
qbertych
Скажите, а кому пришла в голову
дурацкаяидея поставить лазеры на подвижные столики? Понятно, что вам надо завести луч в оптоволокно — но зачем двигать лазер, если можно двигать само волокно, которое и так стоит на держалке с кучей степеней свободы? На столе лазеру гораздо комфортнее — нет риска задеть, не шатается, не мешают люфты подвижного столика.kby
Главное неудобство работы с лазером, расположенным непосредственно на столе, — высота луча 4-5 см. Конечно, вместо столика намного лучше подошел бы lab jack, но именно его под руками и не оказалось.
qbertych
Вам бы под него какую-нибудь подставку выпилить. Или под держалку для волокна. Имхо, возни меньше будет, чем сейчас.