
Я уверен, что к 2025 году учёные онкологи разработают лечебные терапии для большинства, если не всех видов рака.
Конечно, я несколько рискую, делая подобные заявления. Но в сфере исследования рака мы движемся к лучшим, более безопасным терапиям невероятно быстро, и я взволнованно предвкушаю будущие результаты. Я убеждён, что нужно высоко ставить планку, исполнять и реализовывать, и не должно быть оправданий, если мы не выдержим продвижения в таком темпе.
2017 стал знаковым в ускорении лечения рака, новыe лекарства получили одобрение FDA. В том числе были одобрены два вида терапий CAR T клетками – тип иммунотерапии рака, который использует собственные иммунные клетки пациента, запрограммированные на атаку и уничтожение раковых клеток. Все мы в Центре Исследований Рака Фреда Хатчинсона воодушевлены такими известиями. Это успешная проверка, того, над чем мы и наши коллеги по всему миру работали в течение десятилетий. Что ещё важнее, это означает терапию, потенциально способную спасти жизнь некоторым раковым пациентам с исторически ограниченными вариантами лечения.
Между прочим, ключевая фраза в этом предложении – некоторые пациенты. Клеточные иммунотерапии Kymriah и Yescarta были одобрены для лечения типа прогрессивного педиатрического лейкоза и агрессивной неходжкинской лимфомы соответственно. И мы знаем, что, хотя эти две терапии и являются большим шагом вперёд по сравнению с ранее доступными методами лечения, однако не все пациенты реагируют на них. И из тех, кто реагирует, некоторые испытывают серьёзные побочные эффекты.
А ведь остаётся ещё гораздо больше пациентов и видов рака, которые нужно лечить, и лечить безопасно. Иммунотерапия обещает заняться этими прочими видами рака, но одного этого подхода недостаточно для полного успеха. Нам нужно объединить множество знаний из разных областей, новые методы исследования, технологии сбора и анализа больших данных, чтобы суметь вылечить большее количество пациентов.
Исследователи нашего центра тестируют раковые терапии завтрашнего дня в лаборатории и в ходе клинических исследований. В прошлом году мы увидели замечательные научные достижения наших лабораторий, которые намекают на то, что нас ждёт в будущем. Начиная с 2018 года, мы с коллегами внимательно следим за несколькими перспективными направлениями исследований и лечения рака – и, конечно же, делаем всё возможное, чтобы способствовать скорейшему их развитию.
Я занимаюсь исследованием рака всю свою карьеру и вижу больше прогресса в этой сфере за последние несколько лет, чем за предыдущие пятьдесят. И я с нетерпением жду, что же принесёт нам 2018 год.
Иммунотерапия нового поколения
Недавнее известие о приобретении компанией Celgene компании Juno Therapeutics является хорошим примером того, как развивается отрасль иммунотерапии. Наука, стоящая за иммунотерапией Juno, восходит к десятилетиям доклинических исследований в Центре Фреда Хатчинсона, где наши учёные обнаружили, что отдельные типы иммунных клеток обладают мощной и устойчивой противоопухолевой активностью.
С целью сделать иммунотерапию рака более безопасной мы очень тщательно изучаем некоторые серьёзные побочные эффекты и инфекции, возможные после лечения CAR T клетками. Понимание и борьба со специфической токсичностью, связанной с CAR T терапией будет ключом к тому, чтобы успешно реализовать этот метод для большего числа пациентов.
По мере того, как мы продолжаем совершенствовать наши текущие подходы к иммунотерапии, мы также проверяем нашу клеточную иммунотерапию в новых клинических испытаниях и на иных типах рака, чтобы применить эту мощную технологию к большему числу нуждающихся пациентов. Наше внимание было сосредоточено на различных формах рака крови, хотя недавно мы запустили исследование, которое включает пациентов с раком лёгких и тройным отрицательным раком молочной железы, а также другое исследование для пациентов с меланомой. В 2018 году мы расширим поле нашего внимания, включив в него ещё многие виды опухолей, в том числе яичников, лёгких, головы и шеи, рака желудка, множественной миеломы и многие иные типы рака крови.
На данный момент у нас идут 12 клинических испытаний клеточной иммунотерапии, и ещё 21 испытание должно скоро начаться. Мы работаем с 11 промышленными партнёрами в области иммунотерапии, от глобальных производителей, таких как Eli Lilly and Company, до биотехнологических компаний, таких как Minerva Biotechnologies, и, конечно же, наших партнёров, иммунотерапевтических стартапов, Juno Therapeutics и Adaptive Biotechnologies. По мере расширения наших испытаний и в целях удовлетворения потребностей пациентов, наш специализированный центр выращивания клеток производит в среднем от 200 до 600 миллионов клеток в день.
По мере развития иммунотерапии, расширение её ранних успехов с лейкемий на опухоли будет самым сложным, и при этом самым важным делом. Исследователи центра Фреда Хатчинсона продвигаются вперёд, применяя иммунотерапию к опухолям, таким как рак молочной железы и лёгких. Одни из самых волнующих событий – несколько недавних достижений касающихся редкой опухоли, известной как клеточная карцинома Меркеля, исследования, которые привели к первому одобрению FDA иммунотерапии для этого рака, а также показали многообещающие намёки на мощь комбинированной иммунотерапии. Исследования этой редкой опухоли закладывают основу будущих достижений в лечении иных, более распространённых раков, которыми мы также займёмся в новых клинических испытаниях.
Нам нужно объединить множество знаний из разных областей, новые методы исследования, технологии сбора и анализа больших данных, чтобы суметь вылечить большее количество пациентов.
Могут ли облачные вычисления вылечить рак?

Облачные вычисления намного расширили пути и средства изучения рака. От научного сотрудничества в реальном времени между странами и континентами до управления данными любого масштаба, облачные технологии поддержат ключевые усилия, такие как точная онкология, расширенная визуализация данных и другие передовые исследования, которые приблизят нас к излечению рака.
Поскольку мы продолжаем находить новые связи между генами и типами опухолей, точные онкологические подходы к лечению рака станут более важными и потребуют как минимум терабайт или больше данных на одного пациента – достаточно, чтобы заполнить память восьми новейших смартфонов. В прошлом году исследование в центе Фреда Хатчинсона привело к запуску нового клинического испытания высокоточного лекарственного подхода против рака предстательной железы и выявило определённые генетические изменения, которые могут вдохнуть новую жизнь в старый лейкозный препарат.
В декабре вместе с нашими партнёрами из UW Medicine мы основали Институт Точной Медицины Brotman Baty, и очень рады, что приняли в нём участие. Как я уже отмечал во время открытия, этот институт является ещё одним примером новой роли Сиэтла как центра по лечению рака.
Как Национальный Институт Рака, так и Национальные Институты Здоровья недавно инициировали проекты по сбору данных, объединяющие экспертов по работе с данными, облачных технологов и экспертов в области биоинформатики, чтобы стимулировать совместные усилия по использованию облачных и информационных инструментов в крупномасштабных проектах. Мы ожидаем, что эти усилия продолжат набирать силу в 2018 году, и мы в центре Фреда Хатчинсона работаем с лучшими облачными провайдерами в нескольких проектах с интенсивным использованием данных, которые используют машинное обучение и облачные вычисления для ускорения исследований и улучшения результатов на пациентах.
Например, мы используем методы глубокого обучения для анализа магнитно-резонансных изображений, которые идентифицируют маркеры рака молочной железы. Мы также используем искусственный интеллект для улучшения результатов у пациентов, которые получают химиотерапию, и создаём платформу следующего поколения для участия пациентов, переживших трансплантацию стволовых клеток крови. Следите за достижениями в этих и иных областях, как мы используем облачные технологии в лечении рака.
Недавним захватывающим событием стало объявление о партнёрстве между Adaptive Biotechnologies и Microsoft, которое сосредоточится на использовании искусственного интеллекта для анализа последовательностей рецепторов Т-клеток у пациентов со спектром заболеваний, включая рак, задействующих иммунную систему. Т-клетки являются глазами нашей иммунной системы. Но нам нужен искусственный интеллект для обеспечения виртуальной реальности, позволяющей нам через секвенирование рецепторов Т-клеток видеть то, что они видят, и разрабатывать диагностику и персонализированную терапию основываясь на этом видении.
Поэтому ответ на вопрос «может ли облако помочь вылечить рак» – «да», – и здесь в Сиэтле мы можем использовать связь между биологическими науками и облачными технологиями лучше чем где-либо ещё.
Инфекционные заболевания – связи тянутся к раку и далее
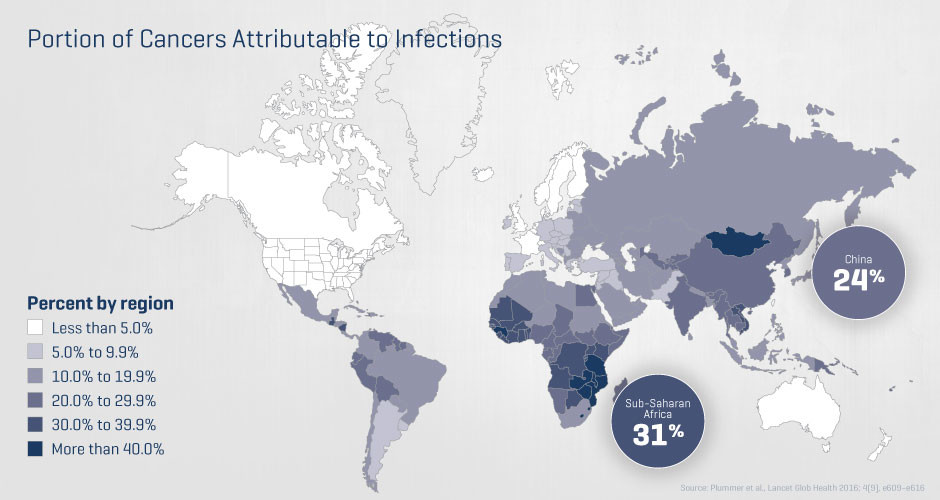
Каждый пятый рак во всем мире может быть связан с инфекционными заболеваниями. Мы в центре Фреда Хатчинсона давно поняли сложные связи между инфекцией и раком; в прошлом году мы запустили интегрированный исследовательский центр, посвящённый изучению этих связей с целью предотвращения многих видов рака, являющихся тяжёлым бременем для человечества. Мы также рассматриваем новые партнёрства в государственном и частном секторах для дальнейших изысканий в сфере пересечения инфекционных заболеваний и рака.
Что касается профилактики ВИЧ, последние два года были знаменательными для основанной на базе центра Фреда Хатчинсона Сети Испытаний ВИЧ Вакцин – HIV Vaccine Trials Network, которая начала четыре беспрецедентных по эффективности испытания профилактики ВИЧ в 2016 и 2017 годах. Исследования по тестированию новых вакцин и других способов профилактики ВИЧ-инфекции соберут вместе 12 200 добровольцев по всему миру. Мы все с нетерпением ожидаем окончательных результатов исследования в 2020 и 2021 годах.
Я занимаюсь исследованием рака всю свою карьеру и вижу больше прогресса в этой сфере за последние несколько лет, чем за предыдущие пятьдесят. И я с нетерпением жду, что же принесёт нам 2018 год.
Я жду общения с вами в следующем году и приглашаю вас поделиться своими
мыслями.
С уважением,
Гари Джиллиланд, MD, PhD, президент и директор Fred Hutchinson Cancer Research Center
Перевод выполнил Ник Сестрин, группа SENS Volunteers
Комментарии (12)

ARD8S
09.05.2018 22:26+4Это отлично. Но нужно более широко освещать успехи этого вида терапии, сильнее и быстрее развивать это направление. Чтобы привлечь талантливых аналитиков, специалистов, инвесторов и чтобы заткнуть лоббистов безальтернативной химио-радио-терапии. Считаю, что нужно на уровне государств разрешать участвовать пациентам (в т.ч. и иностранным) в разработке терапий. Пусть даже за деньги и без гарантии результата. Ещё желательно разработать методы более доступные диагностики по маркерам, внедрять периодические скрининги всего населения на гос. уровне. МРТ не напасёшься делать, да и дорого ИМХО. Очень хочется, чтобы у них этот прорыв получился. Всё прогрессивное человечество ждёт их успехов.

RusakovMxL
10.05.2018 08:47Всё намного печальнее, когда сталкиваешься с реальностью. Тут всё красиво и радужно, а на деле — не очень! Как только выходит новый противоопухолевый препарат и он прошел клинические испытания, он стоит 120 т.р. — 250 т.р. за один тюбик, которых нужно пару штук на один курс терапии, который, не факт, что поможет. А этих курсов надо 5-20. У какого ракового больного есть такие деньги? Фармкомпании сразу после выпуска препарата желают «отбить» бабло и им плевать на людей и сколько там умрет в ближайшем будущем. А если у человека какая-нибудь редкая опухоль, которой больны по стране 5-6 тысяч пациентов, разработкой лекарств по ней вообще не ведут, понимая, что деньги не будут отбиты в перспективе. А так, в ДНК человека около 40 цепочек, которые способны при мутации вызвать раковую опухоль. Их разные комбинации — есть разнообразие раковых модификаций.

Wuzaza
10.05.2018 09:04Дополню, что раковая опухоль также полиморфна в своем генетическом составе — клетки разных участков опухоли отличаются генетически. Кроме того в клетках продолжают происходить постоянные мутации, которые постепенно приводят к выживанию клеток нечувствительных к препаратам — формирование резистентности, аналогичной резистентности бактерий к антибиотикам. Так что не все так радужно, как оно хотелось бы.

Alter2
10.05.2018 09:25Проблема в том, что если фармкомпании не окупят затраты, то они обанкротятся, и дальнейшей разработкой заниматься будет некому. Поэтому выставляют реальные цены, а оплачивают их страховые компании и благотворительные организации.

roscomtheend
10.05.2018 09:52Для этого есть госпрограммы помощи, а если не отбить затраты (как уже сказали) не будет не только следующего, но и этого препарата. И да, они не всегда помогают, они есть поддельные (и от них только хуже даже без учёта потери времени), стоят запредельных денег и в наших широтах могут быть вообще не представлены.

Gritsuk
10.05.2018 22:55+2Иммунотерапия дороже. Представьте — надо взять мышку, подсадить ее потомкам человеческие гены, вырастить это потомство, ввести ему маркеры опухоли, добиться иммунного ответа, выделить антитела к опухоли… Курс Ниволумаб+Ипилимумаб, согласно вики, стоит под 200k$. Бывает не один курс на лечение.
Однако тут вопрос, кто за это платит. В клинических испытаниях лекарства оплачивает спонсор. Потом есть госпрограммы и страховки. Так что все может быть не так и страшно в финансовом плане.
Кстати, есть компании, которые специализируются на редких болезнях. По ощущениям, сейчас это направление быстро развивается, но пруфов не могу привести, моя выборка невелика

arielf Автор
11.05.2018 00:31+1Главный недостаток нынешней иммунотерапии – персонализация и, как результат, высокая цена и сложность реализации, ибо иммунные клетки пациента нужно извлечь, запрограммировать и ввести обратно в организм. Поэтому сейчас учёные разрабатывают новое поколение универсальной иммунотерапии, не требующей извлечения клеток, – так называемые противораковые вакцины. В них активация иммунных клеток происходит прямо в организме, например, при помощи комбинации малых молекул.
В настоящее время в клинические испытания вошли две такие вакцины: «гарвардская», убивающая раковые клетки с эффективностью в 50%, и «стенфордская» с эффективностью в 97%. Причём «стенфордская» вакцина в эксперименте на мышах показала феноменальные результаты – уничтожив не только сами опухоли, но и все их метастазы.
RusakovMxL
11.05.2018 08:02Клинические испытания есть уже? И на редких, скажем, лимфоме Ходжкина работает?

arielf Автор
11.05.2018 00:27+2Два типа повреждений накапливаются в наших генах по мере старения: мутации и эпимутации. Мутации являются повреждением самой последовательности ДНК, тогда как эпимутации являются повреждением «лесов» этой ДНК (метильных групп, присоединяющихся к основаниям в цепи ДНК, и контролирующих, какие гены и когда включаются и выключаются в клетке). Мутации и эпимутации в конечном счёте наносят нам вред одинаковым образом: вызывая аномальную экспрессию генов. Итак, какой вред могут нанести изменения в экспрессии генов, вызванные [эпи]мутациями? Обычно в клетке, в которой произошли критические мутации включается защитный механизм, и она замирает в сенесцентном состоянии. Таким образом, многие из сенесцентных клеток – потенциально раковые. Но иногда этот механизм не срабатывает, в клетке включаются гены, экспрессирующие теломеразу, и опухоль начинает бесконтрольно расти.
К счастью, существует универсальная стратегия по защите о рака, хотя её реализация пока ещё очень сложна. Эта стратегия основана на главной уязвимости всех раковых клеток: их абсолютной потребности в обновлении своих теломер. Поскольку раковые клетки размножаются очень быстро, они вскоре истощают свои теломеры, и им нужно найти способ удлинить их снова, чтобы продолжить размножение. Успешные раковые клетки – это те, которые развили мутации, использующие одну из двух систем обновления теломер: фермент теломеразу, либо более редкую систему, называемую Альтернативным Удлинением Теломер (ALT). Если зарождающийся рак не может найти способ «взломать» механизм удлинения теломер, их теломеры будут уменьшаться, пока клетки не перестанут делиться, прежде чем смогут нас убить. Поэтому, несмотря на их разнообразие, все раковые клетки имеют одну важную уязвимость: их выживание целиком зависит от их способности экспрессировать теломеразу (или, реже, ALT). И одно из нынешних направлений исследований – поиск лекарств, ингибирующих активность теломеразы и ALT в раковых клетках.
Ещё одно новое и очень перспективное направление – имунотерапия, когда берут собственные иммунные клетки пациента и программируют их при помощи генной инженерии на распознавание и уничтожение раковых клеток, а затем вводят обратно в организм. Технология прекрасно показала себя в клинических испытаниях, и несколько терапий на её основе уже одобрены к клиническому использованию в Европе и США. Пока, правда, её применение ограничено лишь лимфомами и лейкозами, но учёные активно работают в направлении опухолей.
Главный недостаток нынешней иммунотерапии – персонализация и, как результат, высокая цена и сложность реализации, ибо иммунные клетки пациента нужно извлечь, запрограммировать и ввести обратно в организм. Поэтому сейчас учёные разрабатывают новое поколение универсальной иммунотерапии, не требующей извлечения клеток, – так называемые противораковые вакцины. В них активация иммунных клеток происходит прямо в организме, например, при помощи комбинации малых молекул.
В настоящее время в клинические испытания вошли две такие вакцины: «гарвардская», убивающая раковые клетки с эффективностью в 50%, и «стенфордская» с эффективностью в 97%. Причём «стенфордская» вакцина в эксперименте на мышах показала феноменальные результаты – уничтожив не только сами опухоли, но и все их метастазы.
Учёные с большим оптимизмом смотрят на будущее иммунотерапии.
«Я уверен, что к 2025 году учёные онкологи разработают лечебные терапии для большинства, если не всех видов рака.»
«2017 год стал знаковым в ускорении лечения рака, что привело к разрешению клинического использования принципиально новых лекарств. К ним относятся одобрение двух различных CAR-Т терапий – нового типа иммунотерапии, использующей собственные изменённые иммунные клетки пациента для атаки и уничтожения раковых клеток.»
«Я занимался исследованием рака всю свою карьеру. И я вижу больше прогресса в этой области за последние несколько лет, чем за предыдущие пятьдесят. Я с нетерпением жду, что же принесёт 2018 год.»
Гари Джиллиланд, президент и директор Fred Hutchinson Cancer Research Center
Поскольку раковые клетки – как и любые иные типы тканей – имеют уникальные белковые маркеры, проблемы их поиска и уничтожения очень похожи на аналогичные у сенесцентных клеток, а также на проблемы высокоспецифичной и эффективной доставки в генной терапии. Поэтому успехи OncoSENS во многом зависят от успехов в этих сферах. Например, компания Oisin Biotechnologies планирует использовать свою систему распознавания и уничтожения сенесцентных клеток в борьбе с раком, просто перепрограммировав её на иные маркеры! Это ещё один пример универсальности SENS подхода.
Но это всё временные решения. Наиболее радикальным и эффективным решением, полностью исключающем образование рака, было бы WILT (Whole-body Interdiction of Lengthening of Telomeres) – полное вырезание генов теломеразы из всех (по крайней мере из всех активно делящихся – в первую очередь из стволовых) клеток организма и регулярный их пересев. Увы, пока её применение невозможно по двум причинам. Во-первых, специфичность распознавания и эффективность доставки в генной терапии всё ещё низки, и если в случае сенесцентных клеток уничтожение всего лишь 50% их уже приводит к радикальному омоложению организма, то в случае рака – всего одна упущенная клетка пустит насмарку всё лечение. Во-вторых, вырезание теломеразы приведёт к быстрому истощению пулов стволовых клеток и необходимости их регулярного пересева каждые несколько лет.

arielf Автор
11.05.2018 03:01К счастью, популяций стволовых клеток, требующих регулярного пересева, немного. В первую очередь это кроветворные клетки, эпителиальные клетки кишечника и лёгких и клетки эпидермиса кожи.
Несмотря на различные проблемы, реализация WILT движется медленно, но уверенно. Например, недавно группа учёных из SENS показала на мышах, что регулярный пересев кроветворных клеток с вырезанной теломеразой прекрасно работает в крови. Увы, из-за малой выборки уникальная работа так и не была опубликована. Аналогичное исследование по регулярному пересеву клеток эпителия кишечника начали в лаборатории Graca Almeida-Porada в Институте Регенеративной Медицины Wake Forest. Оно показало неплохие результаты, но его закрыли из-за закончившегося финансирования.


BiW
А у нас!.. А мы!.. В ядерный пепел!.. А я все маме расскажу!...