Увеличение времени между приёмами пищи и ограничение калорий продлевает жизнь
В сентябре 2018 года в журнале Cell Metabolism вышло исследование американских геронтологов из Национального института по проблемам старения (NIH) о влиянии времени между приёмами пищи на продолжительность жизни. Подопытные мыши были разделены на две группы. У первой группы был рацион с естественным питанием (уменьшенным количеством очищенных углеводов и жиров, и повышенным содержанием белков и клетчатки). Другая группа грызунов, напротив, была посажена на «нездоровую» диету – с увеличенным количеством простых углеводов и жиров, и уменьшенным – белков и клетчатки. Кроме этого, мышей в каждой группе разделили на три подгруппы, исходя из того, как часто они имеют доступ к пище. Первая подгруппа мышей имела доступ к еде круглосуточно. Второй подгруппе мышей давалось питание один раз в день, и количество калорий в их порции было таким же, как и у мышей из первой подгруппы, т.е. не урезанным. Третью подгруппу кормили рационом, уменьшенным на 30% калорий.
Вторая и третья подгруппы, по наблюдениям учёных, имели более сильный аппетит и быстро съедали принесённую еду, что приводило к более продолжительным ежедневным периодам голодания для обеих групп.

Рисунок из статьи.
Первая подгруппа мышей (ad libitum) — питавшиеся досыта, имевшие доступ к пище 24 часа в сутки
Вторая подгруппа мышей (meal-fed) — получавшая пищу один раз в день, без урезания калорий.
Третья подгруппа мышей (CR, calorie restriction) — получавшая рацион, уменьшенный по калориям на 30%.
На всём протяжении исследования ученые отслеживали метаболическое здоровье мышей до естественной смерти, а затем изучили их посмертно. Выяснилось, что мыши из двух подгрупп, которых кормили раз в день и ограничивали калорийность, улучшили общее состояние здоровья. О чем свидетельствовали задержки с общим возрастным повреждением печени и других органов, а также увеличение продолжительности жизни. У мышей, которым ограничивали калории, также наблюдалось значительное улучшение показателей глюкозы в крови и уровня инсулина по сравнению с другими группами. В целом, у мышей были такие показатели продолжительности жизни. Мыши, которые питались обычно, без ограничений — жили 104-110 недель, с одноразовым в день питанием — 115-117 недель, с ограничением калорий — 132-135 недель.
Как показало вскрытие, все три группы мышей имели одни и те же патологии, но различные сроки их развития. Основными неопухолевым поражением тканей был амилоидоз, причём скопления амилоида были более обширными у мышей-долгожителей, питавшихся с ограничением калорий. Учёные объясняют этот факт более долгой продолжительностью жизни этих мышей.
Примечательно, что по наблюдению исследователей, диетическая композиция не оказывала существенного влияния на продолжительность жизни в подгруппах с одноразовым питанием и ограничением калорий. Учёные связали это с тем, что большие промежутки между приёмами пищи позволяли организму эффективнее задействовать механизмы восстановления: «Увеличение ежедневных сроков голодания без снижения количества калорий и независимо от типа потребляемой диеты привело к общему улучшению здоровья и выживаемости у мышей-самцов. Возможно, этот расширенный ежедневный период времени натощак позволяет восстанавливаться и поддерживать механизмы, которые отсутствовали бы при длительном воздействии продуктов питания». [3]
Средиземноморская диета снижает риск инсультов у женщин
Средиземноморская диета может снижать риск инсульта у женщин старше 40 лет, но не у мужчин, такие данные получены в новым исследовании, проведенным английскими кардиологами.
В статье, вышедшей в сентябре 2018 в журнале Американской кардиологической ассоциации, описывается что диета с высоким содержанием рыбы, фруктов, овощей, орехов и бобов, а также с меньшим количеством мяса и молочных продуктов, снижает риск инсульта среди женщин, которые подвержены высокому риску сердечно-сосудистых заболеваний. Это исследование, по словам учёных, является одним из самых больших и длительных, из направленных на оценку потенциальных преимуществ диеты средиземноморского стиля в снижении риска инсульта. Оно показывает, что такая диета может быть особенно эффективна у женщин старше 40 лет, независимо от состояния менопаузы или заместительной гормональной терапии.
Учёные из университетов Восточной Англии, Абердина и Кембриджа в рамках исследования EPIC study in Norfolk, продолжавшегося 17 лет, изучили диеты 23 232 участников и сравнивали риск инсульта в зависимости от рациона участников.
У участников, которые наиболее постоянно придерживались средиземноморской диеты, уменьшение риска возникновения инсульта было у 22 % женщин и у 6 % мужчин.
«Это исследование показывает нам, что диета в средиземноморском стиле, богатая рыбой, фруктами и орехами, овощами и бобами, а также с меньшим количеством мяса и молочных продуктов, может снизить риск инсульта у женщин старше 40 лет. Но здоровая сбалансированная диета важна для всех, как для молодых, так и для пожилых людей. Непонятно, почему мы обнаружили различия между женщинами и мужчинами, возможно, что компоненты рациона могут влиять на мужчин иначе, чем на женщин. Мы также знаем, что разные подтипы инсульта могут различаться между полами. Наше исследование было слишком маленьким, чтобы проверить это, но обе возможности заслуживают дальнейшего изучения в будущем» — пишут исследователи.
Американская кардиологическая ассоциация в своих рекомендациях также делает акцент на рационе, схожем с средиземноморской диетой: «Американская кардиологическая ассоциация рекомендует придерживаться здорового образа жизни и диету, включающую множество фруктов и овощей, цельные зерновые, обезжиренные молочные продукты, рыбу, птицу, фасоль, не тропические растительные масла и орехи, а также ограничивающую насыщенные жиры, транс-жиры, натрий, красное мясо, сладости и сахаросодержащие напитки; эти диетические составляющие снижают факторы риска сердечных заболеваний и инсульта» [4]
МикроРНК-141-3p, сигнальная молекула SDF-1 и возрастная дисфункция костной ткани
В августе 2018 года в журнале Journal of Gerontology была опубликована статья о взаимосвязи микроРНК-141-3р, сигнальной молекулы SDF-1 (Stromal cell-derived factor-1) и старением костной ткани.
По данным Международного фонда остеопороза, около 30 процентов женщин в постменопаузе в США и Европе имеют остеопороз. По крайней мере, 40 процентов этих женщин и около 30 процентов мужчин такого же возраста имеют повышенный риск переломов из-за хрупкости своих костей для других.
Мезенхимальные стволовые клетки могут дифференцироваться в основные компоненты нашего скелета: формирующиекость остеобласты, костные клетки остеоциты, хрящевые клетки, хондроциты; а также в жировые клетки, адипоциты. SDF-1 является ключевой сигнальной молекулой, которая регулирует дифференцировку стволовых клеток в эти клетки, как показали исследования. Также SDF-1 имеет множество других функций, в том числе помогает мезенхимальным стволовым клеткам попасть в нужное место во время формирования или восстановление костей. Кроме этого, SDF-1 выполняет функции антиоксиданта, защищая клетки от пагубного воздействия окислительного стресса.
Большое значение SDF-1 в поддержании нормального здоровья костей, и тот факт, что уровень этой молекулы уменьшался с возрастом, заставило ученых заинтересоваться тем, как она регулируется. Ученые предположили, что уменьшение уровней SDF-1, по крайней мере в одном из путей, зависит от микроРНК-141-3p.
Ранее проведённые исследования показали, что роль микроРНК-141-3р может быть негативной. Было обнаружено, что эта микроРНК подавляет активность транспортера витамина С, что не позволяло витамину проникать в клетки. Витамин С также важен для здоровья костей, и без достаточного количества транспортеров витамин вместо этого начинает накапливаться вне клетки, где он вызывает окислительный стресс. Исследования на животных показали, что окислительный стресс в мезенхимальных стволовых клетках снижает уровень SDF-1. собирая все имеющиеся данные вместе, исследователи предположили, а затем обнаружили, что более высокий окислительный стресс повышает экспрессию микроРНК-141-3p, что, в свою очередь, снижает уровни SDF-1.
Как в мышиных, так и в человеческих мезенхимальных стволовых клетках, было установлено, что уровни микроРНК-141-3p более низкие в молодых клетках. А в старых клетках уровень этой микроРНК повышался в 3 и более раз. Для уровней же молекулы SDF-1 было обнаружили принципиально противоположное явление – многократное понижение с возрастом. Добавление microRNA-141 к стволовым клеткам, приводил к снижению уровней SDF-1. Последствия этого включают в себя еще один возрастной сдвиг: производство большего количества костных остеокластов, в ущерб остеобластам. Также было замечено, что мезенхимальные стволовые клетки больше дифференцировались в жировые клетки, что тоже, как правило, связано с возрастом.
В рамках всестороннего тестирования их гипотезы, ученые вначале добавляли микроРНК-141-3p в клетки, и наблюдаемая функция костной ткани ухудшилась, затем использовал ингибитор этой микро РНК, и наблюдалось улучшение.
По мнению исследователей, клинические препараты, такие как использованный в их работе препарат для ингибирования микроРНК-141-3р, могли бы в один прекрасный день стать эффективным способом помочь мезенхимальным стволовым клеткам оставаться функциональными, не взирая на возраст и другие условия: «Ингибитор нормализует функцию костей. Мы считаем, что ингибитор клинического уровня может помочь нам сделать то же самое и у людей»
Следующим этапом учёные планируют перейти на модели животных и посмотреть на множество других факторов, участвующих в старении костной ткани. А также выяснить, могут ли более высокие уровни физической активности, которые, как правило, уменьшаться с возрастом, помочь восстановить более здоровый баланс микроРНК-141-3p и SDF-1. Также планируется исследовать и других членов семьи microRNA-141 на предмет их участия в процессах старения [5].
Как «плохие» бактерии побеждают в кишечнике
В сентябре 2018 года в журнале PLOS Pathogens вышла статья английских учёных, которые описали механизм колонизации патогенными бактериями кишечника после приёма антибиотиков.
Уже известно, что антибиотики нарушают естественную защитную флору кишечника, делая людей восприимчивыми к пагоненной бактерии Clostridium difficile. Инфекция этим патогеном (CDI) вызывает большую часть диарейных вспышек, связанных с антибактериальной терапией, и может приводить к потенциально опасным для жизни заболеваниям и осложнениям. C. difficile может вызвать опасную потерю веса и ослабление в течение короткого периода времени В настоящее время существует большая потребность в том, чтобы лучше понять, как C. difficile может влиять на микробиоту кишечника и нарушать кишечный гомеостаз. Размножение этой бактерии происходит в условиях, когда антибиотики убивают другие патогены.
C. difficile является грамположительным спорообразующим анаэробом, который в суровых для её жизни условиях в течение длительных периодов времени. Лечение антибиотиками, направленное против этой бактерии, не даёт нужного результата. 35% пациентов снова бывают подвержены рецидивам инфекции C. difficile. эти факты побудили ученые присмотреться к этой бактерии более пристально, чтобы понять, что делает ее такой слабоуязвимой.
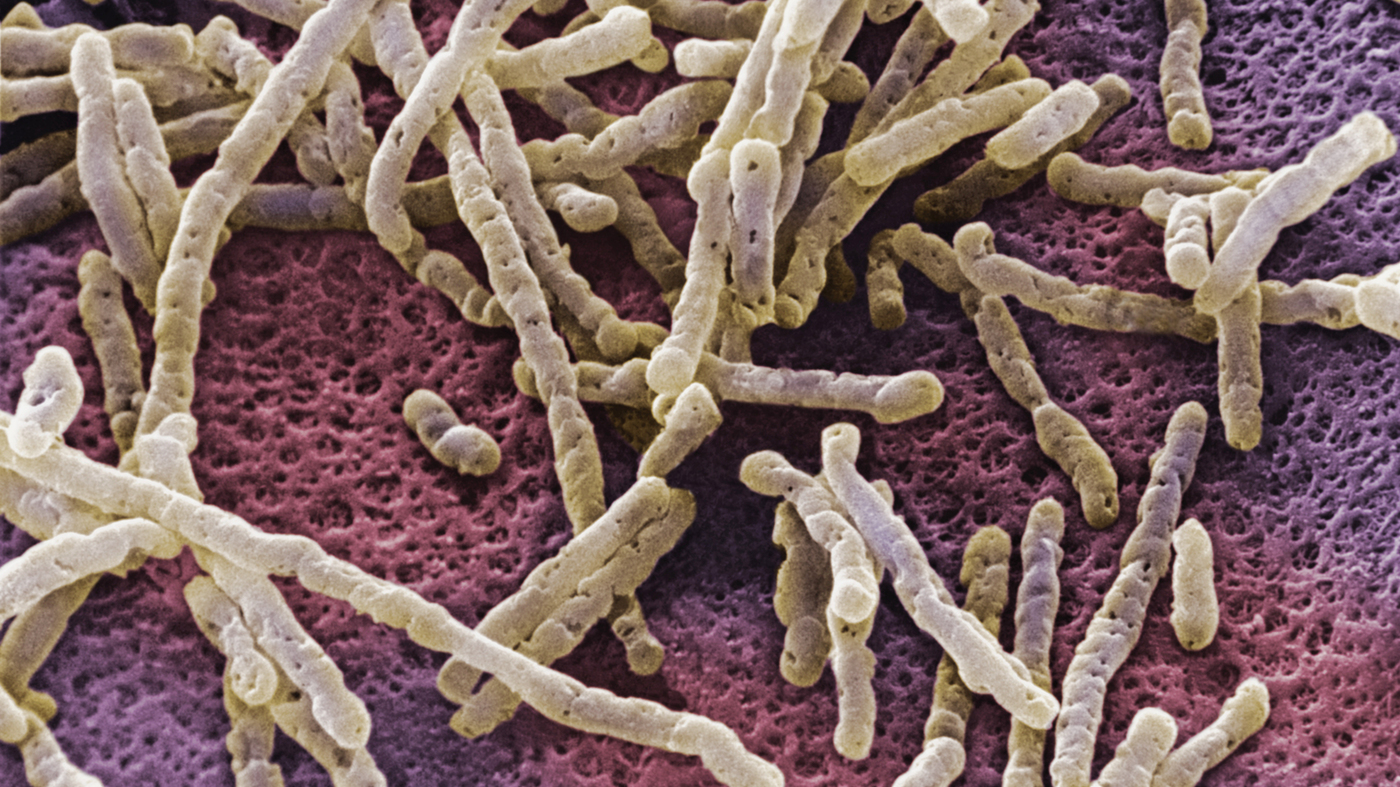
Бактерия Clostridium difficile
Оказалось, что у Clostridium difficile есть секретное оружие. Одной из характерных особенностей C. difficile среди других кишечных бактерий является её способность продуцировать соединение паракрезола (п-крезол) путем ферментации тирозина. П-крезол оказывает вредное воздействие на естественные защитные кишечные бактерии. Ученые обнаружили, что п-крезол избирательно нацеливается на определенные бактерии в кишечнике и нарушает их способность к росту. т Что создавало конкурентные преимущества для C. difficile.
В качестве подтверждения этому, учёные исследовали штаммы мутантного C. difficile, которые не могли продуцировать п-крезол. Такие бактерии были менее способны конкурировать с другими видами микробиоты кишечника, и таким образом, менее способны повторно колонизировать кишечник после первичной инфекции. «Наше исследование дает новое понимание эффектов производства п- крезола на здоровую микрофлору кишечника и как она способствует выживанию и патогенезу Clostridium difficile. Мы обнаружили, что основной кишечный патоген Clostridium difficile производит бактериостатический агент паракрезол, который помогает контролировать микробиоту кишечника и обеспечивает C. difficile конкурентными преимуществами роста, особенно после потребления антибиотиков. Этот уникальный признак патогена может обеспечить новую лекарственную мишень для снижения инфекций, вызванных C. difficile » [6]
Белок NLRP12 и бактерии Lachnospiraceae защищают от ожирения и резистентности к инсулину
В ещё одном исследовании, связанном с микрофлорой кишечника, учёные описали противовоспалительную функцию белка NLRP12, который оказывал положительное влияние на профилактику ожирения и диабета. NLRP12 способствовал росту колоний «хороших» бактерий, обитающих в кишечнике, Lachnospiraceae, которые продуцируют небольшие молекулы бутирата и пропионата. Эти вещества, в свою очередь, положительно влияют на здоровье кишечника и препятствуют развитию ожирения и резистентности к инсулину.
У людей NLRP12 продуцируется несколькими типами иммунных клеток и, по-видимому, функционирует как тормоз чрезмерного воспаления. Более ранние работы показали, что мыши с нокаутом гена Nlrp12 очень восприимчивы к воспалению, включая экспериментальное воспаление толстой кишки (колит) и связанный с ним рак толстой кишки.
В этом исследовании ученые кормили мышей с нокаутом гена Nlrp12 (Nlrp12 -knockout) и обычных мышей едой с высоким содержанием жиров в течение нескольких месяцев. Nlrp12-knockout-мыши ели и пили не больше, чем их здоровые собратья, но накопили значительно больше жира и прибавили сильно в весе. У нокаутных мышей также были обнаружены признаки резистентности к инсулину, что связано с уменьшенной способностью усваивать глюкозу и, как правило, следует за развитием ожирения.
Отсутствие Nlrp12 у этих мышей привело к увеличению признаков воспаления в кишечнике и жировых отложениях, но было неясно, как это привело к увеличению лишнего веса. На следующем этапе мышей с нокаутом Nlrp12 разделили на две группы, одной из которых провели терапию антибиотиками. В результате у мышей из этой группы было замечено снижение веса, и это позволило учёным предположить что кишечные бактерии участвуют в развитии ожирения. Дальнейшие испытания показали, что когда мышей с нокаутом Nlrp12 поддерживали в условиях без бактерий, мыши не набирали вес, и отсутствие Nlrp12 не сказывалось. Это показало, по мнению учёных, что «плохие» бактерии приводили избыточное увеличение веса во время диеты с высоким содержанием жиров. Примечательно, что нокаутные мыши также были защищены от ожирения, когда они жили совместно с контрольными мышами, что может говорить о том, что «хорошие» бактерии от контрольных мышей попадали в нокаутированных и помогали защитить их.
Также исследователи вводили мышам с нокаутом Nlrp12 полезные бактерии Lachnospiraceae и обнаружили, что эти бактерии уменьшали воспаление кишечника, устраняли гегемонию вредных бактерий Erysipelotrichaceae и способствовали увеличению разнообразия микробиоты. Lachnospiraceae также значительно защищали животных от ожирения и связанной с ним резистентности кинсулину. Lachnospiraceae содержат ферменты, которые превращают углеводы и волокна в небольшие молекулы, называемые короткоцепочечными жирными кислотами (SCFA).Ученые заметили, что две из них, в частности, бутират и пропионат, оказались в значительно большем количестве, когда количество Lachnospiraceae в кишечнике увеличивалось. Известно, что бутират и пропионат обладают противовоспалительными свойствами, которые способствуют здоровью кишечника. Исследователи давали бутират и пропионат мышам Nlrp12 -knockout и обнаружили, что они защищали животных в отсутствии Nlrp12 так же хорошо, как и бактерии Lachnospiraceae.
«Все воспалительные и метаболические изменения, которые мы наблюдали у мышей Nlrp12 -knockout во время диеты с высоким содержанием жиров, были существенно отменены, когда мы повторно поставляли им Lachnospiraceae. Ожирение зависит от воспаления, а не только от переедания и отсутствия физических упражнений, и это исследование предполагает, что уменьшению воспаления способствуют «хорошие» бактерии в кишечнике, которые помогают поддерживать здоровый вес. У мышей NLRP12 уменьшает воспаление в кишечнике и жировых тканях. Также известно, что у людей, страдающих ожирением, снижены уровни экспрессии NLRP12 » — пишут исследователи [7].
Найдена молекула, имеющая потенциал в профилактике болезни Паркинсона
В сентябре этого года в журнале PNAS была опубликован статья испанских учёных новой молекуле, которая может помочь в предотвращении нейродегенераций. Применив надевно недавно разработанный ими высокопроизводительный скрининг-анализ, исследователи идентифицировали SynuClean-D, небольшое соединение, которое ингибирует агрегацию ?-синуклеина, разрушает зрелые амилоидные фибриллы, предотвращает распространение фибрилл и отменяет дегенерацию дофаминергических нейронов на животной модели болезни Паркинсона.
Молекулярные события, вызывающие развитие болезни Паркинсона, ведут к аномальной агрегации белка ?-синуклеина в дофаминергических нейронах. Агрегирование ?-Syn также встречается в олигодендроцитах у пациентов с множественная системной атрофией (MSA). ?-Syn является белком, который экспрессируется в значительном количестве в головном мозге. Предполагается, что функция ?-Syn связана с движением везикул. Этот белок является основным компонентом телец и нейритов Леви при болезни Паркинсона.
Для обнаружения SynuClean-D была разработана методология, позволяющая индексировать ингибиторы агрегации ?-синуклеина среди тысяч разных молекул. После идентификации учёными была проведена биофизическая проверка in vitro ингибирующей активности SynuClean-D, были проведены тесты для определения механизма действия SynuClean-D в культуре нейронных клеток человека, прежде чем тестировать это вещество на животных моделях. В качестве такой модели был взяты два вида червей Caenorhabditis elegans. Они экспрессируют ?-синуклеин в мышцах и в дофаминергических нейронах. Эксперименты показали, что введение идентифицированного ингибитора, SynuClean-D, снижало агрегацию белка, улучшало подвижность животного и защищало его от нейронной дегенерации.
«По-видимому, все указывает на то, что молекула, которую мы идентифицировали, SynuClean-D, может предоставить терапевтические применения для лечения нейродегенеративных патологий, таких как болезнь Паркинсона в будущем. В целом, SynuClean-D представляется многообещающей молекулой для терапевтического вмешательства при болезни Паркинсона» — пишут учёные. [8].
?-гидроксибутират замедляет старение сосудов
В сентябре в журнале Molecular Cell вышла статья американских учёных, посвящённая профилактике возрастных сердечно-сосудистых патологий. Молекула, которая продуцируется во время голодания или ограничения калорийности, оказывает антивозрастное действие на сосудистую систему, что может уменьшить возникновение и тяжесть заболеваний человека, связанных с кровеносными сосудами, согласно исследованию, проведенному Университетом штата Джорджия.
По мере того, как люди становятся старше, они более восприимчивы к заболеваниям, таким как рак, сердечно-сосудистые заболевания или болезнь Альцгеймера. Возраст является самым важным фактором риска развития заболеваний человека. Важнейшей частью старения является старение сосудов. С возрастом сосуды становятся очень чувствительны к различным повреждениям, поэтому изучение сосудистого старения представляется очень важным.
В данной работе учёные исследовали малоизвестный механизм позитивного действия ограничения калорий (уменьшения еды или полного голодания) на возрастные процессы. Исследователи определили важную небольшую молекулу, которая вырабатывается во время стресса и при недостатке питания – ?-гидроксибутират. Это вещество является одним из видов кетоновых тел, и продуцируется печенью из жирных кислот в периоды низкого потребления пищи, углеводно-ограничивающих диет, голодания и длительного интенсивного физического упражнения.
Исследователи проследили всю цепочку положительного воздействия ?-гидроксибутирата. Вначале он воздействовал на ядерный рибонуклеопротеин A1 (hnRNP A1) в качестве прямой связывающей мишени. На следующем этапе hnRNP A1 усиливал экспрессию транскрипционного фактора Oct4. Ну а затем Oct4 повышал уровни Lamin B1, ключевого фактора, противостоящего возраст зависимому повреждению ДНК. Голодание и внутрибрюшинная инъекция ?-гидроксибутирата активировала Oct4 и Lamin B1 как в гладких мышцах сосудов, так и в эндотелиальных клетках у мышей in vivo. Учёные сделали вывод, что ?-гидроксибутират оказывает антивозрастное действие в сосудистых клетках путем активирования пути Lamin B1 индуцированием hnRNP A1 и Oct4. [9]
Очень малое и чрезмерное потребление алкоголя повышает риск деменции
В августе 2018 года вышла статья французских и английских исследователей о влиянии разных доз алкоголя на развитие деменции. 9087 участников в возрасте 35-55 лет наблюдение за которыми продолжалось 23 года в рамках исследования Whitehall II, которое рассматривало влияние социальных, поведенческих и биологических факторов на долгосрочное здоровье, были разделены на три группы. Первая группа участников состояла их практически не пьющих людей (учёные отнесли их к категории абсистенции, т.е. воздержания). Вторая группа участников употребляла от 1 до 14 стандартных алкогольных единиц (unit) в неделю. Алкогольная единица в среднем составляет около 12 грамм чистого спирта. В пересчёте на спиртные напитки, вторая, умеренно пьющая группа, получается, употребляла по бутылке пива или бокалу вина в день. И третья группа употребляла более 14 алкогольных единиц в неделю.
Как показали результаты долгосрочных наблюдений, больше всего риску возникновения деменции были подвержены люди, которые или почти совсем не употребляли алкоголь (категория абсистенции) или пили более 14 единиц в неделю. Если с пьющей группой связь с деменцией вполне логична и объяснима, то попадание в категорию риска по развитию нейропатологий непьющих людей, стало сюрпризом для учёных.
Проведённый анализ показал, что избыточный риск деменции, связанный с воздержанием от алкоголя в зрелом возрасте, частично объяснялся кардиометаболическими заболеваниями, которые были как сопутствующий фактор у непьющих людей. Авторы особо подчёркивают, что их результаты не следует рассматривать, как призыв к непьющим людям начать употреблять алкоголь: «Наши результаты усиливают доказательства того, что чрезмерное потребление алкоголя является фактором риска развития деменции и поощряют использование более низких пороговых значений потребления алкоголя в руководящих принципах для содействия когнитивному здоровью в пожилом возрасте. И наши выводы не должны мотивировать людей, которые не пьют, начать пить, учитывая известные отрицательные последствия употребления алкоголя, касающиеся смертности, нейропсихиатрических расстройств, цирроза печени и рака» [1]
Вместе с этим, в августе этого же года вышла ещё одна статья, в которой описывалось, что, скорее всего, не существует безопасной дозы алкоголя. В рамках масштабного исследования Global Burden of Diseases, Injuries, and Risk Factors Study 2016 учёные проанализировали данные, содержащиеся в 694 научных работах о потреблении алкоголя на индивидуальном и популяционном уровнях, а также 592 перспективных и ретроспективных исследования риска употребления алкоголя. Полученные данные показали, что для укрепления здоровья лучше не пить совсем: «Уровень потребления алкоголя, который сводил к минимуму вред здоровью, был равен нулю». [2]
Список литературы
- Severine Sabia, Aurore Fayosse, Julien Dumurgier, Aline Dugravot, Tasnime Akbaraly, Annie Britton, Mika Kivimaki, Archana Singh-Manoux. Alcohol consumption and risk of dementia: 23 year follow-up of Whitehall II cohort study. BMJ, 2018;
- GBD 2016 Alcohol Collaborators. Alcohol use and burden for 195 countries and territories, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 2018 Sep 22;392(10152):1015-1035.
- Mitchell SJ, Bernier M et al… Daily Fasting Improves Health and Survival in Male Mice Independent of Diet Composition and Calories. Cell Metab. 2018 Aug 24. pii: S1550-4131(18)30512-6.
- Katherine E. Paterson, Phyo K. Myint Amy Jennings, Lucy K.M. Bain,Marleen A.H. Lentjes, Kay-Tee Khaw, and Ailsa A. Welch. The Mediterranean Diet Reduces Risk of Incident Stroke in a Population with Varying Cardiovascular Disease Risk Profiles. Stroke, September 20, 2018.
- Sudharsan Periyasamy-Thandavan, John Burke, Bharati Mendhe, Galina Kondrikova, Ravindra Kolhe, Monte Hunter, Carlos M Isales, Mark W Hamrick, William D Hill, Sadanand Fulzele. MicroRNA-141-3p negatively modulates SDF-1 expression in age dependent pathophysiology of human and murine bone marrow stromal cells. The Journals of Gerontology: Series A, 2018
- Ian J. Passmore, Marine P. M. Letertre, Mark D. Preston, Irene Bianconi, Mark A. Harrison, Fauzy Nasher, Harparkash Kaur, Huynh A. Hong, Simon D. Baines, Simon M. Cutting, Jonathan R. Swann, Brendan W. Wren, Lisa F. Dawson. Para-cresol production by Clostridium difficile affects microbial diversity and membrane integrity of Gram-negative bacteria. PLOS Pathogens, 2018; 14 (9): e1007191
- Truax AD, Chen L et al. The Inhibitory Innate Immune Sensor NLRP12 Maintains a Threshold against Obesity by Regulating Gut Microbiota Homeostasis. Cell Host Microbe. 2018 Sep 12;24(3):364-378.e6.
- Jordi Pujols, Samuel Pena-Diaz, Diana F. Lazaro, Francesca Peccati, Francisca Pinheiro, Danilo Gonzalez, Anita Carija, Susanna Navarro, Maria Conde-Gimenez, Jesus Garcia, Salvador Guardiola, Ernest Giralt, Xavier Salvatella, Javier Sancho, Mariona Sodupe, Tiago Fleming Outeiro, Esther Dalfo, Salvador Ventura. Small molecule inhibits ?-synuclein aggregation, disrupts amyloid fibrils, and prevents degeneration of dopaminergic neurons. Proc Natl Acad Sci U S A. 2018 Sep 24. pii: 201804198.
- Han YM, Bedarida T, Ding Y, Somba BK, Lu Q, Wang Q, Song P, Zou MH. ?-Hydroxybutyrate Prevents Vascular Senescence through hnRNP A1-Mediated Upregulation of Oct4. Mol Cell. 2018 Sep 20;71(6):1064-1078.e5.
Комментарии (25)

halted
13.10.2018 11:56+1Статья скорее является подтверждением предыдущих исследований. Особенно исследование зависимости объема потребляемой пищи и активности митохондрий.

LevOrdabesov
13.10.2018 15:39Увеличение времени между приёмами пищи и ограничение калорий продлевает жизнь
Остаётся ли при этом жизнь такой же насыщенной, как при нормальном питании, вот в чём вопрос.
Если результатом голодовки является просто общее замедление всех процессов в организме, то ничего ни удивительного, ни хорошего в этом нет.
ryo_oh_ki
13.10.2018 17:57+1С точки зрения эволюции нужно оценивать репродуктивный успех особей, а не их продолжительность жизни. Думается, что голодающие мыши вообще не способны нормально приносить потомство…

bioxakep
13.10.2018 18:16+2С точки зрения личности точка зрения эволюции, тем более чисто биологической, до звезды. Смысл в том, чтобы дотянуть до более радикальных прорывов, когда уже "репродуктивный успех особей" будет оцениваться колонизацией каких-нибудь отдаленных звездных систем через хз сколько лет.

LevOrdabesov
13.10.2018 18:18+4С точки зрения эволюции нужно оценивать репродуктивный успех особей, а не их продолжительность жизни.
Формально это верно.
Но подозреваю, что исследователи от старения не мышей собрались спасать.
А к людям подход уже совсем другой.
Кстати говоря, и фраза из статьи лучше отразит суть, будучи сформулированной так:
Согласно единичному исследованию, увеличение времени между приёмами пищи и ограничение калорий продлевает жизнь лабораторных мышей примерно на 20%, данные об активности внутри групп и репродуктивной эффективности не приводятся.

DistortNeo
13.10.2018 21:03Кстати, да. Мужчины-кастраты имели большую продолжительности жизни, чем обычные люди. Стерилизация до наступления полового созревания действительно может увеличить продолжительность жизни.
Читал, кстати, какую-то статью, тоже с экспериментами на мышах и урезанным питанием. Там было так: если мышь посадить на голодный паёк с рождения, она проживёт дольше, но половое созревание не наступит, если же после полового созревания — увеличения продолжительности жизни не будет.
shopoloff
14.10.2018 18:22Может потому что мужчины-кастраты были особой кастой приближенной к чему-то, что как правило нужно было хранить, вроде гаремов. Соответственно и уровень жизни у них был выше чем у остальных мужчин.

DistortNeo
14.10.2018 19:29www.sciencedirect.com/science/article/pii/S0960982212007129
The average lifespan of eunuchs was 70.0 ± 1.76 years, which was 14.4–19.1 years longer than the lifespan of non-castrated men of similar socio-economic status.

DistortNeo
13.10.2018 20:57+1И ещё вопрос: допустимо ли проводить аналогию между человеком и мышью?
Во-первых, у человека, по сравнению с другими животными, обмен веществ ниже в несколько раз. Во-вторых, чтобы у человека хоть сколько-то существенно замедлился базовый обмен, нужно голодать на уровне узников концлагерей. Человек скорее умрёт от голода и болезней.
randall
13.10.2018 22:13+1Если бы аналогия была бы недопустима, развитие медицины остановилось бы и откатилось на сотню лет назад. Работает конечно не всё и не всегда так, как нам нужно, но мышь такое же млекопитающее, как мы с вами. То что убивает мышь, и нас убивает. И наоборот, весьма часто то, что продляет жизнь мышам, на людях, как показывают исследования, тоже хорошо срабатывает. По голоданию есть множество исследований, в том числе тех самых узников концлагерей. Ну и кроме мышей ограничение калорийности питания также успешно проверяли на обезьянах.

arielf
14.10.2018 21:56Вы правы, увы. Ограничение калорий увеличивает жизнь мух в 10 раз, мышей в лучшем случае в 1,5 — 2 раза, у близких к нам приматов — не более пары процентов. В общем, нужны иные пути — регенеративная медицина и биоинеженерия.

ClearAirTurbulence
14.10.2018 01:00Она будет очень насыщенной, т.к. при таких режимах питания высок риск развития гастрита, а с ним будет очень весело.

zartarn
14.10.2018 01:09В предыдущих исследованиях не увеличивали время между приемами пищи, а «заставляли организм думать» что диффицит есть, используя для этого периодическое голодание, раз в несколько дней сильно занижали ккалорийность.
Не припомню чтоб гастроэнтеролог что то говорил про время приема. Желудочный сок вырабатывается в процессе еды, а не по расписанию. Можно питаться меньшее количество раз в день, главное соблюдать суточную ккалорийность и соотношение макронутриентов и всего остального. Другое дело что это не всем комфортно, комфортнее когда сахар в крови не скачет и потому подпитывать себя в течении дня.
LadyOlga
15.10.2018 10:15Не припомню чтоб гастроэнтеролог что то говорил про время приема.
Говорят (правда у меня язва уже а не гастрит, но при гастрите вроде говорили тоже самое). «Разбить приемы пищи на 5-6 раз» Получается, сделать так, что бы желудок был почти постоянно немного заполнен пищей.

ClearAirTurbulence
15.10.2018 13:55Исходил из водписи к картинке:
Вторая подгруппа мышей (meal-fed) — получавшая пищу один раз в день
Мыши, конечно, не люди, и у них может быть немного по-другому.
Но вообще если не питаться регулярно — вероятность гастрита годам к сорока существенно повышается. Как говорил один врач «лучше хоть чуть-чуть, и даже всухомятку, чем никак».
zartarn
15.10.2018 14:04Да нет там в исследованиях прям такого голодания прям уж. А к 40 гастрит может появляться на фоне других проблем — повышенной кислотности и т.д. Да и никто не говорит что прям вобще не есть, есть просто объемы меньше. Суммарная ккалорийность. Можно заменять одни продукты на другие такого же объема но менее ккалорийные, и чувство сытости будет. Главное баланс по макронутриентам и бжу. А количество приемов пищи, тут делим суточную ккалорийность так, чтоб не возникало чувство голода. Будет голод, т.е. некомфортно так питаться, будут срывы. У Олега Тёрна на эту тему была нелпохая работа («Пятнашки» кажется называлась). Про объемы пищи, как делить. Есть просто красивая методичка, а есть именно с объяснениями по бжу и что откуда взялось.

zartarn
13.10.2018 22:13Морили голодом мышей в 2018?? Но вроде же в начале 2000х на крысах это уже было (правда у крыс почти в 2 раза отличалось разница в возрасте). Потом такой же опыт ставили в 2014 на приматах. Вот тут, еще 2 года назад видел. Интересно что тут нового.
( с привязкой ко времеми)


tormozedison
Да тот, кто делал КДПВ — большой любитель советской мультипликации, однако!