Метилирование ДНК представляет из себя один из эпигенетических механизмов регуляции экспрессии генов. В ходе метилирования метильная группа СН3- специальными ферментами присоединяется к одному из оснований ДНК, цитозину. В результате чего образуется 5-метилцитозин и происходит инактивация экспрессии генов — процесс транскрипции блокируется. Как сегодня известно, метилирование ДНК – это процесс динамический. Оно может изменяться под воздействием внешних факторов, связано с развитием ряда патологий и может наследоваться следующими поколениями. Метилирование играет одну из ключевых ролей в деактивации чужеродной ДНК, а также в процессах развития и старения. Описаны возрастные изменения метилирования, получившие название «эпигенетического дрейфа». Так, с возрастом наблюдается гипометилирование (деметилирование) и связанная с этим хромосомная нестабильность. Кроме этого, при старении происходит и обратный процесс – гиперметилирование некоторых промоторных областей, в том числе определенных генов-супрессоров опухолей, что связано с развитием патологий [1]. В целом, сегодня считается, что изменение метилирования играют одну из ключевых ролей в старении.
Исходя из того факта, что хронологический возраст связан с предсказуемыми изменениями эпигенома, гипо- и гиперметилированием во многих регионах по всему геному, было разработано первое поколение эпигенетических биомаркеров старения на основе метилирования ДНК. В 2011 году вышла первая статья ученых Калифорнийского университета в Лос-Анжелесе, под названием «Эпигенетический предсказатель возраста» показавшая, что метилирование ДНК имеет чёткую взаимосвязь с возрастом. В 2103 году Стив Хорват посредством компьютерной методики машинного обучения определил 353 сайта метилирования, имевших высокую корреляцию с хронологическим возрастом человека, которые легли в основу первых «эпигенетических часов» или «часов Хорвата»[2].
Важность этого открытия сложно переоценить. Надо сказать, что история успеха С. Хорвата полна не придуманного драматизма. По воспоминаниям самого Хорвата, его статью о новом эпигенетическом методе измерения возраста поначалу не хотели принимать не в один из журналов. Ему постоянно приходилось слышать от рецензентов одну и ту же фразу, что «это слишком хорошо, чтобы быть правдой». Но Хорват не сдавался и всё своё время посвящал доработке нового метода: «Я писал в каждое свободное время, как будто это было последнее время для завершения моей статьи». Перед самым завершением работы в семье Хорвата случилось несчастье – умерла его недавно родившаяся дочь. Но и это не выбило из колеи упорного учёного. Последнюю редакцию его статьи снова не приняли в Genome Biology. И получив очередной критический комментарий от рецензентов, Хорват, по его воспоминаниям, сделал три вещи, которые не следует делать: «Прочитав комментарии рецензентов, я провел следующие 10 минут, делая три вещи, которые никогда не следует делать. Во-первых, я пошел к холодильнику и выпил три бутылки пива так быстро, как только мог. Во-вторых, я вернулся к компьютеру и составил письмо редактору. В-третьих, я его отправил». И на этот раз фортуна улыбнулась ему, его статья была принята.

Стив Хорват.
Чем могут быть полезны «эпигенетические часы»? По мнению автора открытия, этот метод может сыграть большую роль при оценке эффективности антивозрастных вмешательств, так как позволяет значительно сократить период ожидания результатов. Кроме этого, предполагается, что идентифицированные Хорватом участки метилирования не просто маркеры, а и активные участники старения (по крайней мере некоторые). Что даёт в руки исследователей потенциальную терапевтическую мишень в борьбе со старением и возрастными патологиями. Также этот новый метод может быть полезен в уголовно-процессуальных действиях, когда по образцам ткани требуется установить возраст. Но, конечно, самое большое значение «эпигенетические часы» приобрели впоследствии в прогнозировании заболеваний и повышения риска смертности.
Как выяснилось, «эпигенетические часы» показывали значение «ноль» в эмбриональных стволовых и индуцированных плюрипотентных клетках, сперматозоидах, яйцеклетках и клетках плаценты. А в течении первых 5 лет жизни – ускоренный ход, связанный с развитием организма. К 21 году «эпигенетические часы» постепенно замедляли свой ход, и затем шли с более менее равномерной скоростью, меняя свои показатели под воздействием внешних факторов. Причем, выяснилось, что разные ткани стареют с разной скоростью. Самой подверженной процессам старения оказалась ткань молочных желёз у женщин. Наиболее медленно с точки зрения эпигенетики стареет головной мозг, а клетки крови и костной ткани демонстрируют немного ускоренное старение [3].
В том же 2013 году вышла статья китайских и американских учёных, представлявшая ещё одну версию «эпигенетических часов» – «часы Ханнума». Биоинженер Калифорнийского университета в Сан-Диего Грегори Ханнум с коллегами изучили профили метилирования ДНК 450 000 CpG-динуклеотидов из клеток крови людей возрастом от 19 до 101 года, выделив в итоге 71 сайт метилирования, наиболее коррелированный с возрастом [4]. Главное отличие «часов Ханнума» от «часов Хорвата» состоит в их специфичности: образцы ДНК берутся из клеток крови, а не из любой ткани, как у метода Хорвата.
Довольно быстро выяснилась главная ценность «эпигенетических часов». Сравнение их хода с хронологическим возрастом имеет большую прогностическую ценность для оценки риска смертности от всех причин и развития многих патологий. Если «эпигенетические часы» спешат – возникают болезни, ускоренное старение и укорочение срока жизни. Если идут медленнее хронологического возраста – есть неплохие шансы на долгожительство. Проведённые исследования показали, что «эпигенетические часы» имеют высокую корреляцию со смертностью от всех причин и возрастными заболеваниями.
В 2015 году Хорват с коллегами провёл исследования, чтобы определить взаимосвязь между возникновением рака лёгкого и показателями эпигенетического возраста. После анализа данных 2 029 человек было установлено, что ускорение эпигенетического возраста было связано с увеличением риска возникновения рака лёгкого, и эта взаимосвязь была сильнее у курильщиков и лиц старше 70 лет: «Результаты показали, что стандартизированные показатели ускорения эпигенетического возраста (IEAA) были в значительной степени связаны с заболеваемостью раком легких (HR: 1,50, P = 3,4 ? 10 -3 ). Кроме того, мы показали, что ассоциация может быть еще более сильной среди пожилых людей (70 лет или старше) или тех, кто является курильщиками в настоящее время. В целом, наши результаты показывают, что IEAA может быть полезным биомаркером для оценки восприимчивости к раку легких с точки зрения биологического старения» [5].
В том же году ещё одна группа исследователей установила взаимосвязь «эпигенетического возраста» с риском смертности от всех причин у людей старше 60 лет. Для анализа были взяты данные из четырех исследований (всего 4658 человек), средний возраст участников которых составил 79,1, 69,5, 66,3 и 72,9 лет соответственно. Эпигенетический возраст определялся двумя методами: «часами Хорвата» (на основе 353 CpG сайтов метилирования) и «часами Ханнума» (на основе 71 CpG сайта метилирования). Оба метода показали сильную корреляцию друг с другом, хотя базовые наборы имели совпадения лишь по 6 CpGs сайтам. Результаты исследования показали, что ускорение «эпигенетического возраста» по сравнению с хронологическим на 5 лет увеличивало риск смертности у людей на 16%. Авторы сделали вывод: «Показатели ускоренного старения, полученные на основе метилирования ДНК, являются наследуемыми факторами, которые прогнозируют смертность независимо от состояния здоровья, факторов образа жизни и известных генетических факторов. Поэтому можно предположить, что предсказанный возраст метилирования ДНК является «эпигенетическимb часами», которые измеряют биологический возраст, идущий вместе, но не всегда параллельно с хронологическим возрастом, и могут давать прогнозы ожидаемой продолжительности жизни» [6].
В 2016 году немецкие онкологи провели исследование, описавшее взаимосвязь между ускоренным эпигенетическим старением и смертностью от онкологических и сердечно-сосудистых болезней и всех других причин. Для своей работы они использовали «эпигенетические часы» Хорвата и Ханнума. Возраст метилирования ДНК оценивали в когорте из 1863 пожилых людей, участников исследования ESTHER, средний возраст которых был 62,5 лет. Полученные результаты показали, что эпигенетический возраст, превышающий хронологический, был связан с более высокой смертностью. Ускорение на 5 лет «эпигенетического возраста», определённого по методу Хорвата, давало увеличение смертности на 22%, и на 16% – с использованием метода Ханнума [7].
В 2016 году большая международная команда исследователей во главе со Стивом Хорватом провели масштабный метаанализ, в котором были исследованы данные 13 089 человек из трех расовых / этнических групп: белых, латиноамериканцев и афроамериканцев. Эпигенетический возраст здесь также определялся двумя методами: «часами Хорвата» и «часами Ханнума». Эта работа показала, что ускорение «эпигенетических часов» на 1 год (по сравнению с хронологическим возрастом) повышало риск смертности от всех причин до 4 %. Причём, наблюдался и противоположный эффект: замедление хода «эпигенетических часов» приводило к понижению риска смертности. Кроме этого, исследователи зафиксировали интересный феномен: «Мы обнаружили, что 5 процентов людей имеют более быстрый ход биологического возраста, что приводит к более короткой продолжительности жизни. Ускоренное старение увеличивает риск смерти этих людей на 50 процентов в любом взрослом возрасте».[8, 9].
Также уже известны целый ряд внешних факторов, влияющих на ход «эпигенетических часов». В 2017 году Хорват с коллегами описали взаимосвязь рациона, употребления алкоголя, образования и физических упражнений с ходом эпигенетического времени. По утверждению самих авторов, их работа подтвердила давно известную истину: рацион с овощами, рыбой и постным мясом, умеренное потребление алкоголя, физическая активность и образование замедляют ход эпигенетического времени и способствуют продлению жизни. Ускоряли старение эпигенома повышенные уровни инсулина и глюкозы, С-реактивного белка и триглицеридов, а также излишняя масса тела и повышенное артериальное давление. В этом же исследовании учёные не нашли положительного влияния антидеабетического препарата метформина на ход эпигенетического времени [10]. В том же году финские исследователи ещё раз продемонстрировали взаимосвязь ожирения с ускоренным эпигенетическим старением [11]
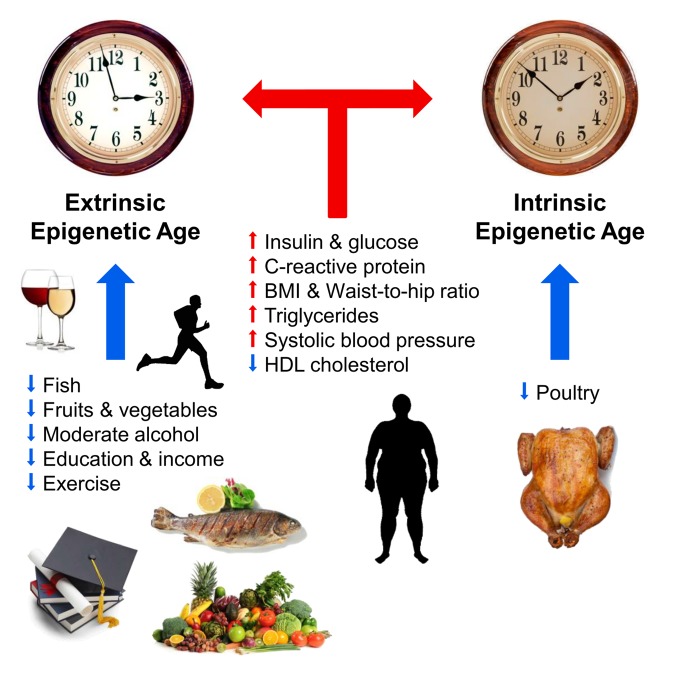
Рис. 1 Факторы, влияющие на эпигенетический возраст (из [10]).
Синие и красные стрелки показывают факторы, замедляющие и ускоряющие старение соответственно. Часы символизируют внешние эпигенетические часы (extrinsic epigenetic clock, расширенная версия метода Ханнума) и внутренние эпигенетические часы (intrinsic epigenetic clock, часы Хорвата). Положительно влияют на ход эпигенетического времени (замедляют): рыба, птица, овощи и фрукты, липопротеины высокой плотности, умеренный алкоголь, образование и физическая активность. Негативно влияют на ход эпигенетического времени (ускоряют): повышенные уровни инсулина, глюкозы, С-реактивного белка, триглицеридов, повышенное артериальное давление, повышенная масса тела и неправильное соотношение объёмов талии и бёдер.
Разные команды исследователей провели работы, описавшие взаимосвязь хода эпигенетического времени с физической и когнитивной функциями, синдромами Дауна и Вернера, ВИЧ-инфекцией, болезнью Альцгеймера и менопаузой [12-17]. Также была продемонстрирована четкая взаимосвязь между долгожительством и замедлением хода «эпигенетических часов» на примере итальянских 100-летних долгожителей [18]. Долгое время Стиву Хорвату не удавалось с помощью своего метода предсказать ускоренное течение биологического возраста при прогерии Хатчинсона-Гилфорда. Но в этом году такая задача была решена: им и его коллегами были созданы специальные «эпигенетические часы» на основе фибробластов, состоящие из 391 CpG сайтов, названные «skin-blood clock» [19].
Следующим этапом работы С. Хорвата была разработка более эффективного биомаркера старения, с улучшением диагностических возможностей, предсказывающих риск смертности от разных причин и развитие возрастных заболеваний. Недостатком предыдущих «эпигенетических часов», по мнению Хорвата, было то, что использование хронологического возраста в качестве эталона по определению возрастных отклонений может исключать CpG сайты, профили метилирования которых не проявляют сильных, зависящих от времени изменений. А вместо этого показывают лишь расхождение биологического и хронологического возраста. Таким образом, важно не только захватить CpG, которые отображают разницу с хронологическим временем, но также и те, которые демонстрируют различия в риске и физиологическом статусе среди лиц одного и того же хронологического возраста..В 2018 году новый биомаркер, получивший название DNAm PhenoAge, был создан.
На первом этапе команда С. Хорвата проанализировала на большой выборке людей, 9926 человек, участников исследования NHANES III, взаимосвязь 42 клинических биомаркеров и хронологического возраста с риском смертности. В результате было определено 9 биомаркеров для предсказания фенотипического возраста:
1. Альбумин
2. Креатинин
3. Глюкоза
4. С-реактивный белок
5. Процент лимфоцитов
6. Средний объём эритроцитов
7. Ширина распределения эритроцитов
8. Количество лейкоцитов
9. Щелочная фосфотаза.
Затем они провели валидацию выбранных биомаркеров – проверили свою модель фенотипического возраста на другой выборке людей (6209 человек). Проверка показала взаимосвязь повышения фенотипического возраста с увеличением риска смертности от всех причин: однолетнее увеличение фенотипического возраста было связано с 9-% увеличением риска смертности от всех причин, 9% увеличением риска смертности от связанных со старением заболеваний, 10% увеличением риска смертности от сердечно-сосудистых заболеваний, 7% увеличением риска смертности от рака, 20% увеличением риска смертности от диабета и 9% увеличением риска смерти от респираторных заболеваний.
На втором этапе исследования авторы связали метилирование ДНК с фенотипическим возрастом. Учёные определили, какие именно метилированные GpC сайты связаны с этими 9 клиническими биомаркерами, прогнозирующими фенотипический возраст. Ими были определены 513 CpG таких сайта, которые прогнозировали фенотипический возраст. Новый эпигенетический маркер был назван DNAm PhenoAge. Проверка показала довольно большую точность нового биомаркера: между 1998 и 2007 годами среднее изменение DNAm PhenoAge составляло 8,51 года, тогда как среднее изменение в клиническом фенотипическом возрасте составило 8,88 года.
После этого исследователи провели «обкатку» своего нового биомаркера маркера, используя данные 4 больших исследований, Women’s Health Initiative (n=4207), Framingham Heart Study (n=2553), Normative Aging Study (n=657) и Jackson Heart Study (n=1747). Результаты показали, что DNAm PhenoAge был значительно связан с последующим риском смертности во всех исследованиях (независимо от хронологического возраста): однолетнее увеличение DNAm PhenoAge связано с повышением риска смертности от всех причин на 4,5%.
Генетический анализ DNAm PhenoAge показал, что используемые в нём 513 CpG сайта имеют одинаковые с «часами Хорвата» 41 CpGs и одинаковые 6 CpGs с «часами Ханнума». Пять одинаковых CpG были обнаружены во всех трех эпигенетических методах. 149 CpG из состава DNAm PhenoAge расположены в районах скоплений динуклеотидов CpG (CpG-островках).
Все полученные в ходе исследования Стивом Хорватом и его командой данные показали, что новый биомаркер имеет большую прогностическую ценность при определении рисков возникновения возраст зависимых заболеваний и риска смертности. «Используя инновационный двухэтапный процесс, мы разработали новый эпигенетический биомаркер старения, DNAm PhenoAge, который сильно превзошел предыдущие биомаркеры в отношении прогнозов для различных факторов старения, включая смертность от всех причин, рак, общее состояние здоровья, физическое функционирование и болезнь Альцгеймера. Хотя этот биомаркер был разработан с использованием данных из цельной крови, он сильно коррелирует с возрастом в каждой тестируемой ткани и клетке. Основываясь на углубленном транскрипционном анализе в сортированных клетках, мы обнаружили, что повышенный эпигенетический возраст по отношению к хронологическому возрасту связан с увеличением активации провоспалительных и интерфероновых путей и уменьшением активации транскрипционных / трансляционных механизмов, ответа на повреждение ДНК и митохондриальных сигнатур. В целом, этот единственный эпигенетический биомаркер старения способен охватывать риски для множества разнообразных результатов в разных тканях и клетках и обеспечивать понимание важных путей старения» [20].
- Вайсерман А.М., Войтенко В.П., Мехова Л.В. Эпигенетическая эпидемиология ассоциированных с возрастом заболеваний. Онтогенез. 2011. 42, 1–21;
- Horvath S. DNA methylation age of human tissues and cell types. Genome Biol. 2013. 14, R115.
- Josh Mitteldorf. Methylation Aging Clock: An Update. February 14, 2018.
- Hannum, G; Guinney, J; Zhao, L; Zhang, L; Hughes, G; Sadda, S; Klotzle, B; Bibikova, M; Fan, JB; Gao, Y; Deconde, R; Chen, M; Rajapakse, I; Friend, S; Ideker, T; Zhang, K (2013). Genome-wide methylation profiles reveal quantitative views of human aging rates. Mol Cell. 49: 359–367.
- Morgan E. Levine, H. Dean Hosgood, Brian Chen, Devin Absher, Themistocles Assimes and Steve Horvath. DNA methylation age of blood predicts future onset of lung cancer in the women's health initiative. Aging (Albany NY). 2015 Sep; 7(9): 690–700.
- Riccardo E Marioni, Sonia Shah, et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol. 2015; 16(1): 25.
- Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum, and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort. Clin Epigenetics. 2016; 8: 64.
- Brian H. Chen, Riccardo E. Marioni et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death Aging (Albany NY). 2016 Sep; 8(9): 1844–1859.
- Epigenetic clock predicts life expectancy. ScienceDaily. 28 September 2016.
- Quach A1, Levine ME1 et al. Epigenetic clock analysis of diet, exercise, education, and lifestyle factors. Aging (Albany NY). 2017 Feb 14;9(2):419-446.
- Nevalainen T, Kananen L, Marttila S, Jylhava J, Mononen N, Kahonen M, Raitakari OT, Hervonen A, Jylha M, Lehtimaki T, Hurme M. Obesity accelerates epigenetic aging in middle-aged but not in elderly individuals. Clin Epigenetics. 2017 Feb 14;9:20.
- Marioni RE, Shah S, McRae AF, Ritchie SJ, Muniz-Terrera G, Harris SE, Gibson J, Redmond P, Cox SR, Pattie A, Corley J, Taylor A, Murphy L, et al.. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936. Int J Epidemiol. 2015; 44:1388–96.
- Horvath S, Garagnani P, Bacalini MG, Pirazzini C, Salvioli S, Gentilini D, Di Blasio AM, Giuliani C, Tung S, Vinters HV, Franceschi C. Accelerated epigenetic aging in Down syndrome. Aging Cell. 2015; 14:491–95.
- Horvath S, Levine AJ. HIV-1 Infection Accelerates Age According to the Epigenetic Clock. J Infect Dis. 2015; 212:1563–73.
- Maierhofer A, Flunkert J, Oshima J, Martin GM, Haaf T, Horvath S. Accelerated epigenetic aging in Werner syndrome. Aging (Albany NY). 2017; 9:1143–52.
- Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer’s disease related cognitive functioning. Aging (Albany NY). 2015; 7:1198–211
- Levine ME, Lu AT, Chen BH, Hernandez DG, Singleton AB, Ferrucci L, Bandinelli S, Salfati E, Manson JE, Quach A, Kusters CD, Kuh D, Wong A, et al.. Menopause accelerates biological aging. Proc Natl Acad Sci USA. 2016; 113:9327–32.
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, Mari D, Arosio B, Monti D, Passarino G, De Rango F, D’Aquila P, Giuliani C, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (Albany NY). 2015; 7:1159–70.
- Steve Horvath, Junko Oshima et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging. Volume 10, Issue 7, pp 1758—75.
- 20. Morgan E. Levine, Ake T. Lu, et al. An epigenetic biomarker of aging for lifespan and healthspan. Aging (Albany NY). 2018 Apr; 10(4): 573–591.
Комментарии (14)

shadrap
01.11.2018 17:15Вот меня все ж смущают такого рода заявления:
Положительно влияют на ход эпигенетического времени (замедляют): рыба, птица, овощи и фрукты, липопротеины высокой плотности, умеренный алкоголь, образование и физическая активность. Негативно влияют на ход эпигенетического времени (ускоряют): повышенные уровни инсулина, глюкозы, С-реактивного белка, триглицеридов, повышенное артериальное давление, повышенная масса тела и неправильное соотношение объёмов талии и бёдер.
Наверное все ж не у всех и не все… Есть научные работы, которые показывают, что носителям определенных SNP, средиземноморская диета что называется «по-барабану».
Потом овощи и «овощи» две разные вещи, вместо овоща нашпигованного нитритными солями, может лучше и свининки поесть, а на липопротеины высокой плотности, вообще тяжеловато напрямую повлиять диетой..., не говоря уже о триглицеридах, без которых не возможна жизнь любого живого существа.
А вообще конечно биомаркеры тема интересная. Вот ребята с openSNP пытаются установить взаимосвязь снижения активность ферментов по производству меланина, в волосяном фолликуле, за счет метилирования определенных частей генома и эпигенетическими часами…
Hardcoin
01.11.2018 18:50Наверное все ж не у всех и не все…
Антибиотики тоже не всем помогают. Но вероятность хорошая. Так же и тут. Можно сдать биомаркеры, посидеть год на такой диете, сдать ещё раз. Если на вас не работает, то можно дальше не заморачиваться.


Desavian
кто бы хоть раз объяснил практическую пользу от подобных маркеров старения… очень напоминает фразы «увеличивает шанс ракового заболевания на 300%»… а потом ученого берут за шкирку, приставляют к стене и он добавляет «с 0.00001% до 0.00003%»
з.ы. Джоли уже судиться хочет ибо отрезала все, что можно, а потом узнала что вероятность правильного не то, что шанса рака, а вероятность правильного _ПРОГНОЗА_ меньше 40%
c0f04
Если будут разрабатываться какие-то лекарства от старения, то убедиться в том, что они действительно работают можно будет только с помощью таких биомаркеров. А т. к. старение комплексный процесс, то чем больше маркеров насобирать, тем точнее будет анализ эффективности. Насколько понимаю, это всё на далёкое будущее, по крайней мере у нас. Зато привлекает внимание общественности к вопросу, пока цель, вероятно, в этом.
А более практичным применением на ближайшее будущее могло бы быть определение индивидуального пенсионного возраста, если в правительстве кто-нибудь догадается до этого. Но это сомнительная перспектива, т. к. не очень справедливо будет, что лютые алкоголики будут выходить на пенсию намного раньше всех остальных. И некоторые люди могут просто начать гробить здоровье принудительно, лишь бы раньше пенсия была.
А вот в плане определения рисков и выработки рекомендаций по изменению образа жизни уже сейчас такие маркеры могут пригодиться. Но тут ещё менталитет людей придётся менять.
randall
Всё верно. Человек не мышь. Нельзя взять 200 людей, кормить их геропротекторами и ждать, когда они умрут — это слишком долго. Но можно оценивать их биомаркеры. Если маркеры улучшаются или хотя бы не ухудшаются с возрастом, значит мы на верном пути.
И по некоторым веществам мы уже знаем, что этот путь работает. Например, метформин гарантированно продлевает жизнь людям с инсулинорезистентностью.
Kamenevdn
В статье же прямым текстом говорится, что не нашли влияния метформина на продление жизни.
randall
Биомаркеры эпигенетическими часами не заканчиваются
Batin Автор
Не совсем так. Не нашли влияния метформина на ход эпигенетических часов.
Hardcoin
При таком подходе время жизни на пенсии будет примерно одинаково. Кто-то захочет умереть раньше, зато раньше получить 10 тыс (или сколько там пенсия)?
А менталитет менять не обязательно. Кто не хочет жить — зачем заставлять? Возможность дать нужно, а дальше сами решают.
c0f04
Думаю да. Не видели никогда как в аптеке в очереди за боярышником стоят?
Все эти маркеры — это коммерция. Если не будет спроса, то и направление может не начать развиваться.
Hardcoin
90% населения нельзя убедить словами, только примером. Это не плохо, просто данность. То есть когда 1% будет дольше иметь бодрость и активность (например, до 80) благодаря anti-age, тогда и остальные подтянутся.
А у этого процент спрос и сейчас есть. Готовы платить и платят. Осталось дать им товар, который реально продлит молодость/средний возраст. Биомаркеры тут только показатель, работает ли Х, платить-то будут за сам Х.
Hardcoin
В статье в большинстве мест указана смертность от всех причин, а не только от рака.
Масштаб цифр такой. Вероятность умереть между 30 и 40 годами 1.2%. (для этого примера я взял таблицу смертности по США из Википедии за 2003 год). При увеличении на 9% риск будет 1.3%. Вроде не много. Но риск умереть с 80 до 90 (для тех, кто дожил до 80) — 66%. Увеличение его на 9% — получается 72%. Заметная разница.
Цифры я немного округлял. При этом предположил, что 9% рост риска одинаков в любом возрасте (это наверняка не так, но более точная зависимость в статье не указана).
c0f04
Проценты с точки зрения психологии плохо воспринимаются. Можно то же самое в числах переписать: на 1 миллион человек в возрасте от 30 до 40 лет в среднем умирает 12 000 тысяч человек. При увеличении на 9% — 13 080. Тысяча на миллион. Если вместо условного миллиона указать население Земли этого возраста, число будет уже пугать людей.
Hardcoin
Напугать задачи не стояло :)
А насчёт натуральных долей — уж лучше проценты, их я всегда в голове могу перевести в "66 из ста". А сравнивать 1 из 83 против 2х из 153 (то самое увеличение на 9% между прочим) я в голове совсем не готов.