
Ученые из научно-исследовательского центра нейродегенеративных заболеваний ASU-Banner и центра биоэнергетики Biodesign предполагают, что восстановление поврежденных генов, связанных с функциями митохондрий, помогут остановить наступление болезни Альцгеймера.
25 ноября 1901 года 51-летняя женщина поступила в больницу во Франкфурте, демонстрируя причудливое сочетание симптомов. Ее поведение было непредсказуемо. На лицо все признаки паранойи, а также слуховые галлюцинации, дезориентация в пространстве и серьезные нарушения памяти. В ответ на просьбу написать свое имя, она выводит «миссис», а затем задерживается над страницей, не в силах вспомнить все остальное. «Я потеряла себя» – скажет она своему лечащему врачу. Со временем она замкнется в себе, перед смертью 9 апреля 1906 года.
 Трагический случай Августы Детер возможно, затерялся бы среди других историй болезни, если бы ее врач, Алоис Альцгеймер, не провел тщательное обследование ее состояния здоровья. Кроме этого, он проанализировал ткани мозга пациентки после смерти и обнаружил явные амилоидные бляшки, а также признаки нейрофибриллярных клубков. Августа Детер стала первым человеком с диагнозом болезни Альцгеймера.
Трагический случай Августы Детер возможно, затерялся бы среди других историй болезни, если бы ее врач, Алоис Альцгеймер, не провел тщательное обследование ее состояния здоровья. Кроме этого, он проанализировал ткани мозга пациентки после смерти и обнаружил явные амилоидные бляшки, а также признаки нейрофибриллярных клубков. Августа Детер стала первым человеком с диагнозом болезни Альцгеймера.Сегодня общество столкнулось с эпидемией болезни Альцгеймера: только в США от нее страдают около 5 миллионов человек. По прогнозам аналитиков из Центра по контролю и профилактике заболеваний, это число увеличится до 14 миллионов к середине века. Из списка 10 самых распространенных заболеваний, ведущих к смерти, болезнь Альцгеймера остается единственной, которую нельзя предотвратить, лечить или вылечить.
В своем исследовании Пол Коулман, Диего Мастроени и их коллеги из ASU-Banner и Biodesign изучили роль митохондрий в патологии болезни Альцгеймера. Митохондрии работают как энергетические центры для клеток и имеют решающее значение для здоровья и болезней. Работа ученых опирается на более ранний труд, в котором генные мутации, затрагивающие митохондриальную функцию, являются предполагаемой причиной возникновения и прогрессирования болезни.
Митохондрии – мембранные органоиды, присутствующие во всех живых организмах – часто называют энергетическими станциями клетки. С помощью процесса, известного как окислительное фосфорилирование (OXPHOS), они производят большую часть химической энергии клетки в форме аденозинтрифосфата или АТФ. Помимо поставки энергии для клетки, митохондрии участвуют в клеточной дифференциации и гибели клеток, а также в их росте и поддержании клеточного цикла.
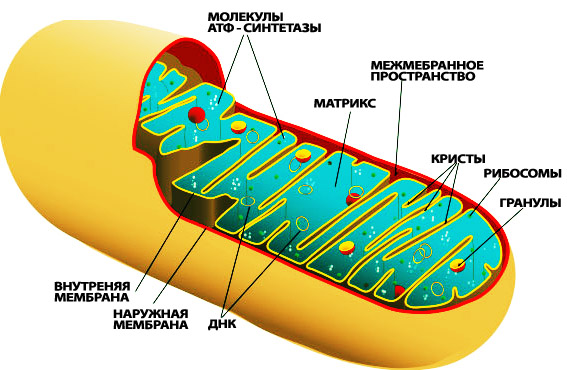
Строение митохондрии
Митохондрии отличаются от других органоидов клетки тем, что имеют собственную ДНК. Она отличается от той, что содержится в ядре клетки. Это стало возможно благодаря митохондриальной эволюции. Эти органоиды произошли от свободно живущих бактерий, которые «колонизировали» около 2 миллиардов лет назад другие клетки. Будучи включенными в клетки, содержащие ядро, эти эндосимбионты (организмы, живущие внутри другого организма и приносящие ему пользу) потеряли большую часть природного строения, но сохранили собственную ДНК.
Поскольку митохондрии играют важную роль, митохондриальная дисфункция связана с возникновением широкого спектра заболеваний, включая сердечно-сосудистые, аутизм, шизофрению, биполярное расстройство, эпилепсию, инсульт, диабет и различные формы деменции, вроде болезни Альцгеймера.
Возрастные нейродегенеративные заболевания вроде болезни Альцгеймера развиваются в течение длительного времени, прежде чем они явно проявят себя. Самые ранние физиологические и молекулярные процессы до сих пор остаются неизвестными. Результаты работы лаборатории Коулмана и Мастроени раскрыли ранние изменения в кодировке ядра (а не митохондриальных мРНК), которые наступают у людей после 30 лет. «Это дает нам возможность заглянуть туда, где, мы подозреваем, происходят самые ранние клеточные изменения в прогрессировании болезни Альцгеймера» – говорит Мастроени.
В этом исследовании были изучены ткани из гиппокампа – части головного мозга, которая играет решающую роль для человеческой памяти. Именно она в первую очередь серьезно страдает при наступлении заболевания. С помощью микроматричного анализа, исследователи изучили ткани гиппокампа 44 здоровых людей в возрасте от 29 до 99 лет, 10 с умеренными нарушениями и 18 с болезнью Альцгеймера.
Реакцию оценивали из двух наборов генов: первый кодируется в митохондриальной ДНК, а другой в ядерной ДНК. Два этих набора связались с митохондриальной сложной основой для окислительного фосфорилирования, производя энергию в виде АТФ. Интересно, что в то время, как сами митохондриальные гены почти не были затронуты, ядерные гены, связанные с механизмом OXPHOS, подвергались значительной модификации, в зависимости от исследуемых тканей. Данные микроматричного анализа показали существенное снижение регуляции ядерно закодированных генов OXPHOS в тканях, пораженных болезнью. Такая же реакция происходит в нормально стареющем мозге.
Результаты нового исследования показывают, что определенные классы генов, связанные с проявлениями митохондрий во время окислительного фосфорилирования, менее выражены у пациентов с болезнью Альцгеймера по сравнению со здоровыми людьми.
Исследование также рассматривает проявление генов у пациентов, чей мозг демонстрирует средний уровень заболевания, известный как умеренно-когнитивное нарушение. Здесь наблюдается противоположный эффект с соответствующими генами – реакция выражается ярче. Авторы полагают, что это наблюдение может указывать на некоторый компенсационный механизм в мозге, который пытается предотвратить болезнь на самых ранних стадиях. Кроме того, они считают, что восстановление определенного набора поврежденных генов, связанных с митохондриальной функцией и расположенных в ядре клеток ДНК, является возможным вариантом остановки болезни.
Полученные результаты согласуются с данными предыдущей работы, устанавливающей, что накопление бета-амилоидов в нейронах (отличительная черта болезни Альцгеймера), непосредственно вовлечены в митохондриальную дисфункцию. «Наша работа над митохондриями предлагает надежный маркер, появляющийся в самом начале заболевания. Он более тесно коррелирует со степенью деменции, чем текущая диагностика бляшек и клубков» – отмечает Коулман.
Точные механизмы, влияющие на снижение реакции митохондрий во время старения или болезни Альцгеймера еще предстоит выяснить. Исследование показывает, что методы лечения, направленные на восстановление функции генов, может открыть новый путь для лечения болезни.
Научная работа опубликована в журнале Alzheimer's & Dementia
DOI: 10.1016/j.jalz.2016.09.003
Поделиться с друзьями


Idot
Кто знает почему? У нас (в бывшем СССР), диагноз Альцгеймер — большая редкость и практически не встречается, но зато диагноз Сосудистая Деменция, вроде, при похожих симптомах, как у Альцгеймера — обычное дело. А вот на Западе — наоборот, обычным диагнозом является Альцгеймер, а диагноз Сосудистая Деменция — практически не встречается.
Dr_Krasov
К сожалению, пришлось в жизни столкнуться с этим. Тоже очень удивило.
Вообще по статистике Сосудистая Деменция существенно отстаёт (на порядок) по частоте от Альцгеймера и от Деменции с Тельцами Леви.
Болезнь Альцгеймера — всего лишь одна из возможных причин Деменции. Сосудистая Деменция,- тоже один из вариантов Деменции, когда причиной становится плохое состояние сосудов мозга. Сосудистая более распространена и часто Альцгеймера идёт одновременно с Сосудистой и опредлеить чей вклад в Деменцию весомее часто невозможно.
Т.е. у Деменции может быть много причин и Альцгеймер лишь одна из них.
Отечественные психиатры и невропатологи, как я заметил, часто не вдаются в детали, при мне лично весьма уважаемые узкие специалисты называли явную Сосудистую Деменцию с Тельцами Леви как просто «Альцгеймер», хотя на Альцгеймера явных указаний вообще не было.
Полагаю, что проблемы в данном случае три: