Митохондрии - это эукариотические органеллы, которые когда-то давно были бактериями. Конечно кто-то может возразить, что это всего лишь гипотеза, однако эта гипотеза уже давно переросла в эндосимбиотическую теорию и является общепринятой в кругах учёных.
Так уже давно считается, что митохондрии произошли когда-то от альфа-протеобактерий, вероятно, два миллиарда лет назад.
Однако остается неясным, что составляло начальный эндосимбиоз между альфа-протеобактерией и ее хозяином. В частности, какую роль сыграл митохондриальный предок, инициировавший эндосимбиоз? В связи с этим вопросом возникают и другие. Например;
В каких условиях возникли митохондрии?
Могли ли это быть микротоксические условия, или митохондрии возникли сугубо в кислородных условиях, а может всё-таки эти органеллы появились в аноксических условиях?
Возникли ли они одновременно с появлением ядра или после него?
Что было движущей силой первоначального симбиоза?
Для объяснения всех обстоятельств и ответов на все вопросы, связанные с основными эндосимбиотическими событиями, выдвигались разные гипотезы зачастую противоречащие друг другу. Так, например, «Водородная гипотеза» предполагала метаболическую синтрофию между водорода-продуцирующими альфа-протеобактериями и водорода-зависимыми археонами, как движущую силу эндосимбиоза.

Эта гипотеза допускала возможность одновременного возникновения митохондрии и ядра, при этом одна и та же альфа-протеобактерия якобы также могла вносить свой вклад в рост ядра путем слияния своего генома с геномом хозяина. Следовательно, «водородная гипотеза» напрямую бросала вызов гипотезе «последовательного эндосимбиоза», в которой хозяин считался изначально полноценным организмом свободно дышащим кислородом и содержавшим ядро
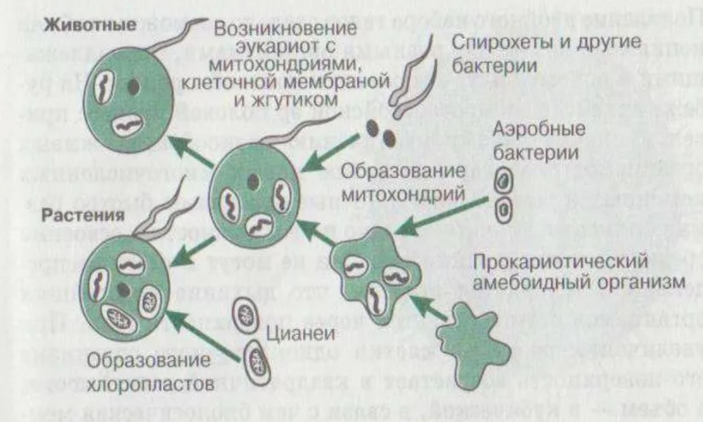
эукариот, что в свою очередь противоречило, гипотезе «поглотителя кислорода», которая предполагала, что именно удаление токсичного кислорода альфа-протеобактериями из анаэробного хозяина привело к начальному симбиозу. Все эти гипотезы объясняют причины, того как произошли основополагающие события, но в тоже время и противоречили друг другу также, как противоречит концовке приквела любое начало сиквела «Зловещих Мертвецов».
В связи с этим в последнее время стала набирать ещё одна гипотеза возникновения митохондрий, которая рассказывает нам о паразитических предках митохондриях. Эта гипотеза на данный момент кажется является более достоверной, так как подкрепляется большим количеством данных. Так в 2020 году вышло огромное филогенетическое исследование показывающее близкое родство митохондрий с паразитическими бактериями. [1]
Но не менее интересное исследование, с которого всё и началось произошло в 2014 году [2].
Хотя мне следует чуть чуть поправить себя, так как предположения о митохондриях-паразитах высказывались не однократно и ранее, но именно это исследование можно назвать самым крутым и начальной «точкой отсчёта» к последующим событиям в научной среде. Поэтому сегодня именно его я и буду рассматривать.
А всё началось как раз с реконструкции митохондриального предка, который имеет большое влияние на наше понимание происхождения митохондрий. Так все выше описанные мной гипотезы объяснялись исследованиями, которые в основном были сосредоточены на реконструкции последнего общего предка всех современных митохондрий, так называемых прото-митохондрий, но не основывались на более информативных премитохондриях, которые по сути были ещё древнее прото-митохондрии, так как они включали последнего общего предка как митохондрий, так и их сестринской клады альфа-протеобактерий.

Сама по себе группа альфа-протеобактерий уже сама является очень интересной группой живых организмов, поскольку в неё включаются различные симбионты эукариот в том числе симбионты, которые являются патогенными, или условно-патогенными микроорганизмами. Например, в этой группе есть и облигатные внутриклеточные паразиты, которых можно назвать «царями симбиоза», правда от которых, как и от царей обычно не ждёшь ничего хорошего.
Самые известные из них это вольбахии и риккетсиалы (отряд в который входят риккетсии). Последние нас интересуют больше всего, так как именно они успели поучаствовать в реконструкции предка митохондрий, а точнее их метаболизма в 2014-м году.
Так чтобы получить представление об обстоятельствах, которые окружали начальное событие эндосимбиоза, учёные старательно реконструировали метаболизм прото-митохондрий и премитохондрий. Для этого они сначала восстанавливали прото-митохондриальные гены, которые в процессе эволюции были потеряны для ядра. Учёные назвали эти гены ядерными генами митохондрий. Восстановление этих генов являлось предпосылкой для реконструкции митохондриальных предков. Предыдущие попытки найти прото-митохондриальные гены были безуспешны так как основывались на довольно ограниченной доступности бактериальных и эукариотических геномов на момент их изучения [3;4].
Используя значительно увеличившееся представление геномов эукариот и альфа-протеобактерий, исследователи провели филогеномный анализ для систематической идентификации ядерных генов, происходящих из митохондрий. Гены эукариот с наибольшим попаданием в BLAST митохондрий / альфа-протеобактерий сначала были объединены в группы генов. Филогенетическое дерево было реконструировано для каждого семейства, и ядерные гены, которые сгруппировались с альфа-протеобактериями на деревьях, были идентифицированы как происходящие из митохондрий.
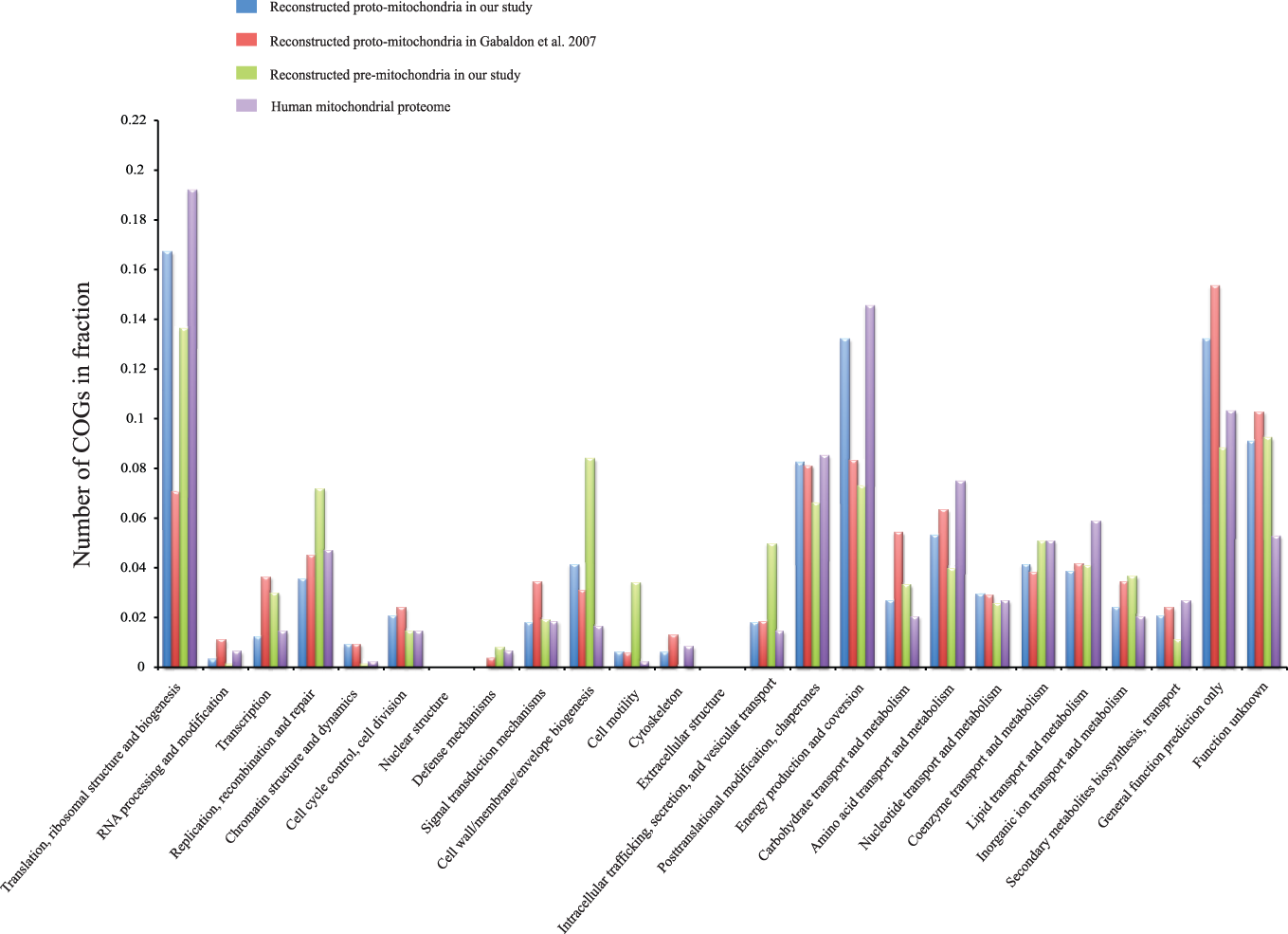
Начав с 427186 генов из 30 эукариотических геномов, представляющих широкий диапазон филогенетического разнообразия, они идентифицировали 4459 генов, принадлежащих к 394 семействам, как ядерные гены митохондрий. Чтобы исключить недавний перенос генов, специфичных для клонов, между альфа-протеобактериями и эукариотами, генные семейства должны были присутствовать по крайней мере в двух альфа-протеобактериальных и двух эукариотических линиях. Собственно, так и произошло. Таким образом учёные смогли идентифицировать, что ядерные гены из 394 семейств присутствуют в прото-митохондриях.

Далее учёные смогли реконструировать прото-митохондрию, а затем и метаболизм прото-митохондрий, восстановив все его пути, включая метаболизм пирувата, цикл TCA, транспорт электронов и рибосомный биогенез, а также биосинтез жирных кислот, бета-окисление, разрушение аминокислот с разветвленной цепью (лейцин, валин, изолейцин) и биосинтез убихинона, биотина и пула одной углеродной единицы.
Всё это есть и в современных митохондриях. Однако учёные обнаружили и то, чего в прото-митохондриях не было. Так в них отсутствовали функциональные категории, такие как репликация ДНК и транскрипция, также в значительной степени отсутствовали в реконструированном метаболизме и гетеротрофные углеводные обмены, такие как гликолиз и пентозофосфатный путь. Таким образом реконструкция прото-митохондрии показала упрощённого предка митохондрии более похожего на современную митохондрию, что опровергло предыдущие гипотезы о ближайших предках митохондрий, которые имели огромное множество разнообразных функций.
При дальнейшем изучении уже самих митохондрий учёные по-новому взглянули на метаболизм эукариот, происходящий главным образом благодаря этим органеллам. Особый интерес представлял ряд генов, участвующих в метаболизме липидов эукариот. Были идентифицированы несколько генов, участвующих в биосинтезе нуклеотидов de novo, как происходящих из митохондрий. Обнаружены были и ферменты, участвующие в биосинтезе стероидов предполагающие, что митохондриальный предок внес свой вклад в биосинтез оных. Вишенкой на торте можно назвать идентификацию церамидгликозилтрансферазы (COG1215).
Сам по себе данный фермент есть во всех митохондриях и, казалось бы, тут нет ничего удивительного. Ну есть фермент такой участвующий в биосинтезе гликосфинголипидов, ну осуществляет он реакции гликозилирования церамидов и дальше-то что? Какой в этом интерес?
А интересно то, что этот фермент расположенный на «ассоциированной с митохондриями мембране», специфическом субдомене ER, который связывает этот самый ER и митохондрии, обнаружился и в риккетсиях. Для понимания замечу, что все эти самые гликосфинголипидные, и церамидные структуры, повсеместно присутствуют в качестве важных мембранных компонентов почти во всех эукариотических клетках и митохондриях, а это в свою очередь говорит нам о том, что присутствие этих структур в бактериях являются крайне редкими. При этом, что интересно, ген отвечающий за все эти субстраты и гликолипидные продукты, присутствующий в бактериальных клетках всё же различается от эукариотических гликозилтрансфераз. Следовательно, данный факт указывает на бактериальное происхождение этого гена, который был приобретён эукариотами для новой функции по синтезу собственных эндомембран, а также по перекрестному взаимодействию и перемещению липидов между митохондриями и субодменом ER. Интересные результаты не так ли?
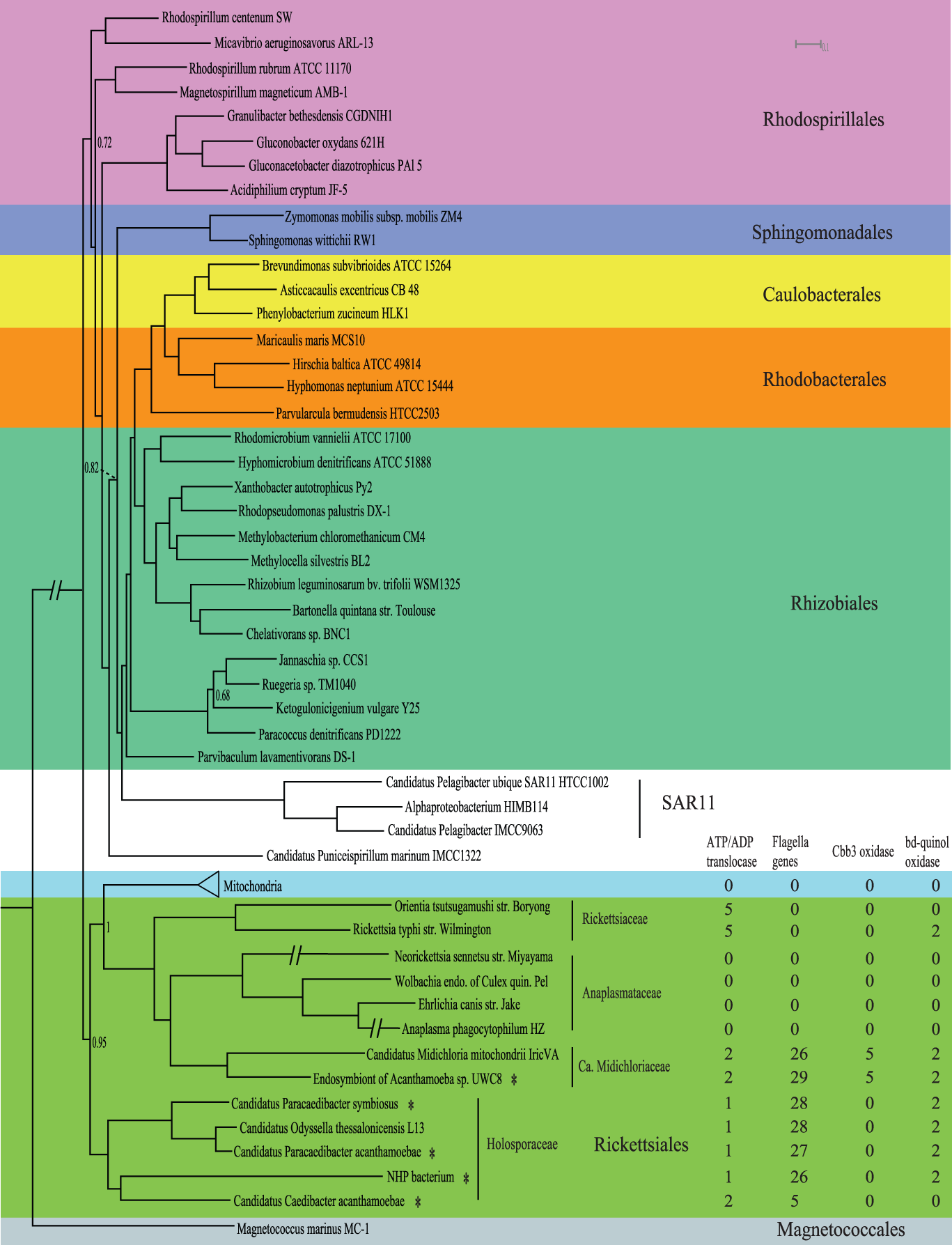
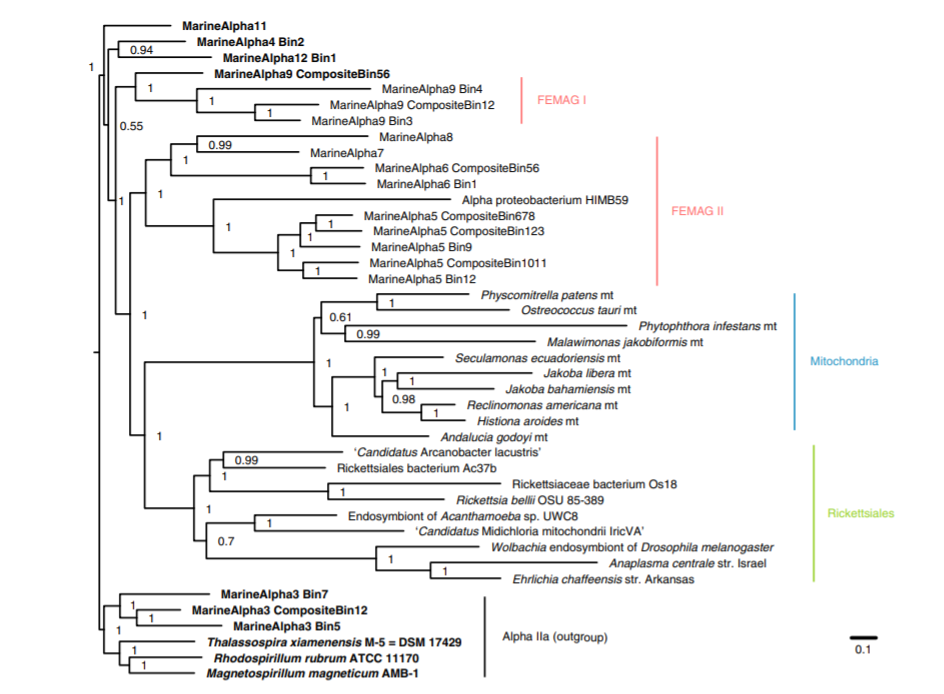
А дальше ещё интереснее, ведь чтобы увеличить достоверность реконструкции учёные направили все усилия на реконструкцию наследственных черт премитохондрий. Так они секвенировали 5 новых линий риккетсиалов имеющие схожести с митохондриями. Помимо риккетсий учёные секвенировали 44 представителя других альфа-протеобактерий схожих с митохондриями, а в качестве внешней группы были использованы 6 представителей эукариот для реконструкции байесовского дерева на основе конкатенированного выравнивания белковых последовательностей кодируемых 55 митохондриальными и ядерными маркерными генами.
В результате получилось, что митохондрии поместились в отряд к риккетсиалам в качестве сестринской клады по отношению к семействам Rickettsiaceae, Anaplasmataceae и Candidatus Midichloriaceae, которую в свою очередь были подчинены семейству Holosporaceae.
Стоит отметить, что представители этих семейств являются паразитами. Так, учёные в этой работе показали, что все пять линий секвенированных риккетсиалов тесно связаны с митохондриями. Далее основываясь на приблизительной линейной зависимости между числом семейств генов, средним числом генов и размером генома учёные заметили, что геном премитохондрий сокращался. Это типично для облигатной внутриклеточной бактерии и предполагает, что сокращение генома шло полным ходом до того, как митохондрии отделились от альфа-протеобактерий, т. е. стали настоящими митохондриями.
Продолжив генетические исследования, учёные стали сравнивать реконструированные прото-митохондрии и премитохондрии. Оказалось, что в отличии узкоспециализированных прото-митохондрий, премитохондрии были способны к гораздо более разнообразному метаболизму. Помимо основных путей, премитохондрии участвовали в трансляции, в клеточной стенке, LPS и биогенезе мембран, в производстве энергии, репликации, рекомбинации и репарации ДНК, они обладали множеством ключевых метаболических путей, включая гликолиз, цикл TCA, пентозофосфатный путь и путь биосинтеза жирных кислот. Кроме того, премитохондрии обладали большим количеством генов, участвующих в синтезе различных кофакторов, таких как рибофлавин, фолат, биотин и убихинон.

С другой стороны, как и большинство Риккетсиалесов, премитохондрии обладали ограниченным количеством генов для синтеза определенных аминокислот (глутамин, лейцин, валин и изолейцин) из промежуточных продуктов метаболизма, но были недостаточны в биосинтезе аминокислот de novo (с нуля). Следовательно, премитохондрии должны были получать незаменимые аминокислоты от хозяина.
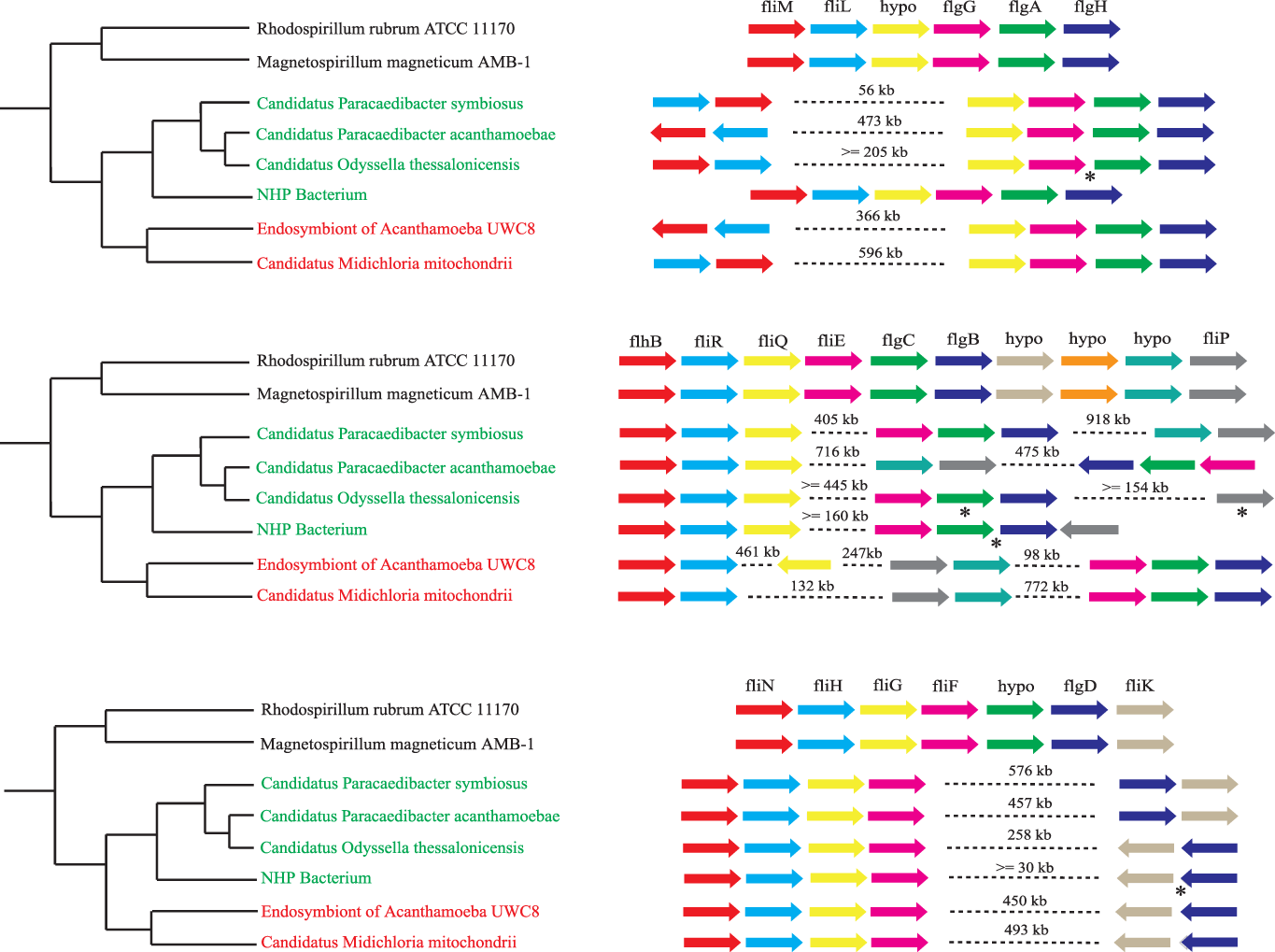
Дальнейшие исследования премитохондрий показали, что они кодируют пластидно-паразитарный тип транслоказы АТФ / АДФ, которая импортирует АТФ от хозяина, что делает премитохондрию энергетическим паразитом. Последующие сравнения генов риккетсиалов с премитохондриями, а также построения филогенетических деревьев показало, что премитохондрии вероятно обладали способностью дышать в условиях низкого содержания кислорода и имели жгутики, которые наследовались вертикально, а не через горизонтальный перенос. Электронная микроскопия части эндосимбиотических бактерий также показала наличие рудиментарных жгутиков. Т.е. данное исследование показывает нам предка митохондрии, который мог жить в условиях с низким содержанием кислорода, обладающим жгутиком и являющимся паразитом, что, казалось бы, прямо контрастирует с нынешней ролью митохондрий как производителя энергии клетки.
Однако, систематический обзор от 2011 года бактериального симбиоза показал, что мутуализмы вполне себе могут происходить либо непосредственно от свободноживущих бактерий в окружающей среде, либо от внутриклеточных паразитов [5] . Ключевое различие между этими двумя эволюционными путями состоит в том, что для инициации симбиоза свободноживущие бактерии должны приносить немедленную пользу хозяину, в то время как внутриклеточные паразитические бактерии этого не делают.

Результаты исследования от 2014 года говорят, что в начале эндосимбиоза бактериальный симбионт не приносил никакой пользы хозяину. Поэтому данная гипотеза утверждает, что преимущества, предлагаемые другими различными гипотезами (например, гипотезой поглотителя кислорода и гипотезой водорода), не имеют отношения к объяснению установления начального симбиоза. При этом она и не опровергает все эти гипотезы.
В место опровержения прошлых предположений данная гипотеза предлагает применять их для объяснения перехода митохондрий от паразита к мутуалистической органелле на более поздней стадии. Это всё очень интересно, а потому есть большая вероятность, что гипотеза о предках митохондриях как паразитах возможно скоро станет научной теорией . Поэтому если, кто-то назовёт Вас паразитом, не обижайтесь, ведь можно парировать, что паразитизм у нас в крови, а точнее в клетках. Такие дела!

Примечание:
Оригинальная версия статьи в научно-популярном стиле была написана и опубликована мной в нашем научно-просветильском сообществе Фанерозой.
Источники
1. «Phylogenetic analyses with systematic taxon sampling show that mitochondria branch within Alphaproteobacteria» Lu Fan, Dingfeng Wu, Vadim Goremykin, Jing Xiao, Yanbing Xu, Sriram Garg, Chuanlun Zhang, William F. Martin and Ruixin Zhu; Nature Ecology & Evolution, 2020
2. Phylogenomic Reconstruction Indicates Mitochondrial Ancestor Was an Energy Parasite Zhang Wang, Martin Wu Published: October 15, 2014Gabaldon T, Huynen MA (2003) Reconstruction of the proto-mitochondrial metabolism. Science 301: 609.
3. Gabaldon T, Huynen MA (2007) From endosymbiont to host-controlled organelle: the hijacking of mitochondrial protein synthesis and metabolism. PLoS Comput Biol 3: e219.
4. Gabaldon T, Huynen MA (2007) From endosymbiont to host-controlled organelle: the hijacking of mitochondrial protein synthesis and metabolism. PLoS Comput Biol 3: e219.
5. Sachs JL, Skophammer RG, Regus JU (2011) Evolutionary transitions in bacterial symbiosis. Proc Natl Acad Sci U S A 108 Suppl 210800–10807.


AcckiyGerman
Неисповедимы пути эволюции.
Hidralisk
или сотворения
sim2q
Эх, читал где-то, что даже если бы с сине-зелёными у нас в клетках кожи и прокатило, то не наелись бы даже бегая под солнышком голышом. Или уже есть поправки?:)
arheops
Нет, конечно. Человек требует слишком много энергии.
Даже лучшие из растений столько не вырабатывают на такой малой площади.
Площадь кожи 1,5—2,3м2.
Эффективность фотосинтеза — 3-6%. Тоесть 2.3*0.06*1000=138Вт. Человек тратит около 2КВт*ч в день в покое. Никак не складывается. Даже без учета неэфиктивности водорослей в теле человека и если всю кожу растянуть под 90 градусов на солнце.
lucius
Ваш комментарий огорчает праноедов!
arheops
Вряд ли. Дело в том, что мозг потребляет до половины этой энергии и когда праноеды перестают кушать — мозг, как правило, перестает работать. Потому они не огорчаются.
К тому же праноеды декларируют потребление чакрами и душой(кто как), а какой радиус захвата у этих концепций — неизвестно. Можно говорить, к примеру, о квадратном километре.