
Если поместить кусочек натрия в воду, можно вызвать бурную, часто взрывную реакцию
Иногда мы узнаём что-то в начале жизни и просто принимаем, как данность, что мир работает именно так. К примеру, если бросить кусочек чистого натрия в воду, можно получить легендарную взрывную реакцию. Как только кусочек намокнет, реакция заставляет его шипеть и разогреваться, он прыгает по поверхности воды и даже выдаёт язычки пламени. Это, конечно, просто химия. Но не происходит ли чего-то ещё на фундаментальном уровне? Именно это и хочет узнать наш читатель Семён Стопкин из России:
Какие силы управляют химическими реакциями, и что происходит на квантовом уровне? В частности, что происходит, когда вода взаимодействует с натрием?
Реакция натрия с водой — это классика, и у неё есть глубокое объяснение. Начнём с изучения прохождения реакции.
Первое, что нужно знать о натрии — на атомном уровне у него всего на один протон и один электрон больше, чем у инертного, или благородного газа, неона. Инертные газы не реагируют ни с чем, и всё из-за того, что все их атомные орбитали полностью заполнены электронами. Эта сверхстабильная конфигурация рушится, когда вы переходите на один элемент далее в периодической таблице Менделеева, и это происходит со всеми элементами, демонстрирующими похожее поведение. Гелий сверхстабилен, а литий чрезвычайно активен химически. Неон стабилен, а натрий активен. Аргон, криптон и ксенон — стабильны, но калий, рубидий и цезий — активны.
Причина заключается в дополнительном электроне.

Таблица Менделеева рассортирована по периодам и группам согласно количеству свободных и занятых валентных электронов — а это первейший фактор в определении химических свойств элемента
Когда мы изучаем атомы, мы привыкаем считать ядро твёрдым, мелким, положительно заряженным центром, а электроны — отрицательно заряженными точками на орбите вокруг него. Но в квантовой физике этим дело не заканчивается. Электроны могут вести себя, как точки, в особенности если выстрелить в них другой высокоэнергетической частицей или фотоном, но если их оставить в покое, они расплываются и ведут себя, как волны. Эти волны способны самонастраиваться определённым образом: сферически (для s-орбиталей, содержащих по 2 электрона), перпендикулярно (для p-орбиталей, содержащих по 6 электронов), и далее, до d-орбиталей (по 10 электронов), f-орбиталей (по 14) и т.д.
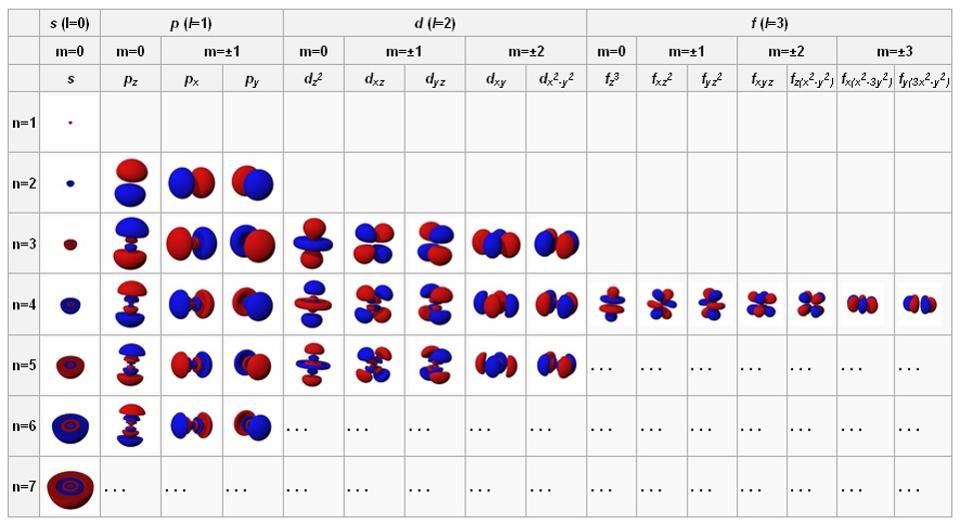
Орбитали атомов в состоянии с наименьшей энергией находятся вверху слева, и при продвижении вправо и вниз энергии растут. Эти фундаментальные конфигурации управляют поведением атомов и внутриатомными взаимодействиями.
Заполняются эти оболочки из-за принципа запрета Паули, запрещающего двум одинаковым фермионам (например, электронам) занимать одно и то же квантовое состояние. Если в атоме электронная орбиталь заполнилась, то единственное место, где можно разместить электрон — это следующая, более высокая орбиталь. Атом хлора с удовольствием примет дополнительный электрон, поскольку ему не хватает всего одного для заполнения электронной оболочки. И наоборот, атом натрия с удовольствием отдаст свой последний электрон, поскольку он у него лишний, а все остальные заполнили оболочки. Поэтому натрий хлор так хорошо и получается: натрий отдаёт электрон хлору, и оба атома находятся в энергетически предпочтительной конфигурации.

Элементы первой группы периодической таблицы, особенно литий, натрий, калий, рубидий и т.д. теряют свой первый электрон гораздо легче всех остальных
На самом деле количество энергии, необходимое для того, чтобы атом отдал свой внешний электрон, или энергия ионизации, оказывается особенно низкой у металлов с одним валентным электроном. Из чисел видно, что гораздо легче забрать электрон у лития, натрия, калия, рубидия, цезия и т.п., чем у любого другого элемента

Кадр из анимации, демонстрирующей динамическое взаимодействие молекул воды. Отдельные молекулы H2O имеют V-образную форму и состоят из двух атомов водорода (белые), соединённых с атомом кислорода (красные). Соседние молекулы H2O кратковременно реагируют друг с другом через водородные связи (бело-голубые овалы)
Так что же происходит в присутствии воды? Вы можете представлять себе молекулы воды как крайне стабильные — H2O, два водорода, связанные с одним кислородом. Но молекула воды чрезвычайно полярная — то есть, с одной стороны молекулы H2O (со стороны, противоположной двум водородам) заряд получается отрицательным, а с противоположной — положительным. Этого эффекта достаточно для того, чтобы некоторые молекулы воды — порядка одной на несколько миллионов — распадались на два иона — один протон (H+) и ион гидроксила (OH-).

В присутствии большого количества чрезвычайно полярных молекул воды одна из нескольких миллионов молекул распадётся на ионы гидроксила и свободные протоны — этот процесс называется автопротолиз
Последствия этого довольно важны для таких вещей, как кислоты и основания, для процессов растворения солей и активизации химических реакций, и т.п. Но нас интересует, что происходит при добавлении натрия. Натрий — этот нейтральный атом с одним плохо держащимся внешним электроном — попадает в воду. А это не просто нейтральные молекулы H2O, это ионы гидроксила и отдельные протоны. Важны нам прежде всего протоны — они и подводят нас к ключевому вопросу:
Что энергетически предпочтительнее? Иметь нейтральный атом натрия Na вместе с отдельным протоном H+, или ион натрия, потерявший электрон Na+ вместе с нейтральным атомом водорода H?
Ответ прост: в любом случае электрон перепрыгнет с атома натрия на первый же встречный отдельный протон, который попадётся ему на пути.

Потеряв электрон, ион натрия с удовольствием растворится в воде, как делает ион хлора, приобретя электрон. Гораздо более выгодно энергетически — в случае натрия — чтобы электрон спарился с ионом водорода
Именно поэтому реакция происходит так быстро и с таким выходом энергии. Но это ещё не всё. У нас получились нейтральные атомы водорода, и, в отличие от натрия, они не выстраиваются в блок отдельных атомов, связанных вместе. Водород — это газ, и он переходит в ещё более энергетически предпочтительное состояние: формирует нейтральную молекулу водорода H2. И в результате образуется много свободной энергии, уходящей в разогрев окружающих молекул, нейтральный водород в виде газа, который выходит из жидкого раствора в атмосферу, содержащую нейтральный кислород O2.

Удалённая камера снимает вблизи главный двигатель Шатла во время тестового прогона в космическом центре имени Джона Стенниса. Водород — предпочтительное топливо для ракет благодаря его низкому молекулярному весу и избытку кислорода в атмосфере, с которым он может реагировать
Если накопить достаточное количество энергии, водород и кислород тоже вступят в реакцию! Это яростное горение выдаёт водяной пар и огромное количество энергии. Поэтому при попадании кусочка натрия (или любого элемента их первой группы периодической таблицы) в воду случается взрывной выход энергии. Всё это происходит из-за переноса электронов, управляемого квантовыми законами Вселенной, и электромагнитных свойств заряженных частиц, составляющих атомы и ионы.

Энергетические уровни и волновые функции электронов, соответствующие различным состояниям атома водорода — хотя почти такие же конфигурации присущи всем атомам. Уровни энергии квантуются кратно постоянной Планка, но даже минимальная энергия, основное состояние, имеет две возможные конфигурации в зависимости от соотношения спинов электрона и протона
Итак, повторим, что происходит, когда кусочек натрия падает в воду:
- натрий немедля отдаёт внешний электрон в воду,
- где он поглощается ионом водорода и формирует нейтральный водород,
- эта реакция высвобождает большое количество энергии, и разогревает окружающие молекулы,
- нейтральный водород превращается в молекулярный водородный газ и поднимается из жидкости,
- и, наконец, при достаточном количестве энергии атмосферный кислород вступает с водородным газом в реакцию горения.

Металлический натрий
Всё это можно просто и элегантно объяснить при помощи правил химии, и именно так это часто и делают. Однако правила, управляющие поведением всех химических реакций, происходит из ещё более фундаментальных законов: законов квантовой физики (таких, как принцип запрета Паули, управляющий поведением электронов в атомах) и электромагнетизм (управляющий взаимодействием заряженных частиц). Без этих законов и сил не будет никакой химии! И благодаря им каждый раз, уронив натрий в воду, вы знаете, чего следует ожидать. Если вы ещё не поняли — нужно надевать защиту, не брать натрий руками и отходить подальше, когда начинается реакция!
Итан Сигель – астрофизик, популяризатор науки, автор блога Starts With A Bang! Написал книги «За пределами галактики» [Beyond The Galaxy], и «Трекнология: наука Звёздного пути» [Treknology].
ЧаВо: если Вселенная расширяется, почему не расширяемся мы; почему возраст Вселенной не совпадает с радиусом наблюдаемой её части .
Комментарии (54)
qbertych
12.02.2018 17:24+5Прекрасный иллюстрация того, чем
птица говорут отличается от депутатаИтан Сигель отличается от нормальных популяризаторов.
Нормальные популяризаторы — это те, кому интересен мир вокруг них. Они могут увидеть в нем что-то красивое и донести эту красоту до читателей. Причем этот интерес у них не пропадает за границами своей области — поэтому, например,
— Мэтт Стресслер (который из физики высоких энергий) может на пальцах изложить предельный переход от классической механики к квантовой,
— его коллега Игорь Иванов способен вообще из чего угодно сделать интереснейшую историю,
— Артем Коржиманов flerant (взаимодействие излучения с веществом) прекрасно рассказывает про астрономию,
— Валентин tnenergy (термоядерщик) умудряется выкопать интереснейшие детали то про LIGO, то про Falcon Heavy,
— Женя Смирнов Tiberius (химик) просто не ленится радоваться всему прекрасному, что творится вокруг.
И есть Сигель, которому вся эта ваша наука за пределами теории струн по барабану, но попиариться хочется. Поэтому он либо пишет свой стандартный речекряк про «Видите ли, 14 миллиардов лет назад ...», либо дико фейлит во всем остальном — от правил вручения Нобелевской премии до несчастного натрия.
justhabrauser
12.02.2018 20:59-1«Видите ли, 14 миллиардов лет назад» — 13.8, по Итану.
Кстати, давно не было этой цифры.
Вообще, конечно, удивительно — как этим «Редакторам GT» (tm) не лень переводить этот детский лепет на лужайке?
За это платят, что ли?
Если достойно платят — то я тоже будувсякий бреднести информацию в массы.
Из Детской Энциклопедии.

VT100
14.02.2018 22:56Пожалуй — да.
Можно было, например, отметить, что в водном растворе чего-либо диссоциирующего с образованием Н+ — протонов нет (или таки есть?). А есть только гидроксоний Н3О+. Отсюда — можно перекинуться на развенчание LENR'ов. И т.д.

Neuromantix
12.02.2018 18:49+1Сколько я не кидал натрий в воду — с таким бабахом, как на первой картинке, он никогда не реагировал. Даже калий — и тот слабее. Может. разве что если натрий измельчить, а водород поджечь.

ru1z
12.02.2018 19:57Предположу, что поверхность натрия была плохо очищена, натрий глубоко погрузился, собрался водород и уже потом рвануло. Или может в бумагу оборачивали.
Вот как взрывается в частичной металлической оболочке:
BalinTomsk
12.02.2018 20:16И калий и литий и натрий просто бегают по воде с дикой скоростью и бурлят. никаких взрывов и огня.
Школьный класс на уроке химии.
А вот марганцовка с глицерином и немного воды — дает весьма бурную термоогненную реакцию.
noanswer
12.02.2018 20:47И калий и литий и натрий просто бегают по воде с дикой скоростью и бурлят. никаких взрывов и огня. Школьный класс на уроке химии.
литий с водой реагирует спокойно без фейрверков, а вот натрий и калий очень качетсвенно разбрасывают горящие куски… приблизительно как на видео в статейке, условно разумно обьяснение привел ниже

noanswer
12.02.2018 20:40и при этом совершенно непонятно почему происходит именно взрыв. О да! я в детстве накидался щелочных металлов в воду и не только в воду.
Если бы все было просто натирй плавился бы и парил на полушке из водяного пара и горящего водорода все!. Но он почему-то взрывается.
При таком горении: сперва образуется гидрид натрия, который частично растворяется (?) в натрии а при достижении какой-то температуры (>300C) опять начинает разлагаться на натрий и водород, натрий разбрызгивается и горение из поверхностного становится объемным, происходит взрыв.
Меня, юного химика, этот вопрос в свое время очень занимал и это единственное объяснение которое хоть что-то объясняет… и да в принципе сюда можно ещё приплести перекись натрия которая образуется пои его горении в атмосфере… но проблема в том что натрий окутан водородом и горит именно водород… натрий сам по себе доволно плохо и "вяло" горит на воздухе.

arheops
12.02.2018 20:47Там же еще H+H — сильно выделяющая и если произошла в присутсвии кислорода то H+H+O2 — еще больше.

noanswer
12.02.2018 20:52+1Взрыв, в данном случае, — объемное горение.
NaH разлагается при 300С в вакууме так что никакого взрывного разложение с выделением водорода не будет, будет "легкое закипание" раствора водорода в натрии что переводит реакцию из поверхностной в объем.
ru1z
12.02.2018 22:06Случайно поставил плюс. У вас какое-то притянутое объяснение, честно. Есть же более традиционные давно уже опубликованные объяснения. К чему такие сложности с образованием гидрида, растворением и разложением? Это чрезвычайно сложная цепочка для доказательства «только на словах».

ftvkun
13.02.2018 03:03Щелочные металлы очень легко и очень быстро отдают свои валентные электроны, превращаясь в катионы. И если при этом образовавшиеся катионы не успевают уходить с поверхности металла(или же образуются по всему обьему металла из-за хорошей проводимости), на всем куске метала будет большой положительный заряд и произойдет кулоновский взрыв.
Немного более подробно обьяснено тут:
www.nature.com/news/sodium-s-explosive-secrets-revealed-1.16771t-nick
13.02.2018 12:21А еще, из-за потери электронов, металл становится прозрачным, как стекло!

Tufed
13.02.2018 15:07Забавный факт, а можно подробности?
t-nick
13.02.2018 16:13Вот демонстрация youtu.be/DJGVZNth68k
Если вкратце, материал пропускает или не пропускает видимый свет в зависимости от наличия электронов, способных поглотить энергию проходящих через материал фотонов. В металлах — это как раз валентные электроны. Электроны на нижних уровнях имеют слишком большой потенциальный барьер, и энергии фотонов видимого света недостаточно, чтобы их поднять на более высокий уровень. Таким образом, при потере валентых электронов (в реакции с водой), натрий становится прозрачным.
t-nick
13.02.2018 20:50Минусуйте на здоровье, но этот вывод был сделан автором вышеприведенной статьи
на примере калия youtu.be/BIGMfai_ICg
ftvkun
13.02.2018 22:27Прозрачным становится не натрий, а расплавленный гидроксид. И некоторое время он находится на поверхности воды из-за своей высокой температуры — «парит» на парах воды (Эффект Лейденфроста). Когда гидроксид охлаждается достаточно и опускается под воду происходит уже взрыв от резкого испарения воды.
Есть еще одна статья, в которй реагировали каплю сплава Na/K с водой без взрыва:
onlinelibrary.wiley.com/doi/10.1002/anie.201605986/abstract
В supporting information есть видео рекции металла с водой без взрываt-nick
14.02.2018 01:24Хм, верно. Давно смотрел эту тему. Видимо идея появления прозрачности из-за потери электронов моя собственная, и скорее всего не имеет ничего общего с реальностью. К сожалению не могу прочесть статью. В приведенном мною видео Мейсон сомневается в верности предположения о природе явления. Возникает ряд вопросов, на которые я не нашел внятных ответов. Есть ли подтверждения того, что прозрачная капля является гидроксидом? Способна ли поверхность воды удерживать тело большей плотности (капля давит на водяной пар, пар давит на воду)? Почему раскаленный алюминий не плавает на поверхности при сходных условиях? Почему капля чернеет перед тем как стать прозрачной?
В supporting information есть видео рекции металла с водой без взрыва
В конце капля все-таки взрывается. Вот если бы ее можно было спасти и провести анализ состава…t-nick
14.02.2018 01:31Все, нашел, действительно гидроксид:
For verification that the transparent drop consists of molten hydroxide, it was quickly removed out of the reaction vessel at the stage shown in Figure 1E with a stainless steel mesh. After solidification the drop was crumbled to powder which was spread on a KCl window, then molten and resolidified. Finally, transmission infrared spectra were recorded using a Bruker Equinox Fourier transform infrared spectrometer with an optical resolution of 2 cm-1 The reference spectrum was analogously recorded by prepa
ring a 1:1 mixture of NaOH (Fluka, 99%) and KOH (Sigma-Aldrich, 99.99%). To study the various details of the reactions, additional high-speed recording with up to 30000 frames per second was performed by a MotionProY4 high-speed camera of IDT/Imaging Solutions.

ftvkun
14.02.2018 08:00Есть ли подтверждения того, что прозрачная капля является гидроксидом?
Да, как вы уже написали, ее изолировали и охарактеризовали по IR
Способна ли поверхность воды удерживать тело большей плотности (капля давит на водяной пар, пар давит на воду)? Почему раскаленный алюминий не плавает на поверхности при сходных условиях?
Немного не точно написал — это обратынй эффект Лейденфроста. У воды очень большое поерхностное натяжение и на поверхности может удерживаться много различных нетяжелых предметов. В данном эксперименте использовали всего 100 мг сплава Na/K так что вполне логично, что маленькая капля расплавленного гидроксида(С температурой порядка 600 С!) пару секунд парит на подушке из водяного пара. Такая же маленькая капля алюминия тоже, возможно, будет на поверхности некоторое время, пока не охладится достоточно
Почему капля чернеет перед тем как стать прозрачной?
Тут не могу сто процентно сказать. Синяя — из-за цвета сольватированых электронов, которые очень активно переходят в воду. Красная — из-за большой температуры. Как по мне, так она не черная, а просто непрозрачная из-за различных остаточных реакций или конвекции вещества внутри капли.
erwins22
13.02.2018 00:19соединение гелия с натрием
nplus1.ru/news/2017/02/08/chemistrywithhelium
остальные благородные давно пали.
хватит Итана, он чушь пишет.

alexstup
13.02.2018 03:03Объясните, почему как добавление какого нибудь протона к атому, резко меняет физические свойства объекта? Типа из неона натрий и т.д.

Greendq
13.02.2018 14:04Увы, исходники и документация по проекту «Мироздание» у нас отсутствуют, поэтому приходится воспринимать сей факт как данность.
Wizard_of_light
14.02.2018 00:15Так в статье же и расписано — меняется конфигурация электронной оболочки, а эта оболочка в привычных человеку условиях и определяет, как атомы взаимодействуют друг с другом.

alexstup
15.02.2018 16:20А как определяет?

Victor_koly
15.02.2018 16:42Электроны желают занять состояние с минимальной энергией (но такое, какое было бы разрешено).

stanislavskijvlad
13.02.2018 08:40Товарищ Итан мог бы рассмотреть реакцию натрия с хлором. Поверьте, это куда интереснее.
kauri_39
13.02.2018 16:09-1Вначале две поправки:
- Атом кислорода имеет меньшие размеры, чем атом водорода, и это можно было отразить в схематическом изображении молекул воды.
- "и, наконец, при достаточном количестве энергии атмосферный водород вступает с водородным газом в реакцию горения." — это атмосферный кислород вступает...
Эту статью можно использовать как повод поразмыслить о новом понимании энергии. Здесь часто говорится — выделяется энергия. А в виде чего она выделяется? Наверное, в виде фотонов, когда происходит, например, присоединение освободившихся электронов натрия к протонам, что превращает последние в нейтральный водород.
Фотоны, видимо, излучаются электронами при их переходе на орбиты вокруг протонов. Так выражается "дефект масс": энергия/масса атома нейтрального водорода меньше суммы отдельных энергии/масс электрона и протона. Меньше на энергию фотона, излучённого электроном, попавшим в электрическое поле протона.
Теперь попробуем то же самое выразить через понятие плотности энергии вакуума. Я тут давно толкую, что в гравполе эта плотность ниже, и что на это указывает снижение частоты фотонов, излучаемых цезием в атомных часах. Но, видимо, и в электрическом поле плотность каким-то образом снижена — таким, что это замечают лишь электрически заряженные частицы. В частности, электрон, подлетевший к протону. И тогда ему становится энергетически выгодно излучить уже лишний фотон.
Есть у кого какие соображения или информация по этому поводу?
ru1z
13.02.2018 20:21Атом кислорода имеет меньшие размеры, чем атом водорода
Нет конечно, откройте любой справочник. Второе замечание по-видимому исправили по тихому.

ZLO_RD
14.02.2018 22:00www.youtube.com/watch?v=LmlAYnFF_s8 — посмотрев вот это я больше не верю в:
«и, наконец, при достаточном количестве энергии атмосферный водород вступает с водородным газом в реакцию горения.»
В видео рассказывается, что взрыв происходит только из-за переноса электронов, взрыв водорода не может случиться так быстро и часто случается потом.

Victor_koly
15.02.2018 12:12+1Уровни энергии квантуются кратно постоянной Планка
Квантуется момент импульса. А энергия уже зависит от собственного числа оператора L^2 и прочих, входящих в гамильтониан системы «ядро + электроны».


cicatrix
Из квантового здесь — только принцип запрета Паули, но тогда в реакции натрия с водой нет ничего особенного. Любая химическая связь — следствие этого запрета.