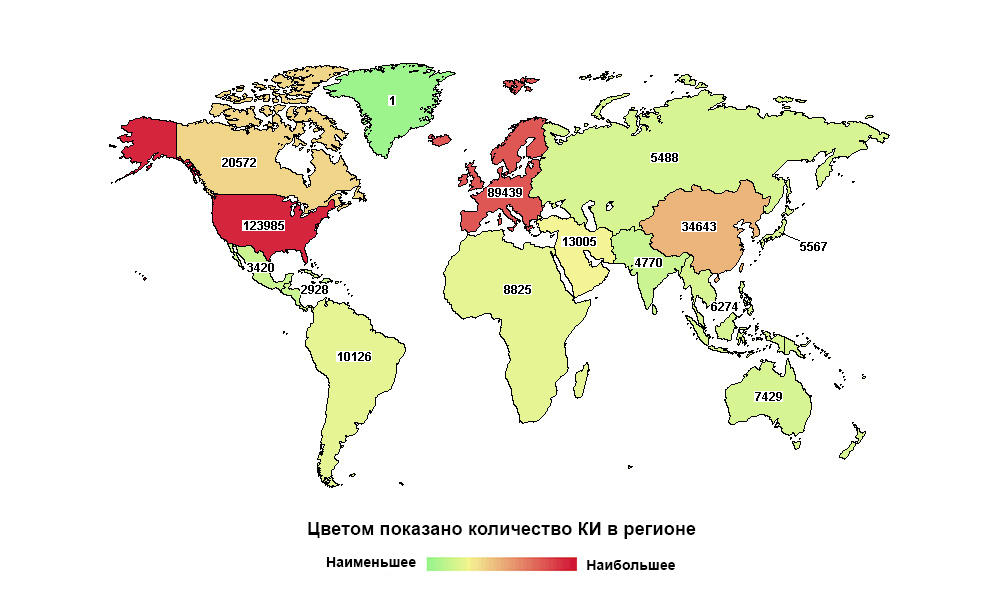
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Любое лекарство сегодня, прежде чем попасть к пациенту, проходит длинный ряд клинических испытаний. Нужно доказать, что оно способно решать определенную проблему со здоровьем, причем делать это эффективнее и, желательно, безопаснее предшественников.
Отбор жесткий – 98% из всех исследуемых препаратов не доходит до пациентов. У 2% «счастливчиков» научные изыскания по новому веществу до выхода на рынок занимают более 12 лет и более 1,5 миллиардов долларов.
Мы в клинике «Медицина 24/7» связаны с клиническими исследованиями напрямую. Уже 2-й год подряд мы проводим клинические исследования зарубежных противоопухолевых препаратов. Новые лекарства с нашей помощью быстрее получают доступ в Россию, а более 100 людей в год – еще один шанс на лечение, бесплатно.
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Грустные истории. Зачем нужны клинические испытания и почему без них – плохо
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Раньше семейный доктор знал истории всех своих пациентов наизусть, врач мог всю жизнь прожить в одном городке, найти и запомнить персональный подход к лечению каждого. Тем более, выбор снадобий был невелик: целебные травы, пиявки, ртуть да мышьяк. Ответственности во времена постулата «на все воля Божья» на врачах было поменьше.

Мышьяком с конца XVIII «восстанавливали» потенцию и «лечили» артрит…

… а ртуть, например, была слабительным и «от сифилиса».
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
В идеале, медик должен использовать только те методы профилактики, диагностики и лечения, которые имеют крайне низкую вероятность получения «случайных результатов», потому что полезность и эффективность их доказана многими корректно проведенными экспериментами.
Это и есть доказательная медицина – единственный адекватный на сегодня подход к такому серьезному делу, как здоровье людей.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.
В 1937 умерли 105 детей и один взрослый, принимавшие «эликсир» из антисептика сульфаниламида и… ядовитого диэтиленгликоля. Да, тот, что сегодня используется в антифризе. Тогда фармкомпания M.E. Massengill по незнанию использовала его как растворитель, вспомогательное вещество. Никаких исследований безопасности полученного «коктейля» для людей не проводилось. Когда спохватились и изъяли препарат из продажи, жертв уже было более сотни. В 1938 г. Конгресс США принял закон об обязательных исследованиях препаратов до их поступления в продажу. Контроль за этим возложили на FDA (англ. Food and Drug Administration) Управление по санитарному надзору за качеством пищевых продуктов и медикаментов
Еще более громкий скандал произошел с талидомидом в конце 1950-х – начале 1960-х. «Успокоительное и снотворное, которое отлично помогает при токсикозе беременных» раскупалось быстро. Исследования его проводили только на крысах. Оказалось, этого недостаточно. У людей Талидомид вызывал дефекты развития плода. В Европе, Австралии и Японии около 10 000 детей родились с мальформациями (пороками развития) конечностей. Препарат запретили в большинстве стран в 1961 году.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Как проходит исследование и почему так долго?
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
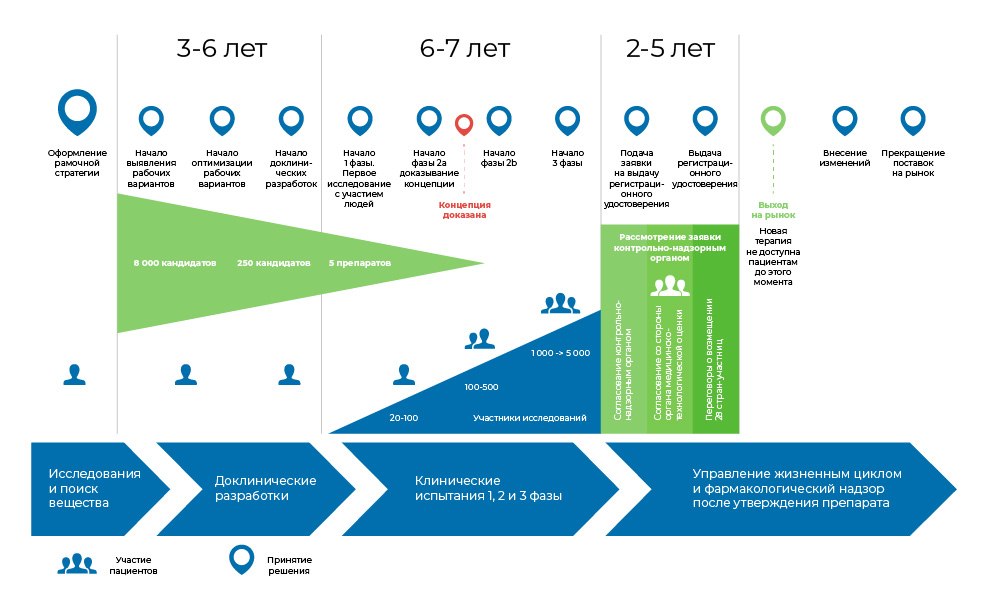
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
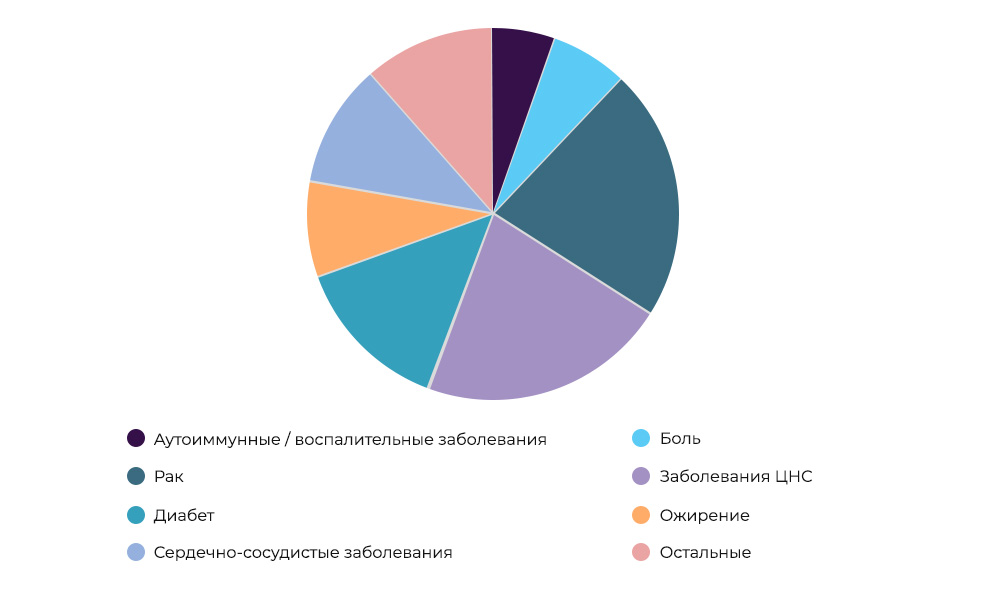
Исследования противораковых препаратов – 23% всех КИ в мире
Кто оплачивает исследования. Иногда организатором и спонсором может стать научно-исследовательская организация. Но чаще ученые занимаются научными изысканиями на средства фармацевтических компаний. Те рассчитывают выйти с успешным препаратом на рынок, получить прибыль и окупить затраты на КИ и разработки. Это как выкупить для проката в кино новый фильм: прокатчик не знает – «выстрелит» или нет. Производить новые препараты – очень рискованный бизнес.
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.
Именно таков случай нашей «Медицины 24/7». Фармкомпания готова платить, но финансы выделяются по окончанию исследования, по факту произведенных расходов. Какой-то сверхприбыли на этом клиника не зарабатывает. А врачи-исследователи вообще не зарабатывают на этом ничего сверху своей обычной з/п. Скорее, такова позиция руководителя клиники: человек считает правильным двигать вперед медицину страны и пользуется возможностью в этом поучаствовать.
Сначала появляется идея. Собственно, что исследовать? В онкологии сначала находят «мишени» – слабое место болезни. Если нарушить или просто «выключить» работу молекул-мишеней, опухоль «терпит убытки». На этом принципе построены многие современные препараты от рака – таргетные или иммунотерапевтические.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
Еще Авиценна в 1025 г. в «Каноне врачебной науки» писал, что лекарства нужно подвергать проверке. Причем, желательно – на потенциальном пациенте, человеке. Ведь результат, полученный на львах и конях, не гарантирует, что на людей лекарство подействует так же.
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После тяжелых побочных эффектов от одного препарата в 2006 г., этический комитет стал еще строже. Поэтому иногда исследование может «зависнуть» на этом этапе на год и более.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
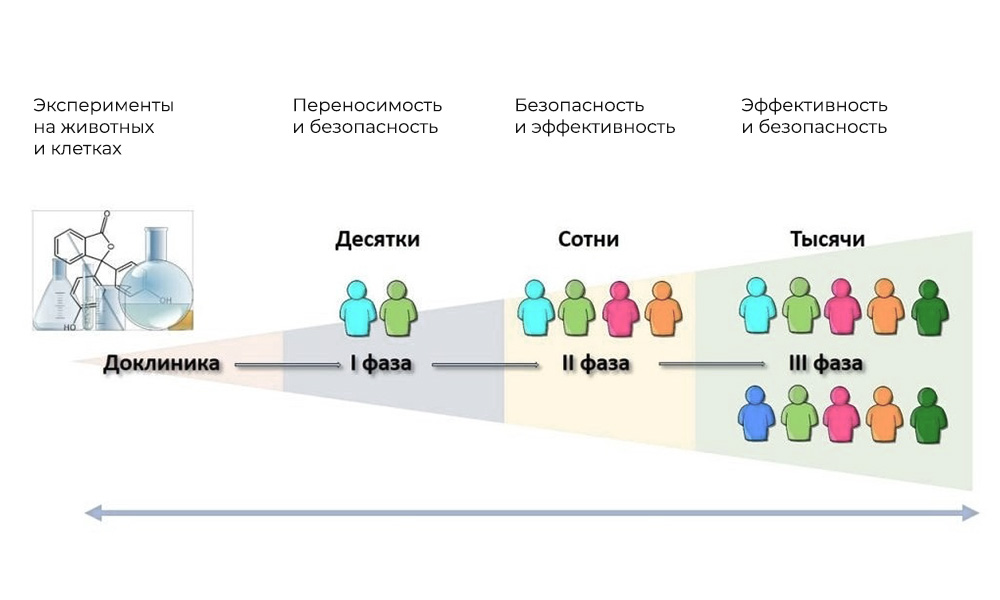
Основные фазы клинических исследований – на людях
Фаза I. Проверка механизма действия
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Фаза II. Проверка действия на заданную цель: конкретный вид заболевания
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Для участия в этой фазе КИ пациенты отбираются по гораздо большему количеству критериев, чем в первую фазу. Например, не просто «рак молочной железы», а «рак молочной железы, стадия T2N1M0, HER2-положительный подтип».
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Вся эта «конспирология» нужна, чтобы исключить умышленное или неосознанное искажение данных эксперимента участниками или исследователями.
Так, в первой фазе, где нет таких жестких требований, бывают ошеломительные результаты. Это «грязная» статистика, в фазе II она очищается от лишнего и результаты становятся правдоподобными.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Фаза III. Подтверждающие исследования
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.
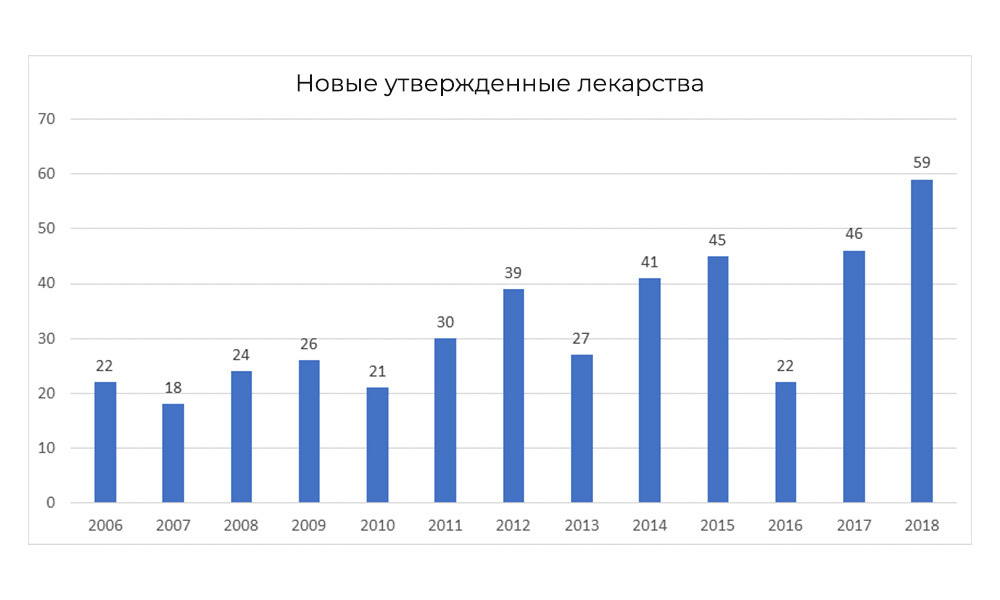
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
Особенности национальных исследований: дополнительный этап КИ в России
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
«Медицина 24/7» участвует в исследованиях фазы III.
Так мы вносим вклад в ускорение процесса регистрации препаратов. Чем быстрее у фармацевтических компаний окажутся данные по необходимому количеству пациентов, тем быстрее лекарство «примут на вооружение». Сначала во всем мире, затем и у нас. В итоге мы влияем на то, чтобы его смогли получать все – не только в частных клиниках, но и в любом государственном онкодиспансере, по ОМС.
К тому же, для наших пациентов участие в клинических исследованиях III фазы – это возможность получить уже достаточно проверенное и безопасное новое лечение– без нескольких лет ожидания, пока оно официально «доберется» до России.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Как происходит исследование
К нам в атмосфере полной секретности привозят само вещество и толстую папку на 1 200 листов, где прописан дизайн и протокол исследования. Там указана каждая мелочь: как, в какое время и в каких дозах мы должны вводить препарат, как часто и в каком количестве брать кровь на анализ, какие анализы проводить, как часто делать МРТ и КТ. Сколько раз в день и в какой форме отправлять «шифровки в центр» – отчеты компании-организатору КИ.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Конечно, всех подряд взять в исследование не получится. Требования даются «сверху», и это очень узкий набор параметров: сколько должно быть лет участникам, какой точный диагноз, были/не было операций, уровень креатинина и железа в крови – до знака после запятой.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Но если тема касается вас близко – загляните в списки клинических исследований на RosOncoWeb, CTAgency и на сайте Минздрава. И обязательно свяжитесь с онкологами «Медицины 24/7» – шансом нужно воспользоваться.


vanxant
Карта на КДПВ — огонь!
minamoto
Не то слово.
Кстати, при чем тут Россия — непонятно, т.к. на карте она не обозначена. Обозначена «Северная Азия», в которую входит Россия, и сравнение идет с такими же макро-регионами.
Кстати, ссылку было бы правильнее дать на место расположения карты, т.е. сюда: www.clinicaltrials.gov/ct2/search/map
martin_wanderer
К слову, в оригинальной карте по ссылке можно «провалиться» внутрь макрорегиона и увидеть данные конкретно по России. А деление на регионы забавное, да. «Северная Азия» — это такой СССР без Прибалтики.
hokum13
Сходил по ссылке. Там еще веселее. Если открыть эту самую "Северную Азию", то у РФ останется только 4580 КИ. В то же время у соседней Украины 1877.
Но вот сумма количества КИ даже этих 2-х стран сильно больше 5494, самого макрорегиона.
minamoto
Некоторые исследования ведутся одновременно в нескольких регионах. Если открыть список по Украине, то в списке первых 100 исследований 5 упоминаний РФ, несколько упоминаний Грузии, и т.д.
Логично предположить, что для макрорегиона такое исследование считается за 1, а при детализации по странам — за 2 или более.
hokum13
Но тогда «Россия – третья с конца» — явное «натягивание совы на глобус». В том смысле, что масштаб выбран не корректно. Канада и США почему-то отделены от Северной Америки, а Африка объединена. В том смысле, что у Северной Америки в целом окажутся 138к исследований, а у северной и южной Африки может оказаться меньше 5к. Пуэрто Рико, который по сути часть США, почему-то отнесен к Центральной Америке.
Перерисуй карту по другому и получишь не 3-я с конца, а 3-я с начала… В общем как всегда искуство статистики заключается не в том, как собрать данные, а в том, как их
корректно«удобно для заказчика» представить.Europe 89,539
East Asia 34,700
Canada 20,593
Middle East 13,018
South America 10,135
Africa 8,838
Pacifica 7,439
Southeast Asia 6,281
Japan 5,575
North Asia 5,494
South Asia 4,775
Mexico 3,420
Central America 2,928
Greenland 1
Medica24 Автор
Поправили подпись, теперь огонь)
amarao
Главный вопрос забыли осветить. Если это stage III, то есть 70% вероятность схватить то, из-за чего препарат не выводят на рынок.
30% что всё будет хорошо и сработает, но а) на халяву, б) в ситуации, когда других препаратов может и не быть.
0serg
Ну не совсем все же. 70% зафейлившихся лекарств — это там где серьезные побочки вылезли хотя бы у части участников группы. Т.е. мало попасть в эти 70%, надо еще попасть в некоторое подмножество этих 70% где наблюдались проблемы, а в третьей фазе испытаний столько народу участвует, собственно, ровно в силу того что это подмножество у лекарств прошедших все предыдущие проверки довольно невелико.
kisaa
Если это онкология, то там серьезные побочки вылезают в каких-то объемах, наверное, для каждого одобренного и используемого лекарства.
DGN
Если 30% препаратов проходят фазу, то это не значит 70% вероятности «схватить то, из-за чего препарат не выводят на рынок». Как минимум 50% вероятность попасть в плацебо группу, оставшиеся 50% делят не только фатальные побочки, но и неэффективность по сравнению с аналогами, сложности в использовании и все такое прочее.
TiesP
Хорошо, что хотя бы частные клиники в России этим занимаются.
Похоже, у крупных федеральных центров какие-то другие
Goron_Dekar
А талидомид проходил клинику, правда не на беременных. С клиникой для беременных/кормящих и сейчас полный швах, шансов пройти эти испытания мало даже в США, даже имея бюджет байера. Поэтому большинство лекарств и промаркированы не для беременных/кормящих.
Eldhenn
И тем более — для маленьких детей. "Исследований не проводилось" и "запрещается до года, потому что". Увы, выхода из этой ситуации нет.
DGN
Страны третьего мира?
Tarson
Главное не попасть в группу плацебо…
minamoto
Для исследований, сопряженных с лечением опасных заболеваний (точного перечня не знаю, но рак, наверняка, относится) в контрольной группе применяется наилучшее имеющееся на текущий момент лечение.
kisaa
То есть претендент должен показать либо лучшую эффективность при равных побочных, либо меньшие побочные эффекты при схожей эффективности?
minamoto
Я точных критериев эффективности не знаю, но есть мнение, что даже если претендент показывает такую же эффективность, или даже несколько хуже, то его могут допустить до производства, чтобы применять, например, в случаях, когда уже работающий препарат дает побочные эффекты.
По крайней мере, для некоторых заболеваний у докторов есть спектр лекарств, который они подбирают в зависимости от особенностей пациента, и могут назначить более слабое, но не дающее серьезных побочек.
DGN
Либо низкую стоимость (при том не только самого препарата, но и всего клинического процесса) при чуть больших побочках и/или чуть меньшей эффективности. Собственно это уже дальше фармкомпания решает, есть у препарата рыночная ниша или нет.
gasizdat
Т.е. в Хаусе соврали про этот момент? Все врут...
minamoto
ЕМНИП, по крайней мере поначалу Хаус создавался на основе реальных медицинских случаев и озарений, собранных по всей Америке. Возможно, данный конкретный материал был создан на базе прецендента, случившегося еще до принятия таких правил — они появились не так давно.
Так то, даже совершенно неэтичное исследование сифилиса Таскиги (предположительно приведшее к недоверию к белым медикам со стороны черных, что в одной из серий Хауса, кстати, показано) закончилось только в 1972 году.
В любом случае, я не помню, про какой эпизод идет речь, поэтому судить не берусь )
gasizdat
В пятом сезоне был эпизод, где Форман устраивает 13-тую на клинические испытания лекарства от хореи Гентингтона. При этом следит, чтобы она не попала в контрольную группу с плацебо. За что и получает заслуженное увольнение.
minamoto
Точно, спасибо, вспомнил.
Там как раз вроде был случай, что существующее лечение неэффективно — т.е. как раз относится к первому пункту из списка ниже.
Собственно, хорея Гентингтона до сих пор неизлечима.
minamoto
Чуть больше деталей:
Данное заявление было сделано в Хельсинкской декларации Всемирной медицинской ассоциации, и звучит так:
Georg93
В целом статья довольно хорошо написана, немного нагнали мистики в практической части.
И, хм, про выплаты скромничаете.
—Мимо-работающий-в-сфере
rboots
Сразу минус 10 к доверию таким источникам. То есть во Вьетнаме, Кубе, Венисуелле и Северной Корее с исследованиями рака лучше? Или рейтинг составлен с «дупущениями», которые переворачивают картину?
Kanut
Тут на мой взгляд проблема не с источником, а с цитирующим. Потому что на самом www.clinicaltrials.gov я ничего похожего на «Россия – третья с конца по количеству клинических исследований» не вижу.
tmin10
А вот если показать так, то Россия становится первой, правда в своём макрорегионе.

Medica24 Автор
Поправили подпись к карте, спасибо, что обратили на это наше внимание
Meklon
Так себе с этичностью плацебо при смертельных заболеваниях. Разве по стандарту не заменяется на обычную стандартную терапию?
Просто получается, что человек теряет время и лечится физраством, когда ему нужна терапия.
UPD Не увидел комментарий выше.
Stiver
DGN
Представляете, есть и плацебо-хирургия.
Кстати говоря, в плацебо могут добавлять препараты, чтобы вызывать жар и тошноту к примеру.
CactusKnight
Еще нужно не попасть на товарищей типа Паоло Маккиарини
Meklon
Своеобразный человек. Но колоритный. Было интересно работать с ним. Но конкретно наша группа работала с животными и за наши исследования не стыдно.
CactusKnight
За наши исследования нам тоже, в общем-то, не стыдно, ибо мы работали только с химией. Но вот легкое ощущение того, что бы будто собираешь бомбу, которую вот-вот сбросят на мирный город, как-то периодически накрывало. В общем, сей факт своей научной биографии я стараюсь не афишировать
consumer
Во-первых, подобные статьи прямое нарушение ICG GCP E6, ФЗ-61 и тд. Во-вторых, статья рекламная, конечно, но после заявлений, что клиника не зарабатывает на онкотраилах, рожа кривится как от плохой игры. Про третье место России уже говорили. В остальном перлов не меньше.
Есть реестр grls.rosminzdrav.ru, где можно по любой нозологии найти трайл и в любом регионе. И да, 4 протокола с Астразенкой это не какой-то там передовой опыт в онкологии, для справки
Vsevo10d
Еще резануло, что брошюра исследователя — это «краткая шпаргалка». Да это полноценный отчет о всей до/клинике, актуализируемый по мере новых исследований, страниц на 100-200!
sotnikdv
Этично ли при этом распределять их в контрольную группу, получающую плацебо? Т.е., по-сути, люди остаются без лечения вообще.
where-is-s
Не очень этично, но какие есть другие варианты?
Стоит заметить, что плацебо имеет бОльшую эффективность по сравнению с полным отсутствием лечения. Кроме того, экспериментальные методы — это всегда большая лотерея, в которой не известна даже сама вероятность выигрыша. Есть только какие-то предсказания с огромным допущением, плюс нешуточный риск внезапных осложнений при применении лечения. В результате определение в контрольную группу совершенно точно не ставит крест на пациенте, это как минимум лежит в серой области на шкале этичности.
Yuriy_krd
Они не остаются без лечения вообще. Их лечат, но теми методами, которые уже выведены на рынок и прошли сертификацию.Т.е. новый препарат сравнивается не с отсутствием лечения, а с уже применяемыми в практической онкологии методиками.
Zmiy666
Эм… а как быть если некий «препарат» убивает примерно 50% пациентов, а 50% вылечивает?
Он получается в принципе не пройдет КИ и не может быть применен, хотя мог бы спасти как минимум половину пациентов? Какое вообще соотношение убитых/вылеченных должно быть, чтоб препарат прошел? И что делать людям, которые хотят получить лечение, пусть и с шансом помереть, но без него они помрут в 100% случаев.
kommari
Немного не так. Чаще всего учёные ищут лекарства за счёт всего общества в государственных институтах. Если они что-то нащупали, увольняются (зачастую вместе с командой), делают фарм. стартап, который продают за кругленькую сумму фармацевтическим компаниям. Напрямую попасть на рынок лекарств они не могут ввиду бюрократических предпядствий, которые в первую очередь этими фарм. фирмами и создавались.
Поэтому, не нужно вестись на крокодильи слёзы фарм компаний о том, что они ничего не зарабатывают, что всё съедает R&D. Большая часть этих расходов лежит на обществе, а фарм. компании сейчас снимают сливки. Такие дела.
vikarti
А вот чисто теоретически (для литературных целей) интересно:
— допустим нашелся способ лечение рака, по описанию — понятно при правильном использовании эффективность 100% и без побочек но также понятно что неправильно методику вполне можно использовать и можно очень серьезно напортачить. На животных вообще не тестировали (хотя ничего не мешает это сделать), на человеке применили один раз раз когда врачи отказались уже лечить потому что 4-я стадия и все плохо — получилось, при этом данный человек прямо просил попробовать. После этого — методика дошла до группы врачей онкологов и они решили попробовать в такой же ситуации когда уже понятно что обычные методы не особо помогают и тоже более менее успешно (хотя не без побочных эффектов) (пациентов просто спросили согласны ли нет на эксперимент).
Допустим изначально разработчика (впервые это применившего) посадить не получится и с его точки зрения — вот вы просили хоть что-то — вот вам решение, ну да я не врач, ну да — с моей точки зрения меры чтобы не было хуже — были применены, адекватные.
Врачи кто методику применил без испытаний — сядут? Или организуют какой то ускоренный процесс? Если по современным Российским правилам.