
Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Мы в «Медицине 24/7» регулярно прибегаем к молекулярно-генетическому исследованию, чтобы лечить человека тогда, когда «все перепробовали – больше ничего не сделать». И пациенты, которым, казалось, ничем больше не помочь – продолжают жить. Одни – два месяца вместо двух недель, а другие – годы вместо пары месяцев.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
«Порядочные» клетки живут, не мешая другим. Используют строго отведенное количество ресурсов, достойно выполняют свои биологические функции, а в положенное время – умирают, уступая место следующим поколениям (этот процесс называется апоптозом). Каждые 7-10 лет тело человека полностью обновляется.
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Перед делением клетка запасается «копией» наследственной генетической информации, которая находится в ее ядре. Нити ДНК, «свернутые» в хромосомы внутри ядра – реплицируются, т.е. удваиваются. И уже после этого клетка делится, спокойно раздавая каждой из дочерних клеток по идентичному набору хромосом. Из одной клетки получается две абсолютно таких же, и вместе со своим генетическим багажом каждая из них получает «знания» о том, как ей надо жить, какую функцию выполнять и сколько раз в жизни делиться.
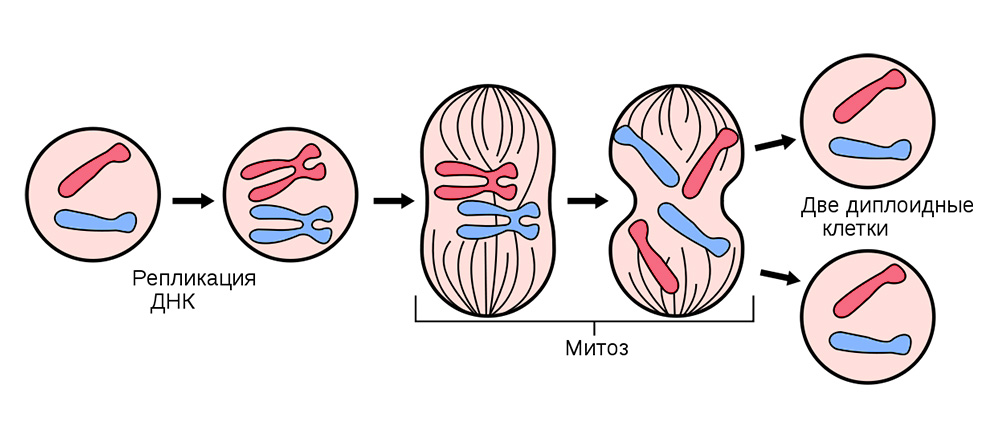
Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
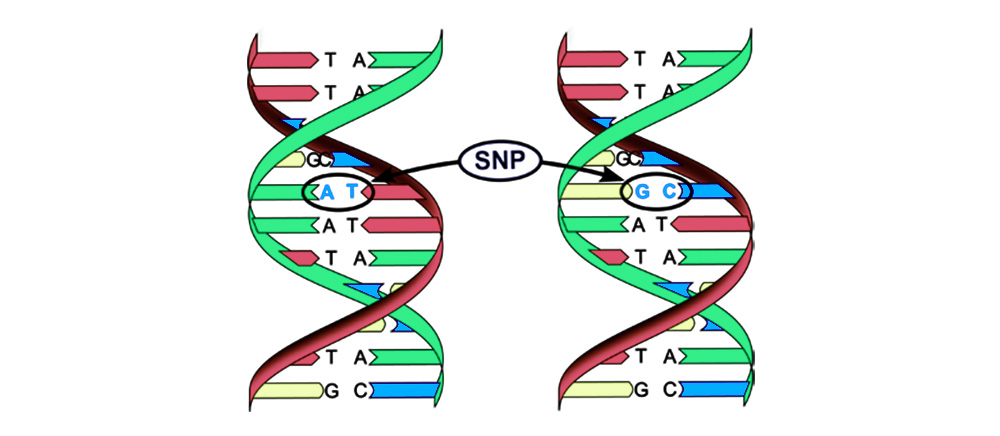
1. Замена пары оснований (Single-nucleotide polymorphism, SNP): один нуклеотид – «буква» генетического кода – меняется на другой. Нарушается и структура белка, закодированного этой последовательностью нуклеотидов.
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
Оторванные «кусочки» ДНК могут встроиться в соседнюю хромосому – получится инсерция (или инверсия, если вставка произойдет в обратной последовательности). Иногда между хромосомами происходит «взаимный обмен» участками ДНК – транслокация. Итог один: экспрессируются «лишние» гены.
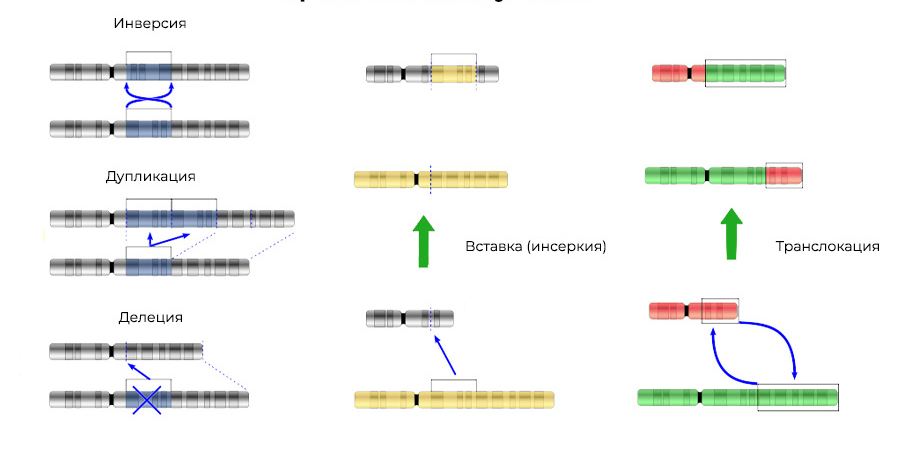
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
3. Слияние генов – ген «собирается» из частей других генов и экспрессируется (срабатывает) как одно целое. Белок при экспрессии такого химерного гена тоже получается необычный, гибридный, с вредными свойствами.
Два гена «склеились» при транслокации и образовали химерный ген (вызывает лейкоз)
Нам повезло, что в ДНК полно не слишком значимых участков, которые не кодируют ничего. Многие мутации происходят в этих областях – и оказываются незначительными, не имеют влияния на дальнейшую работу клеток. И такая клетка с небольшим отличием от «эталона» продолжает нормально жить и делиться.
За 70 лет в теле человека происходит 100 трлн клеточных делений. Это 1,4 трлн делений в год – достаточно случаев, чтобы со временем накопить «критическую массу» ошибок в ДНК, или чтобы очередной сбой смог-таки попасть в участок ДНК, кодирующий что-то важное. Получится небезобидная мутация, из-за которой клетка станет злокачественной (малигнизируется).
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
Они передают сигналы между клетками многоклеточного организма, активируют друг друга, запускают процесс деления и контролируют его корректность, поддерживают правильную активацию генов, выполнение клеткой своих функций, «проверяют» целостность генома, «командуют» клетке начать апоптоз, если ей пора умирать, и т.п.
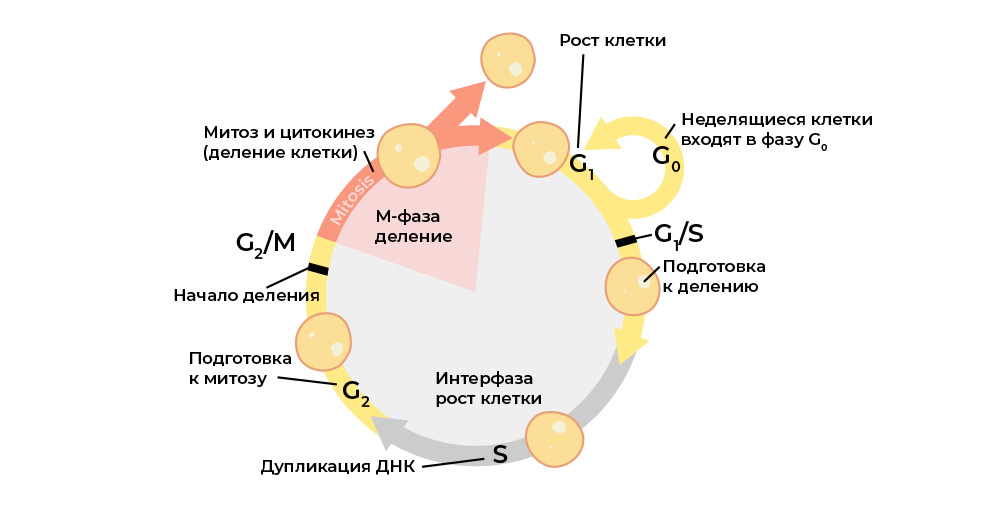
Каждый этап клеточного цикла контролируется белками-регуляторами
И каждый из этих белков закодирован в определенном участке ДНК – гене. Если такой ген подвергнется вредной мутации – он «воспроизведет» соответствующий белок-регулятор неправильно. А «неправильный» белок-регулятор нарушит работу клеточного цикла, и с ним – поведение всей клетки.
Например, «ломается» ген белка-регулятора пролиферации (разрастания массы клеток) – и «мутанты» начинают делиться больше положенного, «давят» здоровые клетки.
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Протоонкогены — «нормальные» гены, которые могут стать онкогенами из-за усиления или изменения их функций. Гены, экспрессия которых может привести к малигнизации клетки и развитию новообразования, называются онкогены. Если в протоонкогене произойдет вредная мутация, он становится онкогеном и может вызвать опухоль.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
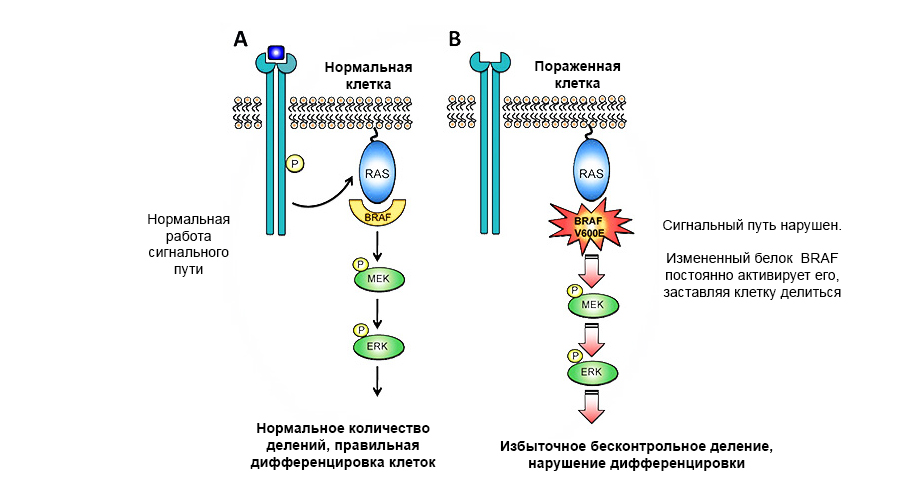
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Например:
- мутации BRCA1, BRCA2 – рак молочных желез, яичников;
- мутации p53 – до 50% различных видов раковых опухолей, в т.ч. саркомы;
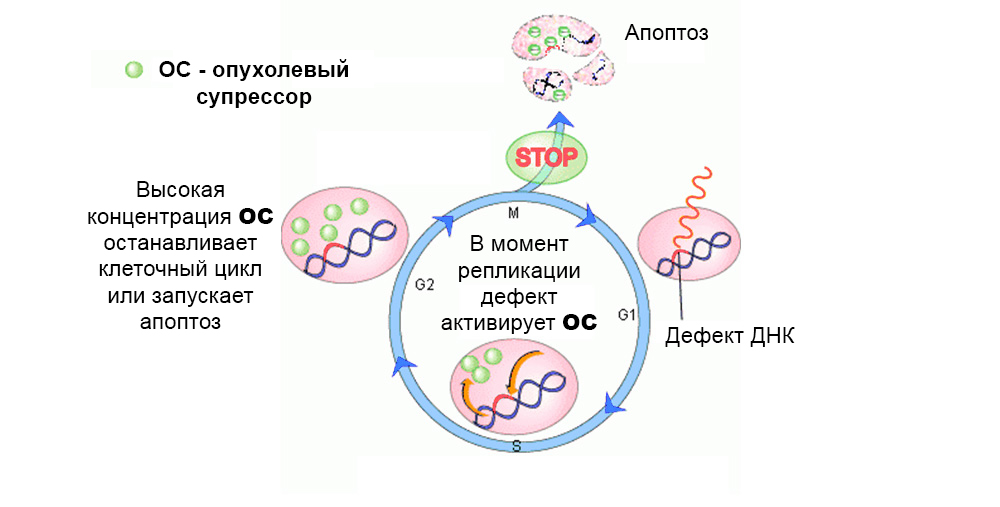
В норме действуют защитные механизмы против развития мутировавших клеток. Дефект в гене-суппрессоре опухоли «выключает» их
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
Каждая найденная в протоонкогене или гене-супрессоре мутация – это причина «суперспособностей» раковой клетки, типа пренебрежения к апоптозу и умения скрываться от иммунитета. Но одновременно – это и ее потенциально слабое место.
Зная, в чем причина особенностей механизма работы опухоли – можно найти вещество, которое этот механизм «заклинит», прервет цепь патологических реакций в клетке. Т.е., специфические мутации в опухоли – указывают мишень, по которой врачи «бьют» лекарством. Этот принцип позволил разработать таргетную терапию.
Таргетная терапия – название целой ветви эффективной лекарственной терапии рака – родилось именно от английского слова мишень (target). Таргетные препараты действуют «прицельно» на раковые клетки – потому что мутации в соответствующих генах есть только у них. У здоровых клеток таких мутаций нет – и на них препараты не действуют.
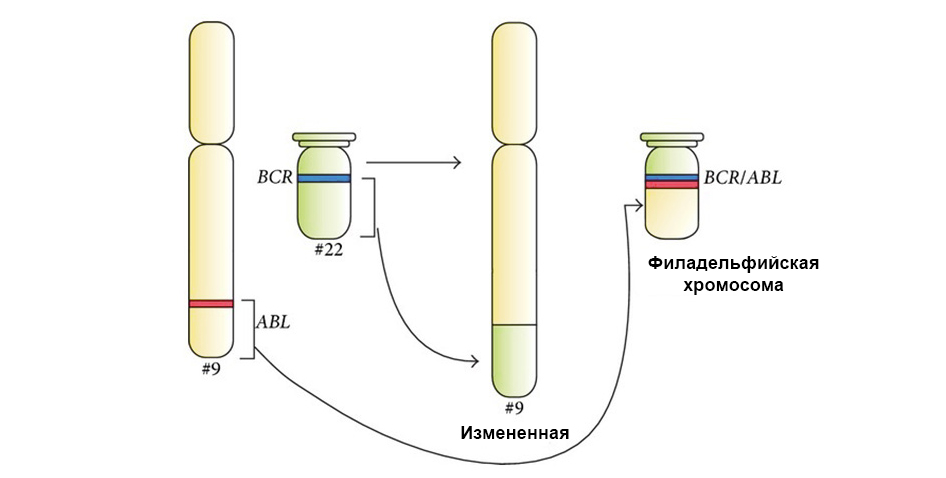
На рисунке ниже – механизм действия таргетного препарата Иматиниб на клетки опухоли с мутацией «филадельфийская хромосома»: слитый ген BCR-ABL. Эта мутация приводит к тому, что в клетке прекращает срабатывать механизм апоптоза – накапливаются ошибки в геноме, клетка перерождается в раковую.
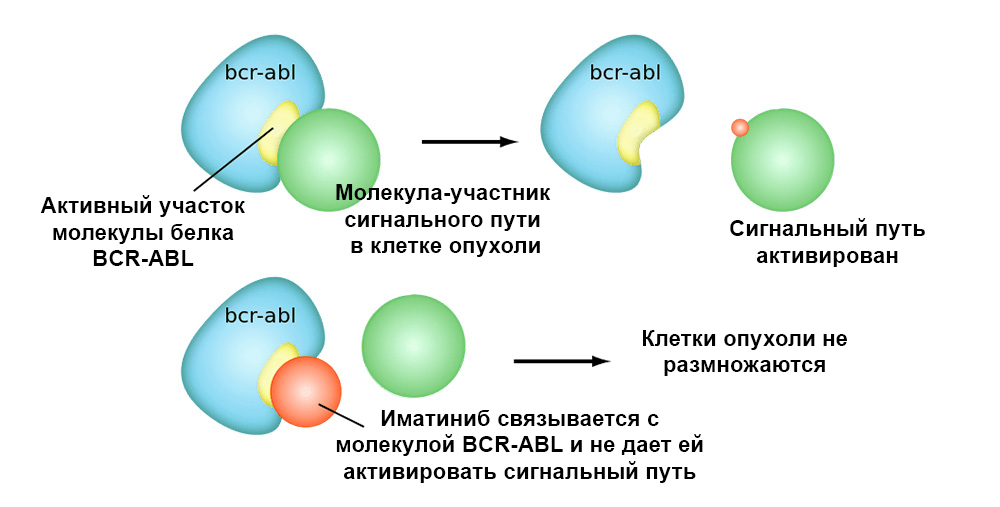
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Более высокая эффективность. Прицельное действие на опухолевые клетки позволяет добиться лучшего «ответа» опухоли на лечение. Например, по сравнению с классическим лечением, добавление таргетного препарата Трастузумаб вместе с химиотерапией при РМЖ с гиперэкспрессией HER2 заметно увеличило частоту «ответов» – 81% против 73%, и частоту полной морфологической ремиссии (исчезновение опухоли) – 43% против 23%
Меньше побочных эффектов. Классические химиопрепараты – с цитотоксическим действием. По сути, токсические вещества, чтобы убить или, по крайней мере, замедлить рост раковых клеток. Сильнее всего они действуют на клетки, которые быстро делятся. Именно поэтому от нее, например, выпадают волосы: это тоже вид активно делящихся клеток, и они «попадают под раздачу». Из-за такого не слишком прицельного действия, химиотерапевтические препараты дают серьезные побочные эффекты: страдают и ЖКТ, и другие органы.
В практике «Медицины 24/7» мы чаще всего назначаем таргетные препараты в составе комплексного лечения: сочетаем и химиотерапию, и таргет, и иммунотерапию.
Сложность в том, что каждая опухоль уникальна по своему набору «мишеней»-мутаций
Так же, как уникален код ДНК у каждого человека – неповторимы и опухоли. Ведь они «рождены» из собственных клеток организма. Не существует опухолей с одинаковыми генно-молекулярными свойствами. Поэтому создать универсальную «таблетку» от рака – принципиально невозможно. Рак – слишком индивидуальное заболевание.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
Чтобы эффективно использовать таргетную терапию, этого мало. Врач должен знать, какие мутации есть в опухолевых клетках у конкретного пациента, присутствуют ли в них биомаркеры-«мишени» для того или иного препарата. Персонализированная медицина, как она есть.
Для этого мы и применяем молекулярно-генетические исследования. Чтобы найти «мишени», по которым нужно прицельно бить таргетными и иммунотреапевтическими препаратами – нужно определить, из каких генов собрана ДНК опухоли, и какие гены в ней – «сломаны». В результате:
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ? ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Там из образца выделяют опухолевую ДНК и секвенируют ее. То есть – «прочитывают» последовательность «букв»-нуклеотидов. А затем сравнивают с диагностической панелью, отобранной из базы библиотек – уже расшифрованных геномов тысяч других людей. Панель подбирают под каждого пациента – с учетом анамнеза и клинических данных. Все это, разумеется, делают автоматические секвенаторы и компьютер.
И если 20 лет назад «чтение» генома занимало месяцы, требовало медленной и сложной расшифровки, то сегодня в лаборатории, с которой мы сотрудничаем, делают анализ за несколько рабочих дней.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
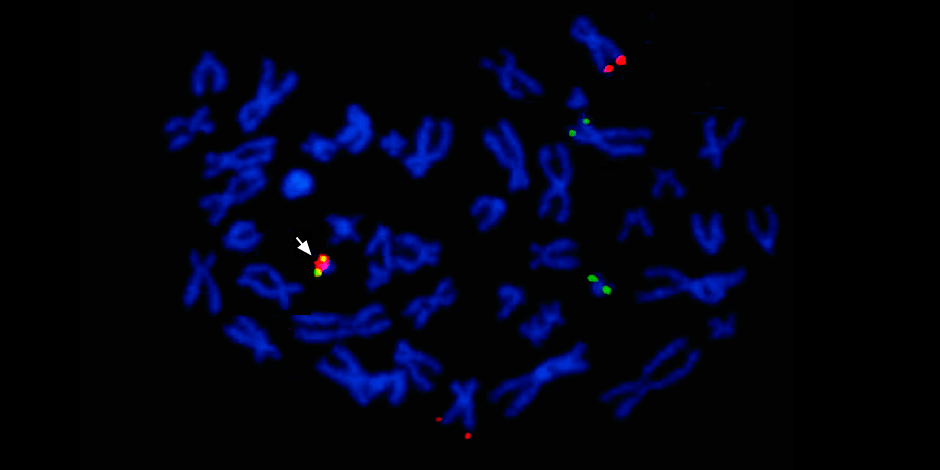
Под стрелкой слева – слияние красного и зеленого сигнала – свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В зависимости от запроса, такое исследование может занимать от 5 до 15 рабочих дней: одному пациенту нужно просто определить тип опухоли и уточнить рекомендованную терапию – достаточно проверить наличие базового набора из 20 мутаций ДНК по рекомендациям мировых онкологических ассоциаций. А другому, с редким диагнозом или резистентностью к стандартному лечению – нужно составить «молекулярный паспорт» опухоли, а для этого – секвенировать 400 генов.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.
В итоге, из этого отчета врач получает максимально полный молекулярно-генетический профиль злокачественной опухоли. У него есть информация что именно лечим, какую конкретно поломку в клетке. Есть самое «свежее» понимание, какие препараты сегодня уже одобрены или доступны для использования в рамках клинических исследований.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
Кому это нужно?
Тем, у кого развилась резистентность опухоли или непереносимость ко всем препаратам из стандартного протокола лечения. Ситуация, когда «все перепробовали – не помогло».
В принципе, нынешние стандарты лечения, особенно европейские и американские протоколы (NCCN), которые мы применяем в «Медицине 24/7», обладают хорошим терапевтическим потенциалом – не зря они считаются «золотым стандартом» лечения в онкологии.
По этим стандартам, сначала назначают препараты 1-й линии терапии – те, что статистически лучше всего помогают при данном диагнозе. Смотрят динамику. Если опухоль не реагирует на лечение или – что хуже – прогрессирует – переходят к препаратам 2-й линии – тем, что по результатам исследований давали чуть менее успешное лечение. Если эти препараты тоже перестают помогать – идем к 3-й линии, и т.д. Многим пациентам длины этой «цепи» хватает до конца жизни.
Но регулярно, к сожалению, врачи оказываются в тупике: в ситуации, когда все линии «протокольной» терапии закончились, а пациент жив и прогрессирует. Коварство раковых опухолей – в их изменчивости. Они очень быстро мутируют дальше, и приспосабливаются к любым условиям, к любым препаратам. Для пациента это означает развитие резистентности – все препараты, прописанные в протоколах лечения, перестали действовать на его опухоль.
Нужно продолжать лечение – а у врача закончились «инструменты», предписанные официальными стандартами лечения. Есть другие препараты, есть право назначить их off-label, вне стандартных линий терапии. Но как узнать, какое лекарство выбрать?
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Большинство онкологов в России НЕ используют молекулярно-генетические тесты. Потому что не имеют достаточного опыта работы с ними и специфических знаний. Не получится просто открыть отчет и «списать» оттуда лечение. Нужно принимать во внимание множество факторов, понимать, как все эти многочисленные мутации влияют друг на друга, на рост опухоли, на потенциальную индивидуальную переносимость пациентом препарата и т.п.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Необходимо продумывать комбинации из таргетных препаратов, уметь сочетать их химиотерапевтическими лекарствами, предусматривать возможные побочные эффекты таких «коктейлей». Это довольно сложная задача – и врач должен быть очень мотивирован постоянно учиться.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Так что, хоть нам в «Медицине 24/7» и приходится все время держать мозги в тонусе, разбираться в новых и новых исследованиях генетических мутаций – результаты определенно того стоят.
Будьте здоровы.


IgorNB_habr
Замечательное изложение — спасибо за статью!
А можно вопросы от далёкого от биологии человека?
1) Правильно ли, что диагностика получается персонализированной, но "препараты" выбираются из "стандартного пула", а не изготавливаются под клиента?
2) Раз мы знаем ДНК опухоли и "эталонное" ДНК здоровых клеток, то (если правильно понимаю) возможно сделать "персонализированное лекарство", которое через CRISPR-CAS9 пофиксит найденное проблемное ДНК и клетки умрут естественным путем. Интересно, такие "экспериментальные" лечения или исследования Вам встречались?
3) Ну и совсем уж наивный взляд "ИТ-шника" почему-то приводит к банальной мысли:
раз у нас есть "эталонная врождённая ДНК" и "мутировавшая ДНК (часть таких клеток раковые)", то решение проблемы — пробежаться по всем клеткам, сравнить с "эталоном" и поправить то, что "отличается". Будь такое возможно, то работало бы для всех видов рака. "Лекарство" делалось бы персонально один раз на всю жизнь, пока не заходим сменить врождённую днк. Фантастика конечно, но CRISPR-CAS9 тоже был фантастикой совсем недавно, а звучит в его духе — надежда есть? (:
user_man
В статье (да и во всех подобных) указывается, что мутаций много. В частности здесь приведён пример 80-20, когда 80% вредных клеток можно убить таргетировано, но 20% оставшихся будут делиться и создадут новую проблему. Плюс они мутируют «по ходу пьессы». Поэтому просто пройтись по всем и отстрелить «неправильные» ДНК не получится. К тому же «неправильные» ДНК бывают безопасными, а потому придётся убивать много полезных клеток. Ну а разобраться во всей этой каше могут далеко не все врачи, поэтому и со стороны выбора метода лечения тоже есть засада.
Medica24 Автор
1) Нот всего 7. Но сыграть можно хоть джаз, хоть Моцарта, хоть свое сочинить.
Мы делаем индивидуальную диагностику. Лечение выбираем из «стандартных блоков», но персонально под параметры пациента и его неповторимую генетику. В итоге подбор, комбинация препаратов и порядок назначения – все получается очень индвидуально.
2) Восстановить ДНК у всех раковых клеток разом – невозможно технически, даже если бы мы каким-то чудом все такие клетки поштучно обнаружили. Все они постоянно делятся. Пока модифицируете одну – рядом копируются другие
Сама CRISPR/Cas9 – еще недостаточно точная и специфичная технология, которая вполне может вырезать из ДНК нужный участок вместо «вредного» – то есть не исправить мутацию, а добавить еще и сделать только хуже.
Кстати, пока никто не придумал, как можно прицельно доставлять CRISPR/Cas9 именно в клетки опухоли, не вынимая их из организма.
3) Исправить ДНК вообще всех клеток, не совпадающих с «эталоном» – невыполнимая на сегодня идея.
Доставка компонентов CRISPR/Cas9-системы к клетке происходит с помощью «модернизированных» вирусных частиц. В организме триллионы клеток, и к каждой из них нужно будет запустить вирусную частицу, заряженную CRISPR/Cas9-системой. Зашкаливающая вирусная нагрузка. Организм погибнет просто от интоксикации раньше, чем «лечение» подействует.
Если нужно переписать одну страницу текста, исправив ошибку – ок, это возможно. Найти и переписать миллиарды страниц по всей библиотеке одновременно – нет. Работа библиотеки остановится.