
Многие заболевания и серьезные нарушения можно исправить, если вмешаться в генетический код человека. Это и генетические заболевания, включая врожденные пороки, слепоту и т. д, и последствия мутации клеток, такие как онкология, и даже лечение некоторых инфекций. Первые разработки в этом направлении были инициированы еще в 1960-х годах, когда только-только была открыта ДНК. С тех пор генетическая терапия сталкивалась со множеством прорывов и серьезных препятствий.
Сущность метода
Генная терапия позволяет редактировать ДНК — добавлять, изменять, ликвидировать некоторые её участки. Недостаток традиционных методов такой терапии в том, что нельзя точно сказать, в какой участок ДНК будет внедрен недостающий ген.
CRISPR — один из новых методов редактирования генома. «CRISPR» расшифровывается как «кластеризованные регулярно чередующиеся короткие палиндромные повторы». С их помощью можно «разрезать» ДНК в конкретном месте и встраивать новый участок именно в него, избегая нецелевых эффектов.
Есть два способа редактировать ДНК клеток:
In vivo — то есть внутри организма человека. Для доставки ДНК к нужным клеткам обычно используют вирусы с записанной в них нужной ДНК, которую эти вирусы будут встраивать в клетки;
Ex vivo — ДНК клеток редактируется вне тела пациента. Например, берут его стволовые клетки, редактируют их геном, а после помещают обратно в организм, например, с помощью трансплантации костного мозга.
Для работы CRISPR нужно использовать специальные нуклеазы, ферменты — именно они будут «разрезать» ДНК и отвечать за редактирование. Обычно это Cas9, поэтому иногда технологию называют CRISPR-Cas9. Однако со временем находят более совершенные нуклеазы, способные еще точнее работать с цепью ДНК.
Альтернативы
CRISPR — одна из наиболее совершенных и популярных технологий, но не единственная. Применяются также:
Синтетические белки «цинковые пальцы» (ZFN), обладающие высокой точностью и нацеленностью на специфический участок ДНК. Они были разработаны раньше (в начале 2000-х) немецкими учеными. Эта технология сложнее и намного дороже;
TALENs — белки, которые можно использовать для редактирования последовательности ДНК. В сравнении с «цинковыми пальцами» они еще точнее и проще в использовании, что было показано в 2010 году. Они, как и «цинковые пальцы», требуют создания индивидуального белка для каждой последовательности ДНК — поэтому эти методы сложнее и дороже в сравнении с конструированием направляющих РНК, как при использовании CRISPR.
Еще существуют метануклеазы — они используют похожие на CRISPR ферменты, чтобы разрезать ДНК.
Все три метода — CRISPR, ZFNs и TALENs — обеспечивают полное и окончательное подавление функции гена. Кроме того, CRISPR может воздействовать на несколько участков ДНК одновременно, просто используя разные направляющие РНК.
История
У истоков генной терапии стоит множество ученых. Например, считается, что открытие, которое привело к созданию CRISPR, в начале 2000 годов совершил испанский микробиолог Франсиско Мохика.
Традиционная генная терапия
Основы генной терапии были заложены еще в 1960-х годах. Например, тогда впервые удалось внедрить ДНК в клетки человека, используя вирус для доставки. Сама концепция генной терапии была сформулирована в 1970-х годах. Тогда же она была предложена для медицинского применения.
Собственно, в данном случае вирусы — это палка о двух концах. Считается, что основные осложнения у пациентов возникают из-за использования вирусов для доставки. Если вирусы попадут не в то место, куда нужно, то могут запустить мощный иммунный ответ со всем букетом последствий и осложнений для организма. Поэтому редактирование ex vivo может быть более безопасным и совмещение генной терапии с клеточной развивается быстрее.
В 1989 году ученые считали, что в следующем году уже будет существовать полноценная генная терапия. Тогда нашли ген, вызывающий муковисцидоз (наследственное генетическое заболевание). Однако после 36 исследований с участием более 600 пациентов ни одно не показало устойчивого успеха. Эти провалы также связали со сложностями в доставке генов — при муковисцидозе вирусы просто не могли добраться до места, где должны были начать действовать, из-за слишком сложной и опасной для них среды.
В 1990 году была проведена успешная генная терапия 4-летнему ребенку. Это не решило проблему полностью, девочке пришлось пройти еще несколько курсов лечения, но стало значимым этапом развития технологии. Однако испытания не проходили без проблем. Многие участники заболевали раком или получали другие серьезные осложнения и даже умирали.
Серьезный спад произошел в 1999 году — от осложнений умер пациент, получивший экспериментальное лечение. Сейчас это связывают с его проблемами с печенью и теперь ее дисфункция становятся противопоказанием для получения терапии. Также дело могло быть в чрезмерной иммунной реакции на вирус.
Тем не менее, уже в 2003 году в Китае был выпущен первый коммерчески доступный генный препарат для лечения рака.
В нулевых и десятых появились альтернативные способы редактирования, а «цинковые пальцы» были использованы для лечения ВИЧ. Однако эти методы оставались дорогими, а генная терапия с использованием вирусов в принципе требовала постоянного лечения для достижения результата, а не одноразовой операции.
Развитие CRISPR
Прорывом стала полноценная разработка в 2012 году CRISPR-Cas9, который смог стать легко настраиваемым инструментом для редактирования, лишенным основных недостатков существующих на тот момент методов. CRISPR-Cas9 интересен тем, что его легко адаптировать к любой из тысяч потенциальных мишеней. Также этот вариант предсказуемее и безопаснее.

После открытия CRISPR развитие значительно ускорилось. Начались испытания нескольких способов клеточной терапии. Исследования терапии in vivo стартовали в 2019 году. Именно CRISPR позволило эффективно редактировать иммунные клетки для борьбы с раком. При этом такая терапия не ограничивается лечением генетических заболеваний и онкологии, а также может быть использована против ряда инфекционных заболеваний.
Пик развития генного редактирования пришелся на 2020 год. Дженнифер Дудна и Эммануэль Шарпантье получили тогда Нобелевскую премию именно за исследования CRISPR.
Недавно также были открыты новые нуклеазы Cas7-11, более точные и подходящие для терапии большего числа заболеваний. Также появились новые методы, которые не вызывают разрывов ДНК и потому более безопасны. Придумываются и новые методы доставки, в том числе с использованием нанотехнологий и модифицированных вирусов.
Совершенствуется и сам CRISPR. Осенью 2023 года сообщили о новом значимом прорыве, который делает технологию более точной и эффективной. Открытие сделали в Университете Коннектикута.
Использование
Использование CRISPR-Cas9 для генного редактирования признали «прорывом года» в 2015 году. Наибольшие дискуссии вызывает вопрос применения терапии для редактирования генома эмбрионов человека. В 2019 году одного китайского ученого приговорили к трем годам тюрьмы за использование CRISPR для редактирования эмбрионов человека.
Генное редактирование может применяться не только для лечения заболеваний, но и в других областях — в сельском хозяйстве как средство борьбы с вредителями.
Продление жизни
Генную терапию рассматривают как способ значительно продлить жизнь. С её помощью уже в 10 раз удалось увеличить продолжительность жизни некоторых видов червей. Однако при тестах на более высокоорганизованных организмах, в том числе млекопитающих, этот эффект снижался. Специалисты связывают это с тем, что млекопитающие прошли более длительную эволюцию, в ходе которой их ДНК и так стала обеспечивать более долгую жизнь, поэтому возможностей для дальнейшего редактирования меньше — часть работы уже проделала эволюция.
Одна из ключевых сложностей в том, что ДНК человека до сих пор недостаточно расшифрован, и находят все новую и новую информацию о генах, которые могут ускорять или замедлять старение. Например, в 2020 году была проанализирована база данных почти 2 млн человек с известной продолжительностью жизни, после чего было выявлено около 10 участков генома, сильно влияющих на продолжительность жизни. Многие из них связаны с сердечно-сосудистыми заболеваниями, а ранее считались общезначимыми. Также было отмечено, что продолжительности жизни способствуют гены, отвечающие за связанные с железом процессы и его уровнем в крови.
В 2022 году было опубликованы результаты еще одной работы: ученые из Тайваня открыли ген Cisd2, способный замедлять сердечные заболевания, дисфункцию мышц и другие признаки старения. В экспериментах с мышами его применение к уже «пожилым» животным привело к продлению их жизни на 9% в среднем и на 14% — максимально.
Продукты питания
В 2021 году в Японии впервые в мире началась продажа продукта питания, модифицированного с использованием CRISPR — это были помидоры. Применять к ним CRISPR для исследований начали в 2014 году. Также разработку стали использовать для изменения морепродуктов и рыбы. Один из видов рыб стал вырастать в два раза больше из-за снижения выработки контролирующего аппетит лептина. Еще один вид стал вырастать на 20% больше, но при том же количестве корма — ученые отключили подавляющий рост мышц миостатин.
Медицина
В медицине потенциальное использование генной терапии очень разнообразно. В феврале 2020 года было проведено успешное применение CRISPR для трех больных, страдающих от рака.
Также генная терапия может помочь в трансплантации органов, в том числе напечатанных на 3D-принтере. Можно добавить к ним выработку определенных белков, чтобы исключить отторжение трансплантата.
Пока что среди направлений использования CRISPR лидируют методы лечения заболеваний крови. Особенно успешными были испытания в этой сфере в 2022 году. Пытаются применять эту технологию и для лечения заболеваний головного мозга — например, эпилепсии. Вопрос в том, сколько нейронов будут изменены при поступлении лечения, а также в других особенностях и сложностях строения мозга, который опять-таки не так хорошо изучен, как хотелось бы ученым. Более того — при вмешательстве в эту область еще значимее становится потенциальный иммунный ответ.
В 2018 году в штате Огайо сделали операцию мальчику Уиллу, которому было пять лет и он страдал спинальной мышечной атрофией. Он и 83 других мальчика в результате смогли вырабатывать нужный им белок. В итоге Управление по контролю за продуктами питания и лекарствами США (FDA) одобрило такую терапию для детей 4-5 лет. Также FDA одобрило как минимум семь других методов генной терапии редких заболеваний.
В первые годы эффект был потрясающим, но позже здоровье Уилла снова начало ухудшаться. Проблема в том, что при повторном введении вирусов иммунный ответ может стать еще большей помехой, чем раньше — у мальчика выработался высокий уровень антител к вакцине. Он и еще 5 детей должны участвовать в клинических испытаниях, направленных на снижение этих антител.
FDA выдало в 2022 году разрешение на генную терапию редкого генетического заболевания ex vivo даже несмотря на то, что у трех участников испытаний развился рак. Терапия Skysona сопровождается предупреждением о риске развития рака.
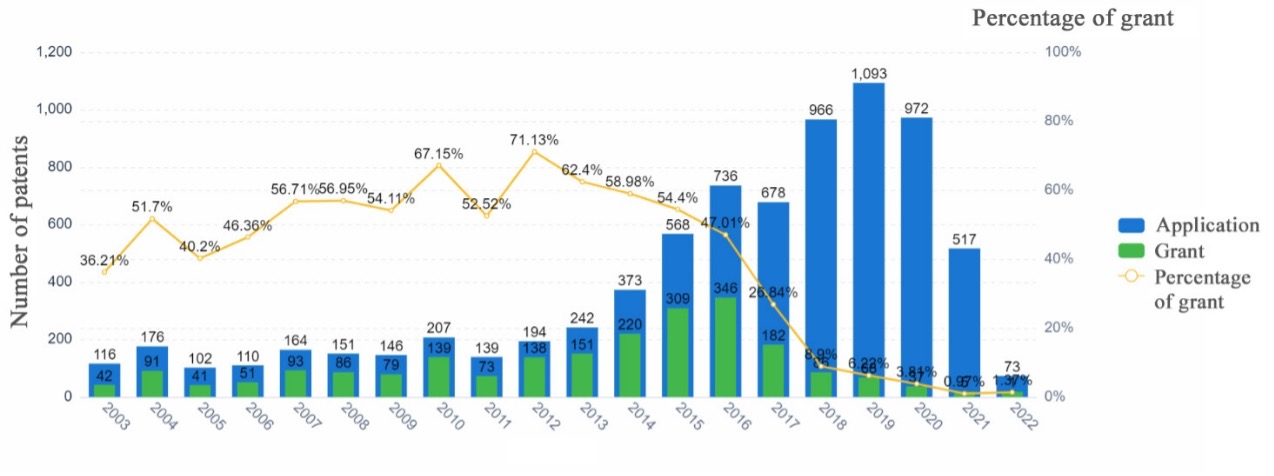
Патенты и споры
Много вокруг технологии и патентных споров. Например, спорят о правах на патенты Фэн Чжан, ученые из Института Броуда и Гарварда. Среди истцов есть даже те, кто уже получил за разработку Нобелевскую премию. Патентное ведомство США в 2022 году признало право на сохранение институтом Броуда основополагающих патентов на редактирование CRISPR-Cas9. В других странах ведомства пришли к другим выводам.
В 2014 году патентные права на CRISPR были оспорены. Разработками занималось несколько компаний, и постепенно встал вопрос о том, кто будет иметь право на монетизацию. В 2014 году Фэн Чжан из Института Брода и девять других ученых получили патент США №8697359 на использование редактирования генов CRISPR–Cas9. Им был отдан этот патент, так как по мнению судей институт Брода был первым, кто добился «практического применения».

Европейское патентное ведомство в 2017 году решило разрешить заявки на генетическое редактирование Институту Макса Планка, Калифорнийскому университету и Венскому университету, а позже и другим организациям, единого владельца технологии выделить сложно. Редактирование генов растений отнесли к созданию ГМО и его было решено регулировать соответствующим законодательством.
Проблемы и перспективы
Среди проблем CRISPR:
Возможность вызвать непреднамеренные изменения ДНК с соответствующими осложнениями;
При разрезании ДНК в неправильном месте возникают нецелевые эффекты;
Дороговизна процедур;
Продолжающиеся споры о подходящих способах доставки;
Вероятность того, что CRISPR будут использовать не по назначению (например, создавать «дизайнерских младенцев»);
Неизвестность долгосрочных последствий вмешательства;
Различные этические проблемы.
Большие надежды возлагают на разработку невирусных способов доставки, но для терапии in vivo. Разрабатывают «молекулярные грузовики» из липидов, белков и химических веществ, которые защищали бы генетический груз и транспортировали его туда, куда нужно. Это реализовано в частности при помощи наночастиц — как в вакцинах от COVID-19 производства Pfizer или Moderna.
Проблема исследований и коммерциализации методов для лечения редких заболеваний в низком спросе. Если в лекарстве от рака могут быть заинтересованы миллионы человек, то в лекарстве от редкого генетического заболевания могут быть заинтересованы меньше тысячи.
Например, Европейское агентство по лекарствам одобрило разработку на основе генной терапии от редкого заболевания производства Bluebird bio весной 2019 года. Однако на рынке этот продукт появился только в 2021 году, в том числе из-за попыток европейских властей повлиять на завышенную цену препарата. Так что помимо всех препятствий самым главным в случае лечения действительно редких заболеваний — вызывать у компаний интерес к запуску такого продукта.
Бывший комиссар FDA спрогнозировал, что к 2025 году организация будут одобрять 10-20 методов клеточной или генной терапии в год. Allied Market Research также прогнозировали, что к 2026 году отрасль достигнет 6,21 млрд долларов. Наиболее оптимальным пока что является направление генно-клеточной терапии, которое при использовании CRISPR достигло хороших показателей безопасности и эффективности.
P.S. Новогодний розыгрыш товарного знака под ключ и других призов в нашем Телеграм-канале
Полезное от Онлайн Патент:
→ Что такое Реестр отечественного ПО?
→ Может ли иностранная компания внести свою программу в Реестр отечественного ПО?
→ Как IT-компаниям сохранить нулевой НДС и попасть в Реестр отечественного ПО


gashka
8️⃣CRISPR-CAS это горячая тема, но изложение очень поверхностное, с массой неточностей/ошибок, начиная с «трансплантации СПИННОГО мозга» вместо «костного» с которым пересаживаются кроветворные стволовые клетки (может быть ОЧЕНЬ досадная опечатка, но маловероятно). И далее, практически нигде неясно о каких болезнях идёт речь, путаница с генной и клеточной терапией, in vivo и ex vivo (по-моему, ВСЕ успешные генные манипуляции с вирусным вектором при болезнях крови и иммунной системы сделаны EX-VIVO), связь случайной встройки вирусов с онкологическими заболеваниями, каким-то Джокером является иммуннитет, а это не так, выработка дополнительных белков для регуляции иммунной системы то ли при болезнях печени, то ли мозга (что это вообще?), и так без конца. Кстати, в конце большинство из 7 проблем дублируют только две: #1 непреднамеренные изменения генома и #6 неизвестность отдаленных последствий, но это - но это про любое лечение любой болезни. Кроме того, указание на дороговизну - неправильное, метод сравнительно доступен для воспроизведения в GCP лабораториях. Все это делает статью спутанной и крайне непрофессиональной. Возможно, если у автора достаточно skills ее можно было бы переписать.