 Уже давно бьют тревогу по поводу возникновения резистентных к антибиотикам штаммов бактерий, хотя некоторые серьёзные заболевания являются вирусными и также требуют скорейших мер по взятию их под контроль.
Уже давно бьют тревогу по поводу возникновения резистентных к антибиотикам штаммов бактерий, хотя некоторые серьёзные заболевания являются вирусными и также требуют скорейших мер по взятию их под контроль.К таким заболеваниям относятся, конечно, СПИД, вызываемый вирусами иммунодефицита человека, гепатит С, который, если его не лечить, во многих случаях может приводить к злокачественным новообразованиям печени и циррозу, герпес, грипп типа А, бешенство, геморрагическая лихорадка Эбола и некоторые другие.
Принципиальное отличие жизненнного цикла вируса от жизненного цикла бактерии заключается в том, что вирус — это облигатный внутриклеточный паразит. Фактически вирус вне клетки мёртв, так как не может ни размножаться, ни самостоятельно перемещаться, ни демонстировать каких-либо иных признаков жизни. Вся его жизнь, которая заключается исключительно в воспроизведении себе подобных, протекает только при попадании в вожделенное начало всех начал — клетку.
Безусловно, именно этот факт и определяет мишени фармакологического воздействия при вирусных заболеваниях.
В фармакологии инфекционных и паразитарных заболеваний (отчасти это справедливо и для случая злокачественных новообразований), существует 2 принципиально различных типа лекарственного воздействия. Одно из них направлено на модификацию макроорганизма-хозяина, то есть человека, с целью выработки устойчивости к инфекционному агенту или усиления защитных свойств организма. Классический пример — вакцинация. Второй тип лекарственного воздействия направлен на модификацию (ослабление, уничтожение) паразита, то есть патогенного агента. Классический пример этого типа – применение антибиотиков.
Меня, как химика, прежде всего интересует использование при вирусных заболеваниях так называемых малых молекул, которым и будет посвящена данная статья.
Так что же дают медицинскому химику, который занимается конструированием лекарственных средств, знания в области вирусологии? Прежде всего, они позволяют определить точки приложения лекарственной молекулы. Вот и пройдёмся по ним.
Представьте, что вы — попавший в организм вирус. Перед вами —
Но, как говорится, и вы не лышком шиты. А вирусной оболочкой, или капсидом.
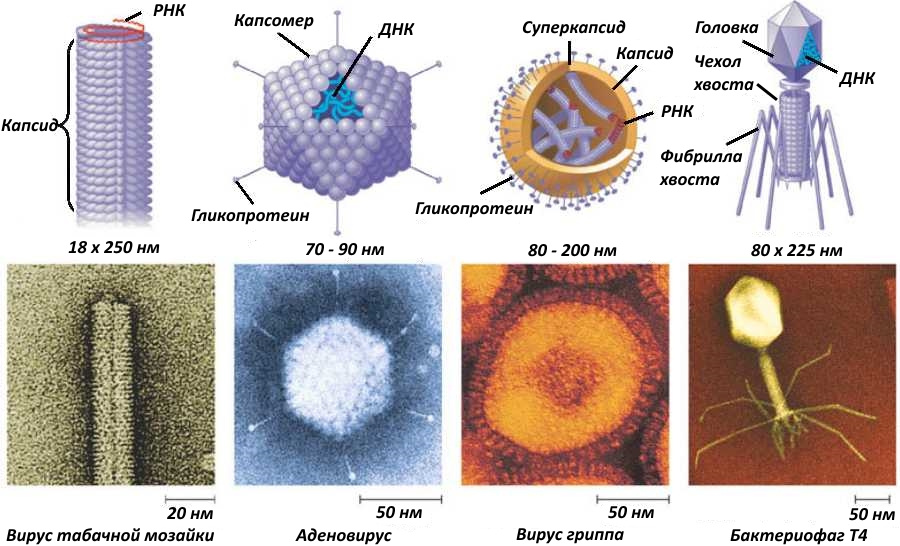
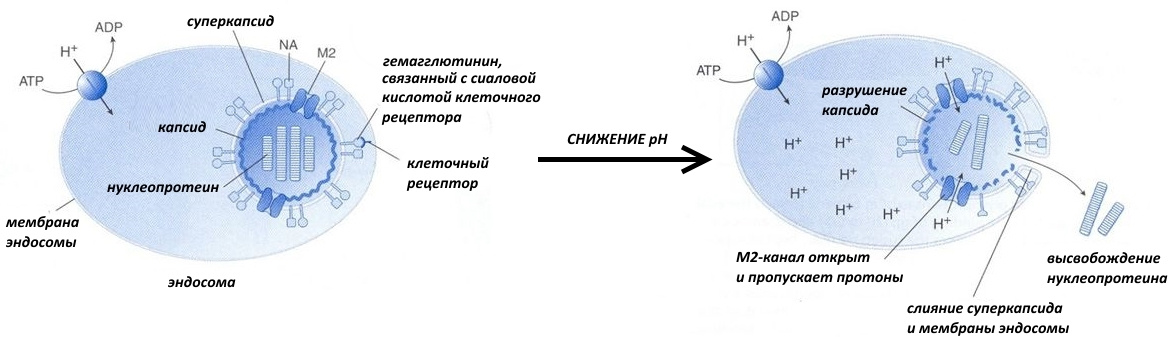
Хочу заметить, что капсид состоит из белков, но некоторые вирусы имеют и суперкапсид. Суперкапсид — это липидная оболочка, захваченная вирусом при выходе из клетки хозяина. Как она образуется у ВИЧ, можно посмотреть на рисунке ниже

В дальнейшем я буду писать «капсид», подразумевая в тех случаях, где речь идёт об оболочечных вирусах, что может быть и суперкапсид.
Капсид имеет на своей поверхности «отростки», чаще всего из гликопротеинов, которые связываются с каким-либо из многочисленых типов рецепторов, торчащих из клетки. Рецепторы эти, естественно, нужны вовсе не для проникновения вируса в клетку, а для получения сигналов извне для нормальной жизнедеятельности.
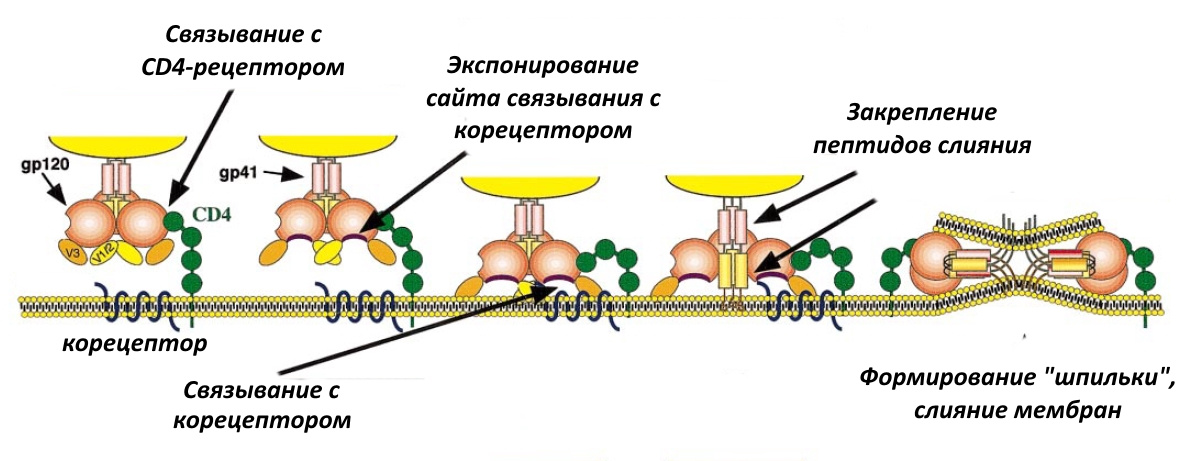
К примеру, если вы — ВИЧ, то облюбуете себе СD4-рецептор, который встречается на поверхности клеток иммунной системы (лимфоцитов, моноцитов, макрофагов, клеток Лангерганса, дендритных клеток), а также клеток микроглии — по сути, компонента иммунной системы головного и спинного мозга.
Если вы домосед, не хотите переезжать с места на место в шастающих туда-сюда клетках иммунной системы, то всегда можно одеться в личину вируса гепатита В или С. В первом случае к вашим услугам предоставляется натрий-зависимый транспортёр желчных кислот, открывающий уютные комфортабельные апартаменты гепацитов печени. В случае гепатита С, что, кстати, встречается в вирусном мире редко, для попадания в гостеприимный гепацит вирус использует несколько рецепторов.
Любителям
Короче, принцип понятен — выбираете курорт по своим предпочтениям, а дальше — дело техники.
Очевидно, что связывание частей капсида с рецепторами на поверхности клетки является слабым звеном вирусной агрессии и может быть использовано для фармакологической атаки. Следуя логике, можно предложить два подхода, каждый из которых имеет свои недостатки. Во-первых, можно заблокировать гликопротеин на поверхности вируса, а во-вторых — рецептор на поверхности клетки. Если пойти по второму пути, то мы рискуем нарушить нормальную жизнедеятельность: клетка перестанет получать сигналы извне и загнётся. А если это клетка иммунной системы, то можно потерять и весь макроорганизм. Кажется, что проще и безопаснее заблокировать вирусный гликопротеин. И это действительно так. Однако вирусы (особенно РНК-содержащие) очень сильно изменчивы, то есть быстро мутируют, поэтому созданный препарат может вскоре перестать работать. Отсюда, кстати, следует вывод о том, что мишенью для препарата должны стать наименее вариабельные (изменчивые) части капсида.
Теперь немножко примеров из клинической практики.
Существует 2 препарата, которые действуют на ВИЧ и препятствуют его попаданию в клетку. Первый, как это ни странно, использует химиотерапевтическую стратегию № 1, то есть модифицирует макроорганизм. Препарат называется маравирок и был разработан британским филиалом Pfizer в первой половине 2000-х. Механизм его действия такой. Чтобы проникнуть в клетку, ВИЧ использует не только CD4-рецептор, но и корецептор иммунных клеток, CCR5 (см. рис. выше). Маравирок изменяет пространственную структуру этого рецептора таким образом, что ВИЧ уже не в состоянии за него ухватиться и проникнуть в клетку.
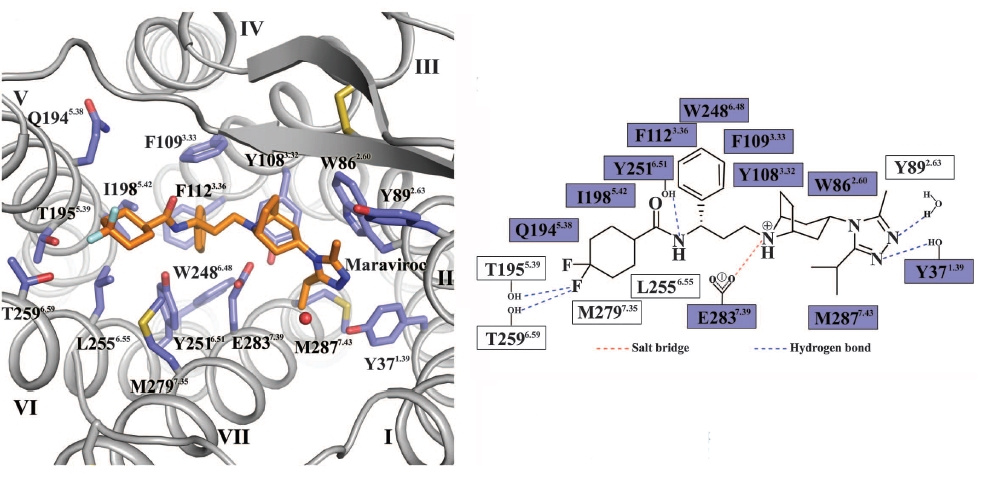
Обратите внимание, что молекула маравирока связывается с CCR5 как многочисленными водородными связями, так и электростатически.
Второй ингибитор слияния, как называют лекарства этого класса, энфувертид, не является классической малой молекулой, а представляет собой пептид — цепочку из из 36 аминокислот, первая из которых модифицирована остатком уксусной кислоты.

Она присоединяется к одному из гликопротеинов ВИЧ и блокирует его работу по внедрению частиц вируса в клетку на последнем этапе проникновения, когда происходит объединение суперкапсида (ВИЧ является оболочечным вирусом) и мембраны клетки. Весьма наглядно это показано в следующем ролике:
В разработке находятся ещё несколько лекарств из класса ингибиторов слияния, предназначенных для терапии ВИЧ и гепатитов. Посмотрим, насколько это направление окажется перспективным.
Продолжим.
Итак, на ресепшене вам дали ключи, и вы широко распахнули ворота клетки, призывно манящей своим содержимым. Что дальше?
Часть вирусов, и среди них ВИЧ, попадает после проникновения в клетку напрямую в цитоплазму, покинув остатки суперкапсида на поверхности цитоплазматической мембраны. Другие вирусы проделывают более сложный путь.
Так, связавшись гликопротеинами с клеточными рецепторами, вирус может попасть в клетку путём эндоцитоза, то есть вместе с выпячиваниями клеточной мембраны, формирующими пузырьки-эндосомы.
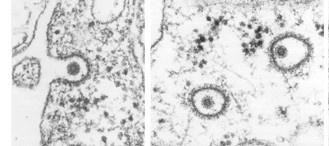
Со временем содержимое эндосомы закисляется, то есть его рН понижается. И тут вам за несколько сотен тысяч лет эволюции надо было успеть подсуетиться, а не щёлкать капсидом. К примеру, вирус гриппа создал специальный М2-белок.
Он представляет собой канал, по которому внутрь вирусной частицы устремляются протоны. В результате происходят следующие события:
— электростатическое взаимодействие между капсидом и нуклеопротеином (комплексом нуклеиновых кислот и белков) ослабляется, и они отсоединяются друг от друга;
— пептиды слияния встраиваются в стенку эндосомы, содержимое суперкапсида и цитоплазмы объединяется.
Таким вот образом в цитоплазму клетки попадает основная «рабочая» часть вируса, которая впоследствии захватывает весь свой гостиничный номер, — нуклеиновая кислота.
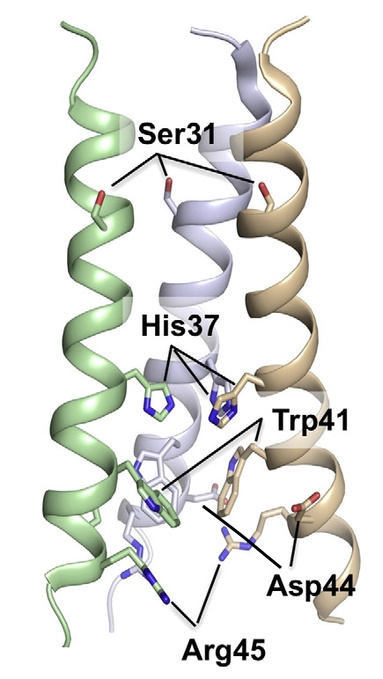
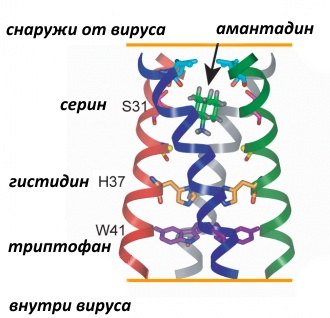
же есть. M2-белок представляет собой тетрамер, то есть состоит из 4 субъединиц и имеет 3 функциональных части. Трансмембранный сегмент образует проницаемый для протонов канал, а С- и N-концевые сегменты удерживают тетрамеры, чтобы те не «разъехались» при открывании канала.
Внутрь канала обращены остатки аминокислот гистидина (His37 или H37) и триптофана (Trp41 или W41), которые, как полагают, играют ключевую роль в обеспечении его протонной проводимости.
При физиологических значениях рН только 2 из 4 гистидиновых остатков протонированы, их имидазольные части находятся почти перпендикулярно ?-спиралям тетрамеров.
Остатки триптофана также перпендикулярны ?-спиралам. В таком положении им помогают удерживаться водородные связи пиррольных колец с остатками аспарагиновой кислоты.
При закислении содержимого эндосомы происходит дополнительное протонирование 1 или 2 остатков гистидина, силы электростатического отталкивания начинают превосходить
силы водородных связей, имидазольные фрагменты выходят из плоскости, перпендикулярной каналу, и открывают его для протонов.

Далее происходит поворот остатков триптофана в сторону протонированного имидазола по причине образования ?-комплекса с его бензольной частью. Таким образом, триптофановые остатки также выходят из плоскости, их водородная связь с остатками аспарагиновой кислоты разрывается, в результате чего протон проходит по образовавшемуся каналу далее вглубь вириона. Вуаля!

Итак, очевидно, что мы снова имеем болевую точку — раздевание капсида вируса гриппа при закислении эндосом. И этим грех не воспользоваться.
Заблокировать М2-белковый протонный канал можно с помощью знакомого вам римантадина, который получил широкое распространение в странах бывшего СССР, и амантадина, более известного в США.
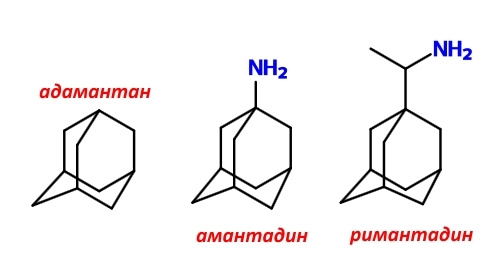
Эти соединения одновременно содержат фрагменты каркасного углеводорода адамантана, которые могут выступать заглушкой канала, образованного M2-белком, а также аминогруппы, которые позволяют удерживаться водородными и/или электростатическими связями (после протонирования) с соответствующими аминокислотными остатками.
Отличительной чертой многих РНК-вирусов, к которым принадлежит и вирус гриппа А, является высокая частота мутаций. Если вы помните, так называемый свиной грипп H1N1, который пришёл из Мексики в 2009 и уже давно стал частью циркулирующих сезонных вирусов, устойчив к производным адамантана из-за мутаций в трансмембранном сегменте белка M2. Так что более назначение этих лекарств при гриппе не рекомендуется.
В настоящее время ведутся разработки соединений, который бы могли затыкать или иным образом нарушать работу М2-канала у мутировавших штаммов вирусов, однако, несмотря на обилие публикаций, о клинических испытаниях подобного рода соединений мне не известно.
Продолжение следует.
Вопросы для самоконтроля. Ну первое сентября же!
1. Почему вирусы растений не имеют суперкапсида?
2. Какие преимущества даёт вирусу возможность связывания с несколькими рецепторами?
3. Известно, что ВИЧ-1 может связываться с 2 корецепторами: CCR5 и СXCR4. Как этот факт может сказаться на эффективности препарата маравирок?
4. Каким образом может сказаться на эффективности препарата маравирок замена в его молекуле 2 атомов фтора на 2 атома хлора? Поясните свой ответ.
5. Энфувертид вводится в организм человека только инъекционно. Как, по-вашему, с чем это связано?
6. В литературе встречается следующее неправильное объяснение механизма действия римантадина и амантадина: указывается, что эти препараты блокируют
закисление эндосом, поскольку являются веществами основной природы (аминами). Какой описанный в статье экспериментальный факт опровергает такое объяснение?
7. Какую модификацию молекул ремантадина и амантадина вы бы предложили провести, чтобы их производные смогли действовать на S31N мутанты?
Комментарии (29)

pvsur
01.09.2017 17:01+1Вопросы для самоконтроля. Ну первое сентября же!
1. Почему растительные вирусы не имеют суперкапсида?
эээ… А что есть и такие? Они, наверное, зеленые и с листочками! :))

potan
01.09.2017 19:15+1А можно заблокировать гликопротеин на поверхности вируса используя модификированную версию клеточного рецептора, переделанному в внемембранный белок? Тогда вирус не сможет адаптироваться к этой ловушки не потеряв способность связываться со своей мишенью.

superhimik Автор
01.09.2017 19:30Идея интересная, конечно, но я сходу вижу 2 но.
1) Этот модифицированный рецептор может связываться со своим эндогенным, т.е. природным, натуральным, лигандом, и будет бо-бо.
2) Вирусы жутко адаптивные. Их репликационный аппарат эволюционно настроен на ошибки — это их козырь. Поэтому полегоньку, потихоньку, но отбор всё же будет идти.
Ну и плюс, конечно, всякие технические сложности, связанные с готовой формой.

raid
02.09.2017 01:111) У растений есть клеточная стенка из целлюлозы. Видимо, вирусы по каким-то причинам не могут завернуться в целлюлозу. Может быть, с таким суперкапсидом было бы сложно проникать в другие клетки?
2) Большая вероятность прицепиться к данной клетке?
3) Маравирок блокирует только один рецептор, а другой остаётся открытым для атаки.
5) Энфувертид — пептид, поэтому в желудке бы он переварился и разложился на аминокислоты.
6) Вирусы с мутациями M2-белка невосприимчивы к ремантадину и амантадину.

Dmitri-D
02.09.2017 03:53у растений нет имунной системы

superhimik Автор
02.09.2017 04:09Иммунной системы нет, а иммунитет есть! :)

Dmitri-D
02.09.2017 04:23+1вырабатывают химию — типа энзимов, антибиотиков и прочие способы, прописанные в геноме, но и только. В общем наш пабмед www.ncbi.nlm.nih.gov/pubmed/?term=plant+immunity к вашим услугам

superhimik Автор
02.09.2017 04:26Спасибо, я о вирусах растений читал, когда ещё пабмеда не существовало. И интернета тоже.

Avior133
02.09.2017 03:58А есть подобные иллюстрации «принципа работы» вируса бешенства?

superhimik Автор
02.09.2017 04:10что именно вас интересует?

Avior133
02.09.2017 16:28+1Прежде чем задавать вопросы, хочу сделать ремарку — биологического образования не имею, если вопросы покажутся бредом — извините. Буду очень благодарен, если подскажете, где поискать более подробную информацию по ним.
Собственно вопросы:
— Интересует механизм проникновения вируса в нейрон (согласно теории, на основе которой был создан протокол Милуоки — активность нейронов в заражённом нерве способствует более быстрой передаче вируса, при вводе пациента в кому скорость распространения вируса снижалась).
— Причины, по которым вирус не распространяется, скажем, с кровью по организму, а движется вверх по отдельно взятому нерву (иммунная система, насколько я понимаю, здесь не причем, т.к. вирус она не распознаёт и не препятствует заражению нейронов. После ввода вакцины и «обучения» иммунной системы она эффективно уничтожает вирус даже в поражённом нерве)
— Как именно происходит уничтожение вируса бешенства в вакцинированном организме — в момент передачи от клетки к клетке, или путём апоптоза поражённых нейронов?
— Есть ли различие в поведении вируса по отношению к нейронам головного мозга и периферической нервной системы? Если да — то как вирус определяет, где именно находится?
— Почему до сих пор отсутствует лечение бешенства на терминальной стадии, когда вирус проникает в мозг? Есть какое-то принципиальное ограничение, далеющее невозможным создание подобного противовирусного препарата, или просто никто не заморачивался по этому поводу?
superhimik Автор
02.09.2017 16:38— Интересует механизм проникновения вируса в нейрон (согласно теории, на основе которой был создан протокол Милуоки — активность нейронов в заражённом нерве способствует более быстрой передаче вируса, при вводе пациента в кому — скорость распространения вируса снижается).
Выглядит логичным. При нейрональной активности происходит выброс нейромедиаторов в везикулах. Вполне вероятно, что в них могут быть вирусы.
— Причины, по которым вирус не распространяется, скажем, с кровью по организму, а движется вверх по отдельно взятому нерву (иммунная система, насколько я понимаю, здесь не причем, т.к. вирус она не распознаёт и не препятствует заражению нейронов. После ввода вакцины и «обучения» иммунной системы она эффективно уничтожает вирус даже в поражённом нерве)
Этого я не знаю. Но если вирус распространяется по нейронам, то у него, в конечном итоге, все пути ведут в мозг. Просто нет вариантов. Ну и он влияет на поведение животных, чтобы те начали заражать других, так как путь передачи весьма специфичен — с укусом.
— Как именно происходит уничтожение вируса бешенства в вакцинированном организме — в момент передачи от клетки к клетке, или путём апоптоза поражённых нейронов?
Не знаю точно, но думаю, что первым способом.
— Есть ли различие в поведении вируса по отношению к нейронам головного мозга и периферической нервной системы? Если да — то как вирус определяет, где именно находится?
Думаю, что никак не определяет — летит от отного синапса к другому, в конце концов долетает до мозга.
— Почему до сих пор отсутствует лечение бешенства на терминальной стадии, когда вирус проникает в мозг? Есть какое-то принципиальное ограничение, далеющее невозможным создание подобного противовирусного препарата, или просто никто не заморачивался?
Принципиальное ограничение (если они принципиальное — я не знаю), я думаю, связано с мишенью — нейроном. Если клетка заражена, то вряд ли она будет жить. Можно только попробовать предотвратить заражение соседних. А когда нейронов гибнет очень много, то сами понимаете.
Вопросы очень дельные и интересные. К сожалению, я, химик, ответить не могу. Советую, во первых, для общего ознакомления, почитать учебники по инфекционным заболеваниями. Эта болезнь достаточно хорошо изучена и описана. Далее двигайтесь в стороны специализированных монографий сначала на русском, а как освоите терминологию — на английском. Ну а потом можно читать свежечёк на пабмеде.
Avior133
02.09.2017 16:42Спасибо за ответы!

superhimik Автор
02.09.2017 17:09+3Спасибо за идею: наверное, напишу о Милуокском протоколе с фармакологической точки зрения. ))
PerlPower
03.09.2017 04:37Далее двигайтесь в стороны специализированных монографий сначала на русском, а как освоите терминологию — на английском.
Как и где такое искать? Разве что только на развалах видел советские книги, где человек посвящал целую книгу какой-то узкой области науки или инженерного дела. Сейчас такое еще осталось или все перешли к формату публикаций?
superhimik Автор
03.09.2017 06:52во-первых, никто не отменял библиотеки. во вторых, есть гугл. мне вчера самому стало интересно, и вот что я нашёл сходу www.belriem.by/about/publications см п. 6, 9. Естественно, сейчас это осталось. Но кто вам сказал, что это должен обязательно писать 1 человек? есть такое понятие, как коллектив авторов

superhimik Автор
02.09.2017 16:44кстати, о протоколе Милуоки. Мне до сих пор неясно, почему они не использовали рифампицин. он хорошо проникает через ГЭБ и обладает активностью в отношении вируса бешенства. может, потому, что об этом открытии белорусских учёных не знали ))

rrrad
02.09.2017 03:58- У клетор растений клеточная стенка состоит из многих слоёв целлюлозы.
- Больше целей для поражения — больше вероятности попасть в клетку.
- Если связывание с рецепторами идёт через разные группы, то заблокировав одну группу, мы не предотвратил заражение, см. ответ 2.
- ГМ… У меня 2 варианта: либо будут пространственные проблемы (хлор покрупнее), либо из-за меньшей энергии связи OH… ClC по сравнению с хлором (фтор ещё трёхцентровую ковалентную связь может образовывать, например в HF2-).
- Такая большая молекула в исходном виде никогда не попадёт в кровь через ЖКТ.
- Собственно, потеря эффективности когда они не способны блокировать канал в мутантных вирусах.
- Обвешать адамантан заместителями, но тут главное не переборщить с размером. Мб. вместо этого втиснуть лишнюю CH2-группу в разрыв в пару адамнтановых цикла (правда, это достаточно дорого обойдётся).

iBat
02.09.2017 04:34+1Интересно как такие штуки, как вирусы, вообще смогли когда-то появиться и выжить. На начальном этапе, не набрав необходимой критической численности и необходимых свойств, они были очень уязвимы в том плане, что могли либо убить всех подходящих хозяев, либо у хозяев могла выработаться защита, которая бы остановила оный вирус.

superhimik Автор
02.09.2017 05:06Согласен, вопрос интересный. Но, к сожалению, вне сферы моей компетенции — я химик, а не биолог, поэтому таких нюансов не знаю :(

uterr
02.09.2017 10:27есть несколько гипотез происхождения вирусов, одна из них — что вирусы раньше также были клетками, которые постепенно утратили, собственно свойства клеток, и произошло это не в один момент, так что если эта теория верна, то у вирусов было много времени, чтобы пройти описанный вами начальный этап

REALpredatoR
05.09.2017 19:59Ждём разработку «нанитов», которые будут циркулировать в крови, и отлавливать вирусы. У вас в крови вирус-мутант? Просто сдайте анализ, и залейте в «нанитов» новую прошивку, с сигнатурами нового вируса ;)


Hellsy22
Если я правильно помню школьную химию, то связи, образуемые хлором, при прочих равных слабее, чем связи, образуемые фтором. Вероятно молекула будет закрепляться хуже. Как это скажется на эффективности я могу лишь гадать — может быть появится больше удачных вариантов ее размещения, а может быть она вообще не сможет встать там, где надо.
superhimik Автор
Я не буду пока отвечать на вопрос, но скажу, что ваше исходное предположение в общем случае неверно. Прочность связи зависит от того, с каким атомом образует её атом галогена. К примеру, ионы серебра и ртути (II) не дают прочных комплексов с ионами фтора, а с ионами хлора — дают.
Hellsy22
Ох, тогда вот еще одно, скорее всего неверное предположение — хлор принимает активное участие в обмене веществ, быть может замена фтора на хлор приведет к тому, что молекула прицепится к чему-то, к чему цепляться не должна?
Насчет первого вопроса. У растительной клетки помимо мембраны есть еще и клеточная оболочка, возможно суперкапсиды не могут ее преодолеть.