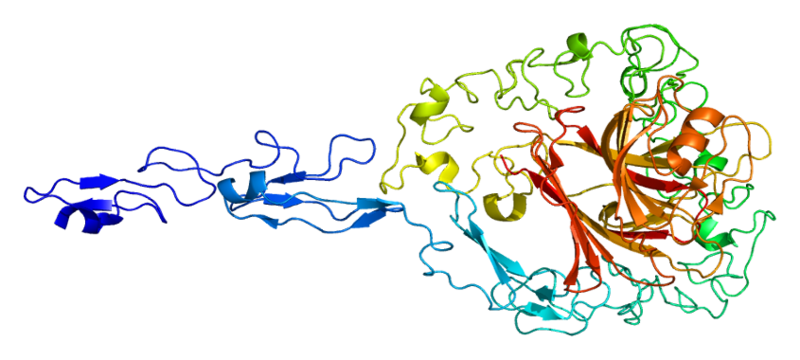
Структура белка Тромбоспондин-2
В конце июля этого года вышло большое исследование международной группы исследователей, посвящённое поиску эффективных биомаркеров старения в рамках концепции frailty (хрупкости, или старческой астении).
Сам термин «frailty» был введён в научный оборот J.H. Friend в далёком 1954 году, впервые прозвучав в статье Science “Alas for Human Frailties!”. Само понятие frailty сегодня определяется как наличие у пожилого человека таких признаков: потеря веса (саркопения), доказанное динамометрически снижение силы кисти, выраженная слабость и повышенная утомляемость, снижение скорости передвижения, значительное снижение физической активности. Принято считать, что frailty (старческая астения) имеет место при наличии трех и более симптомов, если же симптомов один или два — то это старческая преастения.
Федеральный совет по проблемам старения (The Federal Council on Aging) Соединенных Штатов Америки ввел термин “frailty” для специальной группы пожилых людей со «значительными физическими, когнитивными и эмоциональными нарушениями, нуждающихся в дополнительном внимании». По современным оценкам, количество пожилых людей, которых можно отнести к категории frailty, составляет сегодня 12,9%, старческой преастении — 48,9%, которая при отсутствии адекватных мер лечения и реабилитации переходит в развернутую форму в течение 4–5 лет.
Авторы данного исследования определяют frailty как «основной фенотип ускоренного старения, описывающий мультиорганную дисфункцию или мультиморбидность (то есть наличие 2 хронических заболеваний и более, этиологически и патогенетически не связанных между собой) вместе с повышенной уязвимостью к дополнительным заболеваниям у пожилых людей».
В качестве основы своей работы учёные использовали базы данных экспрессии генов (http://genomics.senescence.info/genes, включая GenAge, AnAge, LongevityMap, CellAge, DrugAge, Digital Aging Atlas) для идентификации генов, регулируемых в процессе старения, долголетия и связанных с возрастом заболеваний. При этом они уделили особое внимание секретируемым факторам и молекулам, обнаруживаемым в биологических жидкостях в качестве потенциальных биомаркеров.
На первом этапе работы были идентифицированы факторы, широко выраженные и связанные с несколькими путями «отличительных признаков старения», а также уже используемые как биомаркеры при диагностике возрастных патологий. Затем этот набор биомаркеров был расширен в соответствии с опытом авторов исследования.
Поиск биомаркеров был проведён по шести направлениям, шести «признакам старения»:
1. Воспаление
2. Митохондрии и апоптоз
3. Гомеостаз кальция,
4. Фиброз
5. NMJ (нервно-мышечное соединение) и нейроны
6. Цитоскелет и гормоны.
Было проанализировано 44 потенциальных биомаркера, из которых 19 получили высокий приоритетный бал, 22 были определены как средний приоритет.
В итоге исследователи определили основную и расширенную панель биомаркеров frailty, состоящую из шести пунктов.
1. Воспаление. Общие изменения в иммунной системе, влияющие как на адаптивные, так и на врожденные иммунные ответы, стали одним из наиболее важных «признаков старения», а иммунологические факторы были среди первых маркеров, описанных для старческой астении. Процесс старения тесно связан с системным увеличением провоспалительных медиаторов различной природы. Это увеличение может быть или напрямую связано с устойчивым воздействием инфекционных агентов на протяжении всей жизни, или возрастными изменениями микробиоты кишечника.
Причиной этому может быть и метаболическая дисфункция, наблюдаемая при ожирении, а также секреция антигенов, вызванная гибелью клеток и последующим накоплением клеточного мусора. В целом, воспаление приводит к хронической стимуляции иммунных клеток, которые переходят в низкосортное и долговременное воспаление, которое влияет как на врожденные, так и на адаптивные иммунные ответы.
Кроме того, старение приводит к заметным изменениям фенотипов и функций иммунных клеток. В целом этот фенотип, называемый «иммуногенность», способствует накоплению клеточного и молекулярного повреждения в тканях старения, потенцирует многие возрастные расстройства (например, атеросклероз, диабет и нейродегенеративные заболевания) и, самое главное, уменьшает эффективный ответ на инфекции, рак и другие повреждение тканей.
В связи с воспалением были определены следующие биомаркеры:
- CD14 антиген. Это гликопротеин, который экспрессируется в основном моноцитами и макрофагами. В составе комплекса TLR 4 – CD14 он принимает участие в иммунном ответе организма — связывании бактериальных липополисахаридов.
- Фракталкин (CX3CL1). Фракталкин продуцируется более всего в активированных эндотелиальных клетках, гладкомышечных клетках и макрофагах. Он усиливает миграцию лейкоцитов из кровеносного русла в ткани за счет повышения селектин-опосредованного связывания, вызывая адгезию и, в конечном итоге, миграцию лейкоцитов через эндотелиальный слой. Также CX3CL1 обладает антиапоптическими свойствами.
- Пентраксин (PTX3). Пентраксин действует как компонент гуморального врожденного иммунитета и индуцируется различными воспалительными цитокинами в лейкоцитах периферической крови и миелоидными дендритными клетками.
Пентраксин также секретируется эндотелиальными клетками, сосудистыми гладкомышечными клетками, фибробластами и адипоцитами, способствуя дифференциации фиброцитов и играя роль в ангиогенезе и ремоделировании тканей. - Молекулы адгезии sVCAM/sICAM (молекула межклеточной адгезии 1-го типа, молекула адгезии сосудистого эндотелия 1-го типа). Относятся к суперсемейству иммуноголобулинов. ICAM-1 экспрессируется на эпителиальных и дендритных клетках, фибробластах, тканевых макрофагах, а VCAM-1 — на тканевых макрофагах, дендритных клетках, фибробластах костной ткани, миобластах и мышечных волокнах.
- Интерлейкин 6 (IL-6). Является одним из важнейших медиаторов острой фазы воспаления. Экспрессируется в различных тканях, включая скелетную мышцу, мочевой пузырь, желчный пузырь, аппендикс, пищевод, костный мозг, легкие, надпочечники, простату и жировые ткани. IL-6 в основном продуцируется на участках воспаления и индуцирует транскрипционный воспалительный ответ через IL-6RA (рецептор IL-6 — альфа).
- Интерферон ? индуцибельный белок (IP-10), другое обозначение — CXCL10 C-X-C motif chemokine 10. Представляет собой IFN-индуцируемый хемокин подсемейства CXC и лиганд для рецептора CXCR3, который в основном экспрессируется активированными Т-лимфоцитами и фибробластами.
Связывание CXCL10 с CXCR3 приводит к миграции Т-клеток, к стимуляции моноцитов и NK-клеток, а также к модуляции экспрессии молекулы адгезии и индукции апоптоза
2. Митохондрии и апоптоз. Митохондрии играют центральную роль в производстве АТФ, а также в снижении базальной скорости метаболизма и физической работоспособности. Зависимые от возраста нарушения функции митохондрий включает снижение скорости передачи электронов, повышенную проницаемость по отношению к H+ внутренней мембраны, и нарушение синтеза АТФ.
Кроме того, митохондриальные мутации ДНК накапливаются в процессе старения. Все клетки, особенно нейроны и мышечные клетки, очень чувствительны к митохондриальной дисфункции, связанной с окислительным повреждением, так как большие количества АТФ необходимы для поддержания нейрональных процессов и сократительной функции.
В связи с митоходриальной дисфункцией были выделены следующие биомаркеры:
- Фактор дифференциации роста-15 (growth differentiation factor 15, GDF15). Плейотропный цитокин, белок из суперсемейства трансформирующего ростового фактора-бета. Задействован в воспалительном ответе и регуляции апоптоза при повреждении и во время различных патологических процессов.
- Иризин (fibronectin type III domain containing 5, FNDC5). Мембранный белок, являющийся предшественником пептидного гормона иризина. Позитивно регулирует дифференцировку бурого жира, способствует митохондриальному биогенезу, сохраняет функцию митохондрий в условиях гипоксии, защищает от апоптоза и имеет противовоспалительную активность.
- Виментин (VIM). Белок, играющий важную роль в поддержании целостности клетки. Задействован в процессах апоптоза.
- Гомеостаз кальция. Кальций играет важную роль во многих физиологических и патофизиологических процессах, внеклеточно и внутриклеточно. Физиологические уровни кальция имеют довольно узкие границы, и даже небольшие изменения могут привести к огромным дисфункции.
Кальций всасывается в кишечнике, выводится из организма через почки и его уровни в основном регулируются паратиреоидными гормонами. Кальций в основном находится в мышцах, сердце и кости. В пределах клетки, эндоплазматический ретикулум (ЭР) и митохондрии являются основным хранения и при гомеостатических условиях относительно низкие концентрации кальция присутствуют в цитоплазме.
Жизнеспособность клеток и активность большого количества ферментов зависят кальций. Таким образом, не удивительно, что нарушения гомеостаза кальция связано с дисфункциями органов, старостью и со многими болезнями.
Здесь были выделены следующие биомаркеры:
- S100 кальций-связывающий белок B (S100 calcium binding protein B, S100B). Принадлежит к группе кальций-связывающих белков S100, производится в глиальных клетках, преимущественно астроцитах, а также в адипоцитах. Участвует во внутриклеточных и внеклеточных передачах сигналов кальция. S100B участвует в регуляции ряда клеточных процессов, таких как прогрессия клеточного цикла и дифференцировка.
- Регукальцин (Regucalcin, RGN). Известен также как маркер старения protein-30 (senescence marker protein-30, SMP30). Преимущественно экспрессируется в печени и почках. Играет важную роль в гомеостазе кальция, задействован в индуцированном кальцием окислительном стрессе.
- Кальретикулин (Calreticulin, CALR). Многофункциональный белок, который связывает ионы Ca 2+. Действует в митохондриях, на поверхности проапоптотических клеток и в эндоплазматическом ретикулуме, где он связывается с неправильно свернутыми белками для предотвращения их экспорта. Имеет ряд функций в апоптозе и в иммунном ответе.
- Фиброз. Фиброз — процесс формирования фиброзной ткани, который может быть частью нормального процесса при заживлениях ран после травмы. Вместе с этим, фиброзная ткань может также заменять на постоянной основе функциональные ткани в результате старения.
В результате фиброзные ткани накапливаются в таких органах, как сердце, легкие, почки, печень и препятствуют нормальной функции органов. Это приводит к гиперпролиферации и усиленному воспаления в связи с наличием различных воспалительных клеток (нейтрофилов и макрофагов).
Кроме того, неконтролируемая активность протеазы мешает нормальным механизмы репарации, и это может привести к увеличению фиброзной ткани. Многие цитокины, такие как IL-13 (интерлейкин 13), IL-21 (интерлейкин-21), TGF-beta, и хемокины, такие как МСР-1 и MIP-1 & beta, вовлечены в фиброз.
Кроме того, ангиогенные факторы (например, VEGF (сосудистый эндотелиальный фактор роста)), факторы роста (например, PDGF (тромбоцитарный фактор роста)) и компоненты системы ренин-ангиотензин-альдостерон были идентифицированы в качестве важных регуляторов фиброза и исследуются в качестве потенциальных мишеней анти-фиброзных препаратов.
В связи с фиброзом были выделены следующие биомаркеры:
- Трансформирующий ростовой фактор бета (TGF-beta). Белок, контролирующий пролиферацию, клеточную дифференцировку и другие функции в большинстве клеток. Представитель цитокинов, участвует в иммунном ответе, раке, сердечно-сосудистых заболеваниях, сахарном диабете и многих других патологиях.
- Ингибитор активатора плазминогена 1 (PAI-1 или Serpine E1). Ингибирует работу тканевого активатора плазминогена и урокиназы, которые в свою очередь активируют переход плазминогена в плазмин, расщепляющий фибрин тромбов. Таким образом, PAI-1 негативно воздействует на фибринолиз и препятствует растворению тромбов, что повышает риск сосудистых осложнений, различных тромбоэмболий.
- Урокиназный активатор плазминогена (urokinase plasminogen activator, uPA). Представляет собой секретируемую серин-протеазу, которая превращает плазминоген в плазмин. Функционально связан с описанным выше ингибитором активатора плазминогена 1. Активация плазмина вызывает протеолитический каскад, который, в зависимости от физиологической среды, участвует в тромболизе или деградации внеклеточного матрикса. Этот каскад вовлечен в сосудистые заболевания и прогрессирование рака.
- Матрилизин, матриксная металлопротеиназа-7 (MMP-7). MMP-7 экспрессируется в различных органах и тканях, в том числе в печени, легких, сердце, молочной железе, селезенке, головном мозге, спинном мозге и гипофизе. Функции ММР-7 тесно связаны с такими процессами, как морфогенез, ангиогенез и восстановление тканей. Дисрегуляция его действия связана с фиброзом, производством воспалительных цитокинов и эндокринными дисбалансами. Задействован в ряде патологий, таких, как цирроз печени, ревматоидный артрит и рак.
- Трансглютаминаза 2 (TGM2). Является наиболее широко распространенным член семейства трансглютаминаз и экспрессируется в разной степени в почти всех типах клеток. Играет модулирующую роль в развитии нервной системы, а также регуляторное влияние на гибель нейрональных клеток. Вовлечен в различные патофизиологические процессы, такие как заживление ран, рост и выживаемость клеток, апоптоз и аутофагия.
- Тромбоспондин-2 (THBS2). Часть семейства белков-тромбоспондинов, присутствует в различных тканях, таких, как эпителий и эндотелий, соединительная ткань. Он активирует латентный TGF-beta и играет важную роль в регуляции клеточной пролиферации, апоптоза и ангиогенеза.
- Ангиотензиноген (angiotensinogen, AGT). Предшественник ангиотензина, производится в печени и превращается в ангиотензин I под действием ренина. Уровни ангиотензиногена повышаются под действием плазменных кортикостероидов, эстрогена, тиреоидного гормона и ангиотензина II. Играет ключевую роль в регуляции системного артериального давления, сужения сосудов, потребления воды и удержания натрия, в провоспалительных, протромботических и профиброзных процессах.
Ангиотензин I и II
Комментарии (12)

arielf
11.08.2018 01:47SENS — именно омолаживающие биотехнологии, ибо они устраняют причины старения и уменьшают уровни молекулярных и клеточных повреждений, возвращая организм в прежнее, более здоровое и юное состояние. Ежели человеку 60, а уровни повреждений и структура мышц и прочих тканей как в 30, значит ему биологически 30. Вот и всё.

c0f04
11.08.2018 10:14-1Специально для этого есть термин — пренебрежимое старение. Именно он входит в расшифровку SENS. Если человек начнёт в 60 регулярно принимать препараты, убирающие сопутствующие старению факторы, он не станет от этого выглядеть и чувствовать себя на 30 лет. Он просто в 80 будет чувствовать себя на все 60.
Причины старение при этом не устраняются. Устраняются симптомы. Не путайте.


1Fedor
И как узнать состояние своего здоровья?
Сдать анализ в Инвитро?
arielf
Лучше пожертвуйте в SENS! ;-) Узнав о хроническом вопалении, вы ничего принципиально не измените — ибо его причины ещё не лечатся. А финансируя омолаживающие биотехнологии, вы помогаете в инженерии реальной терапии.

bioxakep
Тут стоило бы пояснить подробнее читателям Хабра, что это за график и почему он достоин внимания.
Речь о проценте выживаемости мышей, которых кормят разными сенолитиками или их комбинациями. Сенолитики — это… (тут наверное вот это интервью подошло бы) если кратко — это вещества, уничтожающие постаревшие (бажные и распространяющие баги вокруг себя) клетки. Фишка в том, что комбинация сенолитиков оказывается заметно более эффективной, чем отдельные сенолитики; при этом эксперимент продолжается и потенциальная продолжительность жизни этих мышей еще неизвестна.
Т. е. ученые наткнулись уже не на отдельный, а комплексный механизм нейтрализации повреждений от старения и это уже заметно влияет на среднюю продолжительность жизни экспериментальных животных. И мы уже видим, что старение отступает. Оно теряет ореол хронологической неизбежности в восприятии людей, оказывается (в теории мы это давно понимали, но тут уже практика), что это такой системный глюк, с которым можно бороться системными же действиями. Вообще стоит подробнее раскрыть кибернетический аспект биологии, т. е. что такое организм с точки зрения ИТ, как наши ИТ-системы приближаются к его сложности и как построить эффективные средства администрирования, отладки и апгрейда.
arielf
Спасибо за разъяснения! Немного поправлю лишь. Мышей взяли нормальных, не генетически изменённых, им было 2 года. В Oisin используют генную терапию, а не малые молекулы, и ею не кормят, а используют инъекции.
Ну и целиком по концепции SENS синергичный эффект из-за уменьшения уровня 2-x повреждений оказался намного лучше, чем они же порознь!
c0f04
p16 и p53 — это белки. С одной стороны — они маркеры старения, с другой стороны — они замедляют деление клеток и чинят повреждённую ДНК, если я всё правильно понял. У нас есть гены, ответственные за выработку данных белков. Повысив выработку этих белков данными генами, действительно можно замедлить старение. Что подразумевается под генной терапией?
arielf
p16 и p53 — белки, экспрессируемые в «поломанных» клетках — маркеры. Всё, что нужно, уничтожить поломанные клетки, чем генная терапия и занимается.
c0f04
То, что повышенное отделение этих белков — маркеры, это понятно. Основной вопрос — что подразумевается под генной терапией? Один из вариантов генной терапии, — человеку вводят клетки с изменёнными генами для повышения экспрессии каких-либо белков. Можете ссылку на оригинальное исследование дать, где об этом говорится?
arielf
c0f04
То, что повысив экспрессию этих белков, мы вызовем замедление старения — предположение. С переставшими делиться (подразумевается под старением) клетками это так или иначе не сработает, т. к. у них уже серьёзные нарушения в ДНК, из-за чего эти белки в повышенных количествах и выделяются, но уже не могут повлиять на ситуацию.
c0f04
Я бы не называл всё-таки технологии достижения пренебрежимого старения омолаживающими технологиями. Продлевающими жизнь — да, но никак не омолаживающими. Так Вы вводите общественность в заблуждение. Устранят постаревшие из-за сокращения теломер или повреждения ДНК клетки. А рядом будут всё те же клетки с пределом Хейфлика. Максимум, что можно получить по технологиям SENS — медленное старение с удовлетворительным здоровьем.