Первая часть: какие виды препаратов существуют
В истории открытия лекарств выделяют три периода, каждый из которых дал начало трем поколениям лекарств:
развитие методов химического синтеза веществ дало начало эпохе малых молекул;
изобретение биотехнологических методов позволило создать «большие» биомолекулы;
открытия молекулярной биологии дали начало эре современных технологий — генной и клеточной терапии.
Эти три группы лекарств различаются по химической структуре, размеру молекул и терапевтическим возможностям. Сначала разберем малые и большие молекулы.

Самые первые — лекарства на основе малых молекул
Препараты в форме малых молекул — это химические вещества с небольшой молекулярной массой (не более 900 Да). Промышленное производство препаратов на основе малых молекул началось в 19 веке — и все еще остается доминирующим направлением: их доля составляет 80-90% среди всех современных лекарств в мире. Такие препараты есть в каждой аптечке: это знакомые каждому аспирин и анальгин, обезболивающие и противовоспалительные, сердечно-сосудистые и успокоительные средства.
Основное преимущество лекарств на основе малых молекул кроется в их небольшом размере; благодаря нему они достаточно легко проникают внутрь клеток. Здесь и начинается их фармакологическое действие: препарат оказывает воздействие на молекулы, участвующие во внутриклеточных биохимических циклах, активируя или блокируя определенные реакции. Еще одним плюсом малых молекул можно назвать преимущественно пероральный прием: именно эта лекарственная форма — «запить и забыть» — наиболее привычна для пациентов, что повышает приверженность к лечению. Наконец, среди преимуществ лекарств на основе малых молекул можно назвать «обкатанную» технологию: за долгие десятилетия фармкомпании стандартизировали процесс производства таких препаратов, а врачам удалось накопить результаты многолетних наблюдений за пациентами, благодаря чему ниже риск появления неожиданных эффектов в ходе лечения.
Из минусов препаратов на основе малых молекул стоит отметить их неспецифичность и возможные побочные эффекты, которые могут возникать из-за повышенных концентраций активного действующего вещества. Еще одним недостатком малых молекул является их неизбежная нагрузка на выделительную систему. Это свойство в целом характерно для любого лекарства, но особенно — в случае малых молекул, чужеродных для организма химически синтезированных веществ. При их метаболизме в организме неизбежно вовлекаются печень и почки. Из-за этого у пациентов с дисфункциями этих органов применение лекарств на основе малых молекул ограничено.
Самые белковые — «большие» молекулы
Биопрепараты — это молекулы с относительно высокой молекулярной массой, получают которые обычно с помощью биосинтеза в клетках. Биопрепараты появились благодаря достижениям молекулярной биологии 20 века, когда с помощью биотехнологий стало возможным вставлять целевые гены в плазмиды, клонировать генетический материал и создавать «биофабрики» для наработки в них нужного белка.
Главное преимущество биопрепаратов, которое выгодно отличает их от малых молекул — их специфичность. Разработчики будущего препарата разрабатывают такой дизайн биомолекулы, которая будет связываться только с конкретной мишенью в организме. Можно сказать, что каждое биологическое лекарство «заточено» для лечения конкретной болезни. Специфичность и прочность связывания с мишенью повышают терапевтический эффект биопрепаратов и снижают риск возникновения побочных эффектов.
К сожалению, недостатков у биопрепаратов тоже хватает, и основной из них связан с размерами — многие биомолекулы слишком большие, чтобы проникнуть внутрь клетки. Также биопрепараты в некоторых случаях обладают иммуногенностью, то есть воспринимаются организмом в роли «чужаков». Это может запускать иммунный ответ, в результате чего желаемый терапевтический эффект так и не будет достигнут. Еще один недостаток биопрепаратов — форма их выпуска: обычно их применяют в виде подкожных или внутривенных инъекций, что не так удобно, как привычные таблетки из аптечки. Наконец, еще одним минусом остается высокая стоимость биопрепаратов.
Самые передовые — генная и клеточная терапии
Последние достижения в мире биологии и медицины связаны с разработкой методов лечения на основе генных и клеточных технологий. Формально их нельзя назвать «лекарствами» в привычном смысле слова; это скорее манипуляции с генами и клетками пациентов, которые позволяют справиться с самыми сложными и специфичными заболеваниями. Особенность таких методов — в очень высокой точности воздействия на организм.
Генная терапия
В 20 веке многие наследственные патологии считались неизлечимыми. Сейчас у пациентов с такими болезнями, как гемофилия и спинально-мышечная атрофия, появился шанс. Надежду на это дает развитие методов генной терапии — лечении, при котором генетический материал пациента «чинят» от генетических поломок. Например, это могут быть манипуляции с дефектными генами, которые и вызвали болезнь: их можно поменять, выключить или включить.
— Замена поломанных генов: в этом случае внутрь клетки с генетическим дефектом добавляют нормальный ген, а неправильный ген убирают.

— «Переключение» генов: в случае, если болезнь связана с работой неправильного гена, его можно выключить. Если же болезнь развивается из-за того, что нужные гены почему-то «молчат», их можно активировать — это запустит нужные эффекты в организме.

Как внедрить ген в клетку
Генные инженеры используют специальные конструкции — векторы — для доставки целевых генов в клетку. Наиболее распространенными векторами являются вирусы — разумеется, не вызывающие болезни. Это обусловлено их свойствами: вирусы могут распознавать определенные типы клеток, связываться с ними и переносить внутрь генетический материал. Биологи удаляют вирусные гены, которые способны вызвать заражение, и заменяют их на целевые гены, которые заменят неработающий ген в организме пациента.
Существуют две стратегии введения вектора в организм пациента — ex vivo и in vivo.
— Стратегия in vivo («внутри») предполагает внедрение нужного гена непосредственно внутрь организма человека. В таком случае используют вектор, который не способен интегрироваться в геном человека, что снижает риск генотоксичности. Однако со временем, в процессе клеточных делений, количество правильных копий гена уменьшается.
— Стратегия ex vivo («снаружи») предполагает подготовительный этап — извлечение клеток из организма пациента. После этого производят непосредственно генетическую манипуляцию — вводят внутрь изолированных клеток векторы с нужным геном. Наконец, эти модифицированные клетки возвращают обратно пациенту.

Риски генной терапии
Генная терапия — пока еще очень молодой и «необкатанный» формат терапии, который несет в себе существенные риски:
Неспецифическое редактирование гена. В ряде случаев происходят ошибки редактирования, когда целевой ген вставляется не в то место, в которое должен был, а в похожем на него.
Неспецифическое нацеливание не на те клетки. В случае ошибок при подборе вирусного вектора эти генетические переносчики способны узнать не те клетки, в которые им нужно проникнуть. Из-за этого вирусы могут заразить нормальные клетки, а не только клетки-мишени, в которых содержится дефектный ген. Это может приводить к тяжелым побочным эффектам.
Нежелательная реакция иммунной системы. После добавления вирусного вектора внутрь организма пациента его иммунная система может воспринять этот вектор как чужака и начать атаку.
Потенциальная возможность запустить перерождение клеток. Если доставленные из вирусного вектора гены вставятся не в то место в ДНК, это может запустить процесс неконтролируемого клеточного деления и злокачественного перерождения.
Перспективы генной терапии
Несмотря на возможные риски, эта новая технология открывает шанс для лечения болезней, которые считались неизлечимыми. Уже достигнут большой прогресс в терапии сложных заболеваний, таких как спинально-мышечная атрофия, пигментный ретинит (дистрофия сетчатки, которая может привести к полной потере зрения) и других. Особенность лечения с помощью генной терапии в том, что пациенту достаточно одной инъекции, чтобы излечить болезнь. Правда, и стоимость такой инъекции на порядок выше, чем в случае биопрепаратов.
Клеточная терапия
Этот вид лечения похож на генную терапию, однако манипуляции проводятся не с генами, а с целыми клетками. Например, в организме пациента нет клеток нужного типа или они по каким-то причинам неактивны, а значит, не способны выполнять свои функции и справляться с болезнью. Лечение заключается в том, чтобы ввести человеку нормально функционирующие клетки или извлечь его собственные неактивные клетки, модифицировать их и вернуть обратно, после чего они смогут нормально выполнять свои функции.
Сложность клеточной терапии заключается в работе только с определенными видами клеток, которые в принципе можно трансплантировать в организм пациента. Некоторые специализированные клетки, например, нейроны или миоциты, трудно извлечь из организма пациента или донора, поэтому лечение нейродегенеративных и мышечных заболеваний с помощью клеточной терапии ограничено.
CAR-Т-клеточная терапия
Для лечения некоторых болезней, например, злокачественных заболеваний крови, применяют терапию с помощью Т-клеток. Т-лимфоциты — особый тип клеток крови, которые способны запускать иммунные реакции или напрямую уничтожать «плохие» клетки. У пациентов с лейкемией Т-клетки самостоятельно не справляются с мутировавшими раковыми клетками — например, не могут «узнать» их. Для борьбы с онкоклетками Т-клетки извлекают из крови пациента и активируют, добавляя к ним ген рецептора CAR (химерный антигенный рецептор, от англ. chimeric antigen receptors). С его помощью клетки как бы «настраивают» для узнавания рецепторов на поверхности раковых клеток. После этого модифицированные Т-клетки, вооруженные химерным рецепторов, возвращают пациенту. Этот процесс может занимать несколько недель.
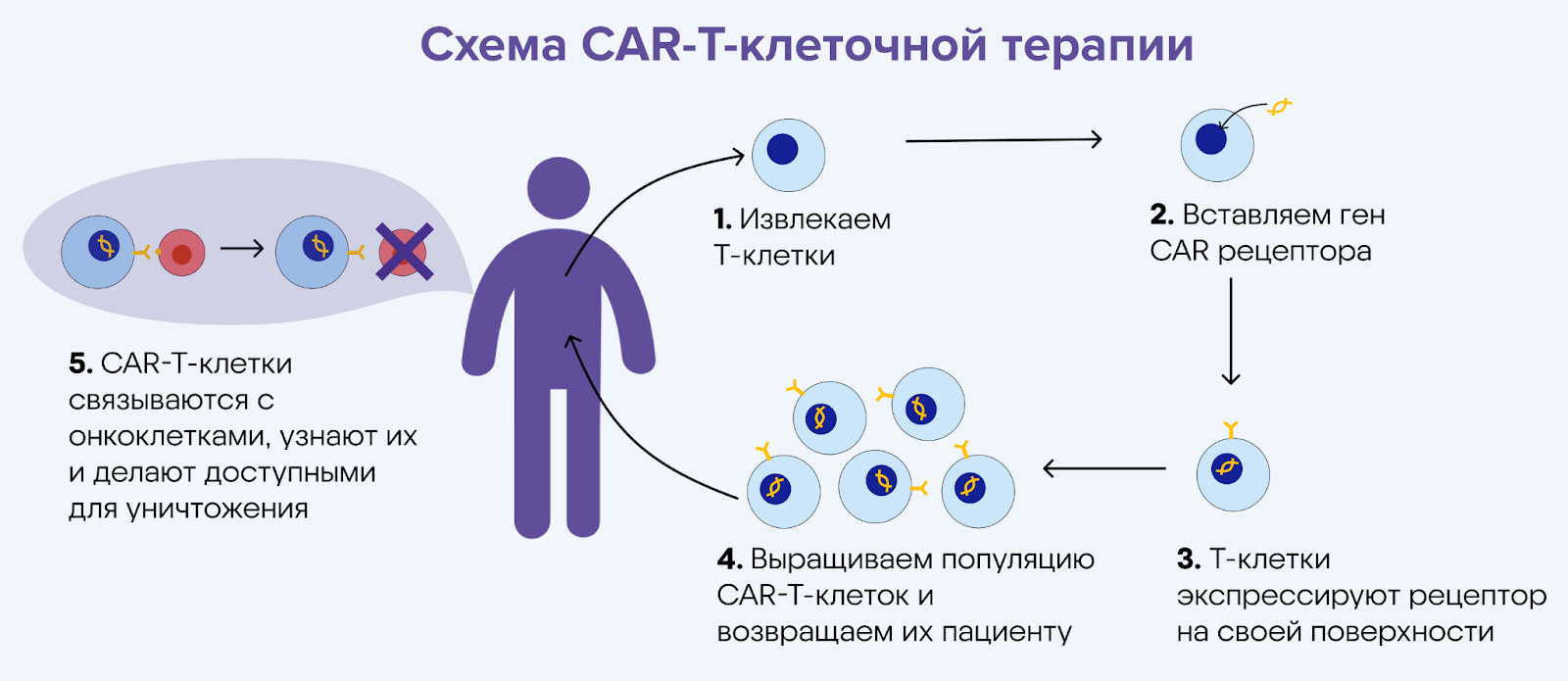
Клеточная CAR-T-терапия достаточно перспективна для лечения сложных заболеваний вроде рака крови, однако ее применение против сóлидных опухолей ограничено. Недостатками все еще остаются высокая стоимость, так как схему лечения разрабатывают индивидуально для каждого пациента, а также высокие требования контролирующих органов к безопасности терапии.
Вторая часть: как разрабатывают лекарства
Дизайн лекарств — процесс поиска и разработки новых терапевтических препаратов. Обычно, когда говорят о драг-дизайне, имеют в виду дизайн молекул, которые будут связываться с конкретной мишенью в организме. Наверное, самым распространенным примером такого взаимодействия является клеточный рецептор в качестве мишени и химическая или биологическая молекула в качестве лекарственного средства. Взаимодействие молекулы с мишенью может привести как к блокировке, так и к дополнительной активации рецептора, в зависимости от необходимого действия на организм.

Если упрощать, то цель драг-дизайна — найти такую молекулу, которая «выключит» плохую мишень (например, на раковой клетке) или «включит» хорошую мишень (например, на иммунной клетке). В организме человека это устроено сложнее: сама по себе молекула не способна заблокировать болезнь, она лишь запускает цикл реакций, которые в конечном итоге будут запускать иммунные реакции, блокировать нежелательные стимулы, и так далее.
Критерии поиска лекарств
Перед тем, как начать разработку, исследователи проводят анализ рынка, изучают потребности в лечении определенных болезней и выдвигают идею будущего препарата. Лекарство, которое возьмут в разработку, должно соответствовать следующим критериям:
Препарат лечит социально значимое заболевание. Это необязательно какая-то распространенная болезнь; для орфанных (редких) заболеваний тоже важно предлагать способы терапии.
Предполагаемый механизм действия нашей молекулы способен привести к нужному терапевтическому эффекту.
Разрабатываемое вещество должно с высокой специфичностью взаимодействовать только со своей мишенью и ни с чем больше, чтобы не приводить к побочным эффектам;
Компания-производитель имеет ресурсы, деньги и технические возможности для разработки конкретного лекарства.
Фармакокинетика и фармакодинамика
Эффективность и безопасность конкретного препарата изучают особые разделы фармакологии — фармакодинамика и фармакокинетика.
— Фармакодинамика изучает то, как лекарство влияет на организм, насколько оно эффективно. Для этого исследуют, как лекарство всасывается, метаболизируется и выводится.
— Фармакокинетика изучает то, как организм влияет на лекарство: его распределение и стабильность, безопасность для пациента.

Этапы разработки лекарств
Перед тем, как попасть на полки аптек или в медучреждения, каждое лекарство должно пройти несколько этапов разработки. Разберем их на примере нового лекарства, у которого нет существующих на рынке аналогов.

1 этап — поиск мишени и разработка. Исследователи ищут молекулы, которые могли бы стать лекарствами для лечения конкретной болезни. В этом этапе участвуют тысячи и десятки тысяч потенциальных молекул.
Сначала исследователи идентифицируют нужную мишень в организме. Наиболее популярными мишенями являются белки — различные клеточные рецепторы и ферменты. Подходящая мишень должна как можно более эффективно и безопасно таргетироваться нашим будущим препаратом.
После выбора мишени нужно разработать терапевтический формат и форму выпуска препарата к ней. Для этого проводят раннюю разработку, когда определяют свойства терапевтический молекулы, в том числе — ее способность связываться с нужной мишенью, оптимизируют и нарабатывают молекулу для последующих испытаний.
После первых этапов ранней разработки запускают фармацевтическую разработку, во время которой изучают стабильность будущего лекарства, форму выпуска, способы хранения и других фармацевтические свойства.
2 этап — доклиническая разработка. Молекулы, полученные на предыдущем этапе, тестируют, как правило, на животных. При переходе к доклиническим испытаниям количество потенциальных препаратов сокращается в несколько раз. В фармацевтической практике в рамках одного проекта обычно проверяют один, реже — два препарата (это может быть одно и то же активное вещество, но в разных формах выпуска и в разных дозировках).
Основная цель доклинических исследований — определить безопасную и эффективную дозировку для дальнейшей проверки в ходе клинических исследований с участием здоровых добровольцев и пациентов.
Важную роль в доклинических исследованиях играют лабораторные животные. Существует множество животных моделей, среди которых мыши, крысы, кролики, собака, кошки и нечеловекоподобные приматы.
Доклинические исследования можно разделить на два последовательных этапа: обычно сначала проводят испытания на грызунах, затем — на крупных млекопитающих (обычно приматах). Выбирая животных для экспериментов, ученые оценивают наличие в их организме мишеней для терапевтического препарата. Важно, чтобы биологическая мишень для разработанного препарата была схожей у человека и исследуемых животных.
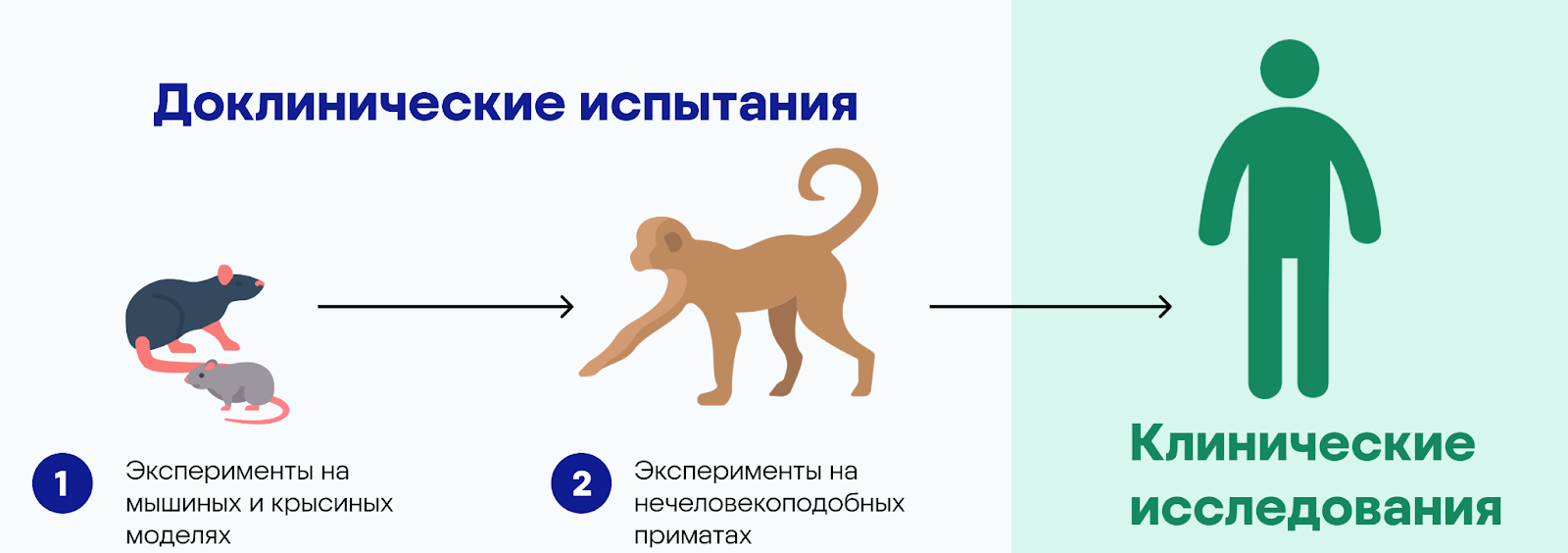
В результате доклинических исследований получают ответ на вопрос, стоит ли тестировать препарат на людях; является ли он достаточно безопасным и эффективным.
3 этап — клинические исследования. Молекулы, прошедшие предварительный отбор на животных моделях, проверяют на здоровых добровольцах и пациентах. Эта стадия — самая сложная, длительная и дорогостоящая во всем процессе разработки препарата. Клинические исследования проводят в течение нескольких фаз. Обычно первую фазу испытаний проводят на здоровых добровольцах, чтобы получить данные о том, как люди в принципе переносят прием лекарства, возникают ли какие-то нежелательные побочные реакции. Последующие фазы проводят на пациентах с конкретным заболеванием — сначала на небольшой выборке, а затем количество испытуемых расширяют, в том числе, включают людей из разных стран. Цель клинических испытаний на пациентах — проверить эффективность действия лекарства, оценить уровень надлежащей терапевтической дозы.
4 этап — регистрация препарата и одобрение регулирующих органов. Фармацевтическая компания получает разрешение на продажу препарата. Важным документом, который дает компании исключительное производство этого лекарства, является патент. Регистрация патента — долгая процедура, поэтому обычно подачу документов на патент начинают уже на этапе ранней разработки.
5 этап — промышленное производство. После того, как новое лекарство прошло необходимые испытания и было зарегистрировано, фармацевтическая компания приступает к серийному производству препарата.
6 этап — продажи и маркетинг. Лекарство наконец выходит на рынок и становится доступным для пациентов. Только на этом этапе фармацевтическая компания начинает получать прибыль, окупая предыдущие вложения. Все время, пока препарат присутствует на рынке, медицинские представители и специалисты по фармаконадзору продолжают следить за безопасностью и эффективностью препарата.
Процесс разработки нового лекарства может занимать от 3 до 15 лет (обычно 5-7 лет). Самым затратным этапом разработки с большим отрывом являются клинические испытания, на которые тратят сотни миллионов долларов. Общая стоимость разработки зачастую превышает 1 млрд долларов. При этом некоторые лекарства не окупаются — например, если уже после выхода на рынок обнаруживаются неожиданные побочные эффекты, которые ускользнули из зоны внимания на этапе клинических исследований.

В статье мы затронули верхушку айсберга современной фармы и вопроса разработки новых лекарств. На самом деле на каждом этапе существует много нюансов, деталей, с которыми люди, работающие в отрасли, сталкиваются постоянно. Будем рассказывать о них в будущем.
Статья подготовлена Анной Гобовой специально для Бластим
Комментарии (3)

vassabi
00.00.0000 00:00интересно - когда придумают целенаправленный доставщик молекул ?
т.е. чтобы выпить таблетку, из нее молекулы всасываются в кровь, в рабочей (но неактивной) форме, разносятся кровью по организму, нигде особо не накапливаются и но и не выводятся из организма. Со временем они превращаются из рабочей формы в нерабочую и выводятся из организма почками.
НО вот в данном месте Х (например - левой ноздре) оно из рабочей неактивной формы превращается в активную, задерживается и действует.


fndrey357
Меня всегда интересовал механизм придумывания новых лекарств. Решили вот излечить чесание правого пальца левой руки. Сначала же надо выделить ген-аминокислоту-вирус или еще, что что вызывает это. А потом уже думать чем глушить и как доставлять это все в клетку-на кожу-в кровь.
Здесь более или менее удобоваримо написали последовательность.
IvanPetrof
Многие препараты получились случайно. Та же виагра, например. Или вот многие антигистаминные препараты от аллергии имеют побочку - угнетение ЦНС, что вызывает сонливость. Кто-то почесал репу и решил, что пусть это будет фича, а не баг. И появились снотворные препараты на этой основе.