Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).

На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
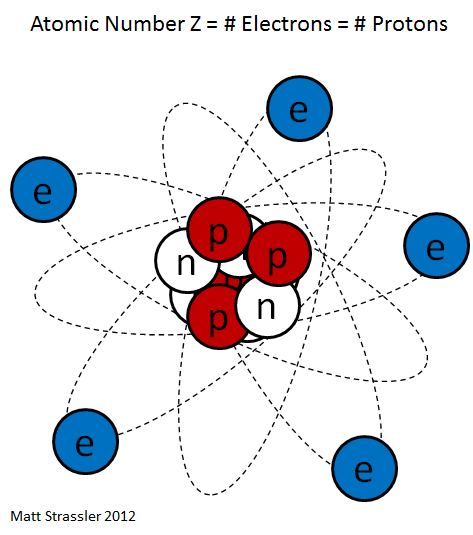
Рис. 1
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.

Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
Комментарии (37)

saboteur_kiev
07.05.2017 02:16«А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2»
Это не вопрос. Вопрос почему и как электроны этой «серой» области взаимодействуют с электронами другой «серой» области таким образом, что появившееся взаимодействует влияет на ядра так, что они отталкиваются?
Stalker_RED
07.05.2017 03:05-1
saboteur_kiev
07.05.2017 13:56Это не ответ. Вопрос — как именно и почему это происходит?
Вроде как уже предполагается, что носителем гравитонов является искривление пространства. И вроде как известно, что на малых размерах, сравнимых с атомов, гравитация не работает, но почему? Как именно работает слабое взаимодействие? Кто его носитель? Наука пока ищет ответы.
dead_undead
08.05.2017 01:17Носители слабого взаимодействия — W и Z бозоны, их уже нашли. Но слабое тут ни при чем, вам правильно дали ссылку на обменное взаимодействие. Оно является следствием принципа запрета паули, антисимметричности волновых функций частиц с полуцелым спином относительно перестановки.

dead_undead
08.05.2017 01:22+1Если по простому в результате этого принципа электроны большую часть времени будут находиться между атомами, соответственно создавая некую неоднородность распределения заряда. И атомы будут притягиваться. Прочитайте про механизм образования ковалентной связи.

coturnix19
07.05.2017 19:17+1disclaimer: не понимаю, но знаю что это не так (как вы написали) а вот так.

frees2
07.05.2017 09:00Если попробовать передать сложное явление, многоуровневое, простой картинкой, то можно здорово пролететь в понимании, лучше иногда вообще не придумывать понятное, а воспринимать только цифры и логику.
«Более реалистичный атом», есть лишь примерно понятный уровень абстракции, как картина Пабло Пикассо.
Есть картинки с восьмёрками, энергетическими уровнями и так далее. Электрон не есть в одном месте.

RusikR2D2
07.05.2017 10:02Возможно, глупый вопрос, но я спрошу :)
Почему атом электрически нейтрален? Положительный заряд в центре, отрицательный снаружи. По макро-логике должен получится отрицательно заряженный объект.
HappyLynx
07.05.2017 11:36Возможно, сейчас на чересчур обывательском уровне поясню, но все же.
Электронные оболочки атома симметричны относительно ядра, а это значит, что если у нас есть удаленный объект, и мы рассекаем атом плоскостью, проходящей через ядро и перпендикулярной вектору на этот удаленный объект, то относительно этой плоскости «полусфера» электронных оболочек, находящаяся ближе чем ядро к удаленному объекту, будет вносить больший вклад в отрицательный заряд, чем половина заряда ядра, но, в то же время, вторая «полусфера» будет вносить настолько же меньший отрицательный заряд, вот и получим нулевой заряд на выходе.
saboteur_kiev
07.05.2017 13:58Я может не очень понял, электронная оболочка это электроны на орбите? Но это означает, что количество электронов должно быть четным, чтобы полусферы могли друг друга компенсировать?

superhimik
07.05.2017 14:41Да, очень условно электронная оболочка — это совокупность электронов. Электронов может быть и нечётное количество. Но оно равно числу протонов в ядре.

saboteur_kiev
07.05.2017 17:16А как тогда две «полусферы» могут друг друга компенсировать, при нечетном количестве электронов?

superhimik
07.05.2017 17:25+1Пример с полусферами неудачен. Электрон не локализован где-то в пространстве, его поведение описывается волновой функцией, квадрат которой — плотность вероятности обнаружить электрон в какой-либо точке пространства. Иными словами вся совокупность электронов равномерно «размазана» вокруг ядра симметрично.

saboteur_kiev
07.05.2017 18:50-1То есть мы не знаем что такое электрон, знаем только отдельные его свойства?

superhimik
07.05.2017 14:39+1В каждый дискретный момент времени атом не является нейтральным, а представляет собой очень-очень маленький диполь, очень быстро меняющий вектор :-D. Но в СРЕДНЕМ (по времени) атом нейтрален, если интегрировать от — до + бесконечности.

uastalker
07.05.2017 11:06+1Довольно интересно. Освежить знания чтобы, например, точнее рассказать об окружающем мире самому младшему поколению. Со школы многое забылось.

simple-simple
07.05.2017 19:23Жалко все же что весь пласт химии насчет валентностей и связей опущен. Все почти позабыл, а там достаточно интересно вроде.

superhimik
07.05.2017 14:37+1Скажите, вы специально «забыли» мой пароль и затруднили процедуру входа, чтобы я не смог написать критический комментарий?
1) Соль — это не молекулярное соединение, а ионное, состоит из ионов Na+ и Сl-.
2) Говорить о типах атомов надо очень осторожно. Химический элемент — это абстрактное понятие, характеризующее совокупность атомов с одинаковым зарядом ядра. Однако типов атомов существенно больше, чем химических элементов, так как есть изотопы, отличающиеся разным количеством нейтронов.
3) Как бы ни был мал размер электрона, он, тем не менее, измерим.
4) Понятие «химия» к атому неприменимо, хотя применимо к абстракции «химический элемент» (как совокупности соединений, которые могут быть этим элементом образованы, так, например, можно вести речь о химии хлора, имея в виду, молекулярный хлор, хлориды, гипохлориты, хлориты, хлораты и перхлораты), как бы это не было парадоксально. Применять понятие «химия» можно только к той частице, которая сохраняет свойства вещества. Атом водорода не составляет никакого вещества, точно так же, как не составляют вещества подавляющее большинство других атомов (за исключением, пожалуй, благородных газов). Свойства вещества сохраняют молекулы (H2, S8, P4, -(CН=СН(СН3))n-) и кристаллы, как ионные, так и металлические.
coturnix19
07.05.2017 23:55-11) В газовой фазе соль «молекулярна», как и (некоторые?) металлы см. например обсуждение (там даже была какая то ссылка на исследование но она издохла)
3) насколько известно, пока то у электрона не обнаружили внутренней структуры (я не знаю может ли она вообще у него быть), соответственно и размер для него неопределим — сколько намеряете столько и получится.
superhimik
08.05.2017 03:22+11) Молекулярна, только, пардон, это уже не столовая соль, о которой идёт речь в статье.
2) мне не очень понятен этот тезис.
coturnix19
09.05.2017 08:19Хм, тогда мне не понятно что вы имели ввиду под
3) Как бы ни был мал размер электрона, он, тем не менее, измерим.

superhimik
09.05.2017 12:31То, что размеры электрона поддаются измерению имеющимися в распоряжении способами.

coturnix19
09.05.2017 20:30А они у него есть, эти размеры?

brzsmg
10.05.2017 11:36-1
coturnix19
10.05.2017 20:04Это приближенная условность, к тому же классическая, а мы говорим о квантовом объекте

superhimik
15.05.2017 04:19+1В пределах неопределённости Гейзенберга — конечно.

coturnix19
15.05.2017 09:42-1т.е., охладив єлектрон достаточно сильно, его размерам можно придать почти произвольное значение, ну или по крайней мере «раздуть» его до размеров аппарата. Не уверен, что обычный человек спрашивая о размерах имеет ввиду под размерами это.

superhimik
15.05.2017 16:25Сори, у меня кванты были много-много-много лет назад, поэтому я не понимаю, к чему вы клоните.

coturnix19
16.05.2017 00:05-1Поверьте, я в этом разбираюсь куда хуже вас, просто мне казалось что у электрона, как у точечной частницы, нету никаких «настоящих» фиксированных размеров, в каком бы то ни было смысле. Их конечно можно измерить, но «результат» может быть любым. Или нет?

superhimik
07.05.2017 14:50P.S. Конечно же, есть и атомные кристаллы. Но их свойства не имеют ничего общего со свойствами изолированных атомов.
kauri_39
07.05.2017 14:54+1«Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? »
Первым вопросом должен быть: «как образуются атомы?» Ответ на него определяет ответы на остальные вопросы.
Атомы разных химических элементов образуются при слиянии разного количества протонов и нейтронов в системы (ядра атомов) — представителей атомной формы организации материи. Исключением служит самый простой и лёгкий атом — водород, его ядром является протон. А в сочетании с одним или двумя нейтронами протон образует изотопы водорода.
Положительно заряженные протоны в атомах удерживаются благодаря ядерным силам (сильному взаимодействию) — их обмену пи-мезонами с нейтронами ядра. При испускании пи-мезона (пиона) протон превращается в нейтрон, а поглощающий пи-мезон нейтрон превращается в протон.
Поэтому на вопросы можно ответить так:
«1. Из чего состоят атомы?»
Атомы в первую очередь состоят из разного количества протонов и нейтронов (нуклонов), поскольку образуются из них, исключая атом водорода. И так как эти первичные атомы (ядра атомов) имеют положительный электрический заряд, то после своего остывания они могут окружить себя отрицательно заряженными электронами — в том же количестве, сколько имеется в атоме протонов. Так образуются электрически нейтральные атомы.
«2. В чём смысл атомного номера?»
В том, что атомный номер определён количеством протонов, входящих в состав атома.
«3. Каков главный источник различий в химическом поведении атомов разных элементов?»
Это количество протонов в атоме. Оно задаёт не только общее число электронов в электрически нейтральных атомах, но и форму их орбит, и число электронов на орбитах. Когда заполняется электронами ближняя орбита, а положительный заряд атома ещё не скомпенсирован, то следующие электроны размещаются на новой дальней орбите. И если на ней размещается всего лишь один или два электрона, то такому нейтральному атому легче их отдать при взаимодействии с другим атомом, у которого на внешней орбите, наоборот, есть одно или два места, свободных от электронов. Поэтому первый атом имеет химические свойства, например, металла, а второй — свойства окислителя. «Лишние» электроны для первого атома становятся общими для него самого и для атома с «недостающими» электронами. Обмениваясь ими, эти атомы объединяются в молекулу — более масштабную систему, которая представляет собой новую форму организации материи.
«4. До какой степени разные атомы одного элемента схожи между собой?»
Разные атомы одного хим.элемента — это разные изотопы данного элемента, то есть атомы с одним и тем же числом протонов, но разные по числу нейтронов в атомах. Химические свойства их схожи, но у них разный вес. Изотопам тяжёлых атомов присуща радиоактивность — распад их нейтронов с испусканием радиоактивных частиц.
«5. Как части атома удерживаются вместе?»
Нуклоны (протоны и нейтроны) в атоме удерживаются путём обмена пи-мезонами — носителями ядерных сил. Положительно заряженное ядро атома удерживается вместе с отрицательно заряженными электронами благодаря действию электромагнитных сил.
«6. Почему атомы удерживаются вместе и образуют молекулы?»
Благодаря обмену общими электронами, как было сказано в ответе на третий вопрос. Как образуются атомы — системы нуклонов, так образуются и молекулы — системы атомов. Так образуются вообще все представители своих форм организации материи, что выражается в общем законе эволюции.
Прошу извинить за возможные ошибки и за отличия в формулировках от традиционно принятых в физике.

dadyjo
09.05.2017 18:49часто пишут что электроны "вращаются" но насколько я понял это не так!

dead_undead
11.05.2017 00:37+1здесь вы имеете в виду что, собственное вращение (спин), или вращение вокруг ядра (орбитальный момент)? Но в общем то это в обоих случаях не так, да.


GennPen
Это школьные уроки на ГТ?