
На GEEKTIMES популярны публикации, связанные с энергетикой, в том числе с получением водорода. Однако в обоих недавних случаях (1 и 2), да простят меня авторы, я плохо понимал, о чём речь, несмотря на профильное образование, пока не обратился к первоисточникам.
Ниже – мои пояснения читателям, чтобы было яснее, из-за чего у электрохимической науки существует необходимость в повышении энергоэффективности.
Итак, электролиз воды, т.е. разложение её на водород и кислород (1):
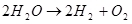 (1)
(1)Учитывая, что это эндотермический процесс, т.е. протекающий с поглощением энергии, встаёт вопрос о его экономическом смысле. Он, правда, не в моей компетенции, но могу предположить, что смысл может быть, например, в том, чтобы использовать водород для хранения энергии.
При протекании электролиза возникает несколько видов энергетических потерь, связанных с химическими явлениями:
— низкий выход по току;
— износ электродов;
— перенапряжение.
Омические потери я не рассматриваю, так как они не связаны с химическими процессами.
1)Выход по току – это отношение количества электричества, израсходованного на образование целевого продукта (Qц), к общему количеству электричества (Qо), пропущенного через электроды. Выход по току может принимать значения от 0 до 1 или от 0 % до 100 %:
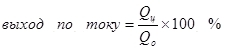
Выход по току менее 100 % объясняется тем, что при электролизе очень часто протекают побочные реакции, которые не ведут к образованию желаемого продукта. Типичный пример – электрохимическое хромирование (а также цинкование в кислых электролитах, например), которое автору доводилось проводить в промышленных масштабах. Выход по току реакции образования металлического хрома (2, для дотошных: конечно, такая реакция на электроде не протекает, это упрощение) из стандартного сернокислого электролита не превышает 15-20 % из-за того, что одновременно с нужной реакцией протекают реакции восстановления ионов водорода (гидроксония для особо дотошных) до водорода (3) и дихромат-ионов до ионов хрома (+3) (4). Когда говорят об эффективности электролиза, чаще всего имеют в виду именно этот показатель – выход по току.
 (2)
(2)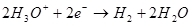 (3)
(3)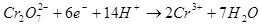 (4)
(4)Выход по току зависит от множества факторов: состава и температуры электролита, материала и состояния электродов, силы тока и напряжения. Варьируя в определённых пределах эти параметры, можно оптимизировать расходы энергии на целевой электрохимический процесс.
Само же протекание побочных реакций связано с их термодинамической возможностью (см. ниже) и ненулевой скоростью (см. ниже).
2) Износ электродов – это материальные, а не энергетические потери. Однако для изготовления электродов тоже необходимо затрачивать энергию, поэтому я включил этот пункт. Чаще изнашиваются аноды – на них протекают процессы окисления. Катоды тоже могут разрушаться, если электролит достаточно агрессивен.
Стойкость анода есть функция от его состава и структуры, а также плотности тока.
3) Наиболее сложно для понимания третье явление – перенапряжение. Попробую объяснить его суть.
Чтобы стал возможен электролиз, необходимо подать на катод и анод определённую разность потенциалов. Минимально необходимая разность потенциалов считается с помощью уравнения Нернста (5):
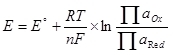 , (5)
, (5)где
E – электродный потенциал полуреакции, В;
E° – стандартный электродный потенциал полуреакции, В;
R – газовая постоянная, 8,314 Дж/(моль?К);
T — температура, К;
n – число электронов, участвующий в полуреакции;
F – постоянная Фарадея, 96500 Кл/моль.
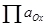 – произведение активностей (фугитивностей) окисленных форм;
– произведение активностей (фугитивностей) окисленных форм; – произведение активностей (фугитивностей) восстановленных форм.
– произведение активностей (фугитивностей) восстановленных форм.Так, электродный потенциал полуреакции (4) запишется в виде (6):
 (6)
(6)Вот пример.
При разложении воды (в кислых растворах) на аноде идёт окисление её до кислорода:
 Eа°=1,36 В
Eа°=1,36 ВНа катоде идёт восстановление её до водорода:
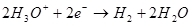 Eк°= 0 В
Eк°= 0 ВМинимальная разность потенциалов (?E), которую надо подать на электроды, чтобы начал протекать электролиз, составит ?E = Eа – Eк. В случае воды это значение при стандартных условиях (активность ионов водорода 1, давление, для особо дотошных — фугитивность, кислорода и водорода 1 атм, тогда второй член уравнения Нернста равен 0 и E=E°) составит 1,36 В. Однако в реальности это напряжение часто больше на величину, называемую перенапряжением ??, которое, к тому же, зависит от плотности тока на данном электроде ??=f(j), материала электрода и состояния его поверхности.
Откуда берётся перенапряжение?
Причины возникновения перенапряжения – кинетические, т.е. связанные со скоростью протекания электрохимической реакции.
Рассмотрим реакцию, обратную электролизу воды: взрыв гремучего газа, т.е. смеси 2 объёмов водорода и 1 объёма кислорода. Реакция сопровождается выделением большого количества теплоты, однако при комнатной температуре не протекает из-за высокой энергии активации (обозначено Eа на рисунке ниже) – потенциального барьера, которого надо преодолеть прочным молекулам водорода и кислорода. Чтобы взрыв всё-таки произошёл, смесь необходимо поджечь, т.е. нагреть, повысив потенциальную энергию части молекул. Можно внести катализатор, например, мелкораздробленную платину, которая понизит энергию активации.
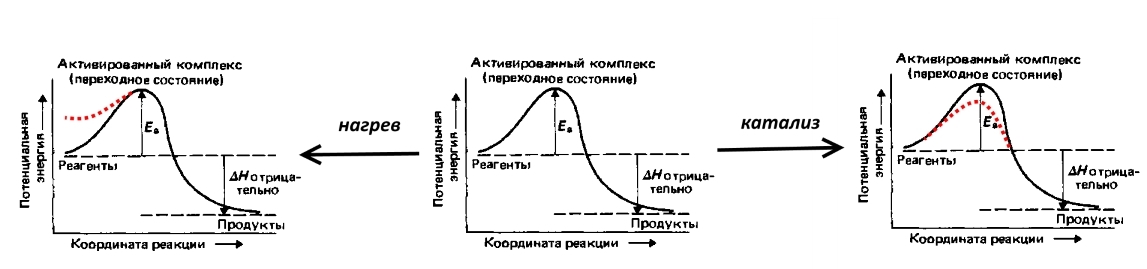
Перенапряжение – это электрохимический эквивалент энергии активации, она отражает те дополнительные (по сравнению с термодинамическими, рассчитанными по уравнению Нернста) энергетические затраты, которые надо преодолеть для того, чтобы скорость электролиза была высока.
У перенапряжения есть несколько составляющих.
В процессе электролиза приэлектродный слой обедняется теми ионами, которые разряжаются на соответствующем электроде. Таким образом, значения концентраций, которые надо подставлять в уравнение Нернста, не соответствуют тем, которые наблюдаются в объёме электролита, а, значит, и разность потенциалов, при которой будет продолжаться электролиз, увеличится. Такое перенапряжение называется концентрационным. В случае концентрационного перенапряжения дополнительные энергетические затраты нужны для того, чтобы преодолеть последствия диффузионного, миграционного и конвективного переноса потенциалопределяющих ионов.
Концентрационное перенапряжение устраняется перемешиванием и повышением электропроводности электролита.
Вторая составляющая перенапряжения связана с протеканием химической реакции. Это может быть как обычная химическая реакция, идущая в приэлектродном слое или на поверхности электрода, процессы адсорбции-десорбции, так и электрохимическая реакция, связанная непосредственно с переносом электрона через границу раздела фаз с электрода на молекулу или ион. Такое перенапряжение иногда называют реакционным.
Если наиболее медленной стадией становится перенос электрона, говорят о наличии перенапряжении электрохимической стадии. В этом случае дополнительные энергетические затраты нужны для повышения энергии электронов материала электрода. Нужно повысить их потенциальную энергию до энергии соответствующих химических связей реагента и облегчить их туннелирование к реагенту, находящемуся в приэлектродном слое.

Третья составляющая перенапряжения, фазовая, появляется в том случае, если электролиз связан с образованием новой фазы – пузырьков газа или плёнки металла. Дополнительные энергетические затраты в данном случае нужны для преодоления силы поверхностного натяжения на стадии образования зародышей новой фазы. Снять фазовое перенапряжение помогают добавки к электролиту поверхностно-активных веществ.
Теперь вернёмся к статье, которая обсуждалась на GEEKTIMES, чтобы расшифровать её смысл.
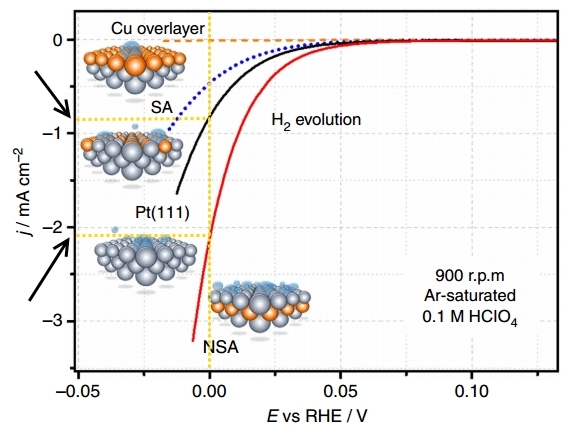
На рисунке представлены поляризационные кривые – зависимости плотности тока (j) от потенциала (E, относительно RHE, т.е. обратимого водородного электрода) на различных электродах при выделении водорода (H2 evolution).
Поляризация – это разность между равновесным потенциалом электрода (т.е. в отсутствие тока) и его потенциалом под током, т.е., грубо говоря, перенапряжение для отдельного электрода. На графике выше – это поляризация электрода, на котором происходит выделение водорода. Плотность тока в электрохимии – это способ выражения скорости химической реакции. Таким образом, чем больше плотность тока при меньшем перенапряжении (поляризации), тем лучше, т.е. тем быстрее идёт процесс и тем меньше энергетических затрат на его осуществление.
Сравним плотность тока при E=0 В для платинового немодифицированного электрода Pt (111) и модифицированного подслоем меди электрода NSA. На модифицированном электроде в единицу времени выделяется примерно в 2 раза больше водорода.
Теперь посмотрим на проблему с другой стороны. Первоначально статья на GEEKTIMES была озаглавлена как «Эффективность электролиза увеличили вдвое». Как я писал выше, часто под эффективностью при электролизе подразумевают выход по току. Часто, но не всегда.
Существует понятие КПД электролиза, которое учитывает перенапряжение (как сумму модулей поляризаций) (7):
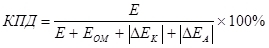 , (7)
, (7)где
E – напряжение, подаваемое на электроды, В;
Eом – омическое падение напряжения, В;
?EK – катодная поляризация, В;
?EA – анодная поляризация, В.
С этой точки зрения снижение перенапряжения, безусловно, повышает эффективность электролиза. Другое дело, что для вычисления КПД электролиза в обсуждаемом случае нужно, скорее всего, провести дополнительные измерения и расчёты, которые покажут, что модифицированный подслоем меди электрод увеличить КПД в 2 раза не смог.
Ну и немножко теории в заключение.
Если концентрационное перенапряжение можно понизить перемешиванием и увеличением электропроводности раствора, фазовое – добавками поверхностно-активных веществ, то реакционное перенапряжение, связанное с протеканием химической реакции, устраняется применением катализаторов. В рассматриваемом случае таким катализатором стал подслой меди на платиновом электроде.
Выделение водорода при электролизе воды связано с обрзованеим промежуточных частиц – атомов водорода, адсорбированных на электроде, так называемых адатомов. Для эффективного выделения водорода связь адатомов с поверхностью электрода не должна быть ни очень сильной, ни очень слабой. Из всех известных чистых металлов оптимальной энергией связи с адатомами водорода обладают платиноиды, вот почему на платине перенапряжение выделения водорода – одно из самых низких. Введение субслоя из атомов меди, как показывают расчёты, ещё несколько понижает энергию связи «поверхность электрода-адатом водорода», что усиливает каталитическую активность электрода, снижает перенапряжение и, соответственно, энергетические затраты, а также повышает скорость выделения водорода.
Спасибо за внимание.
Комментарии (62)

nomadmoon
27.03.2016 13:12Вопрос немножко про другое, про электроперенос. Если погрузить фольгированный текстолит в раствор медного купороса, поместить над ним электрод и подать ток будет медь с текстолита переноситься на электрод? Так наверное можно было бы «экологичные» платы рисовать.

superhimik
27.03.2016 13:18+2я не знаю, что такое фольгированный текстолит. Знаю, что такое фольга и что такое текстолит, а вот фольгированный текстолит не знаю. Про медь могу сказать следующее. Есть такой процесс электрорафинирования. Из чернового металла (с примесями) делают анод, из чистого — катод. Подают на электроды разность потенциалов. При определённых режимах процесса черновой анод растворяется, примеси оседают на дно или переходят в раствор в зависимости от своей природы, а металл переносится с анода на катод, где осаждается в чистом виде.
Alexey2005
27.03.2016 19:10Пробовал электрохимически "меднить" металлические предметы — медь каждый раз осаждается не в виде плёнки, а в виде рыхлого слоя кирпично-красного цвета, и собственно покрытия не образует.
Толку от её чистоты, если нет именно плотной плёнки металла?
superhimik
27.03.2016 19:12Да, если не применять специальных добавок и спецэлектролит, то: а) будет рыхлый слой; б) адгезия к подложке будет фиговая.
VerdOrr
27.03.2016 20:32Плотность тока слишком велика — "… Содержание меди в электролите во время работы обычно уменьшается вследствие недостаточной растворимости анодов. Снижение концентрации ионов меди в электролитах приводит к образованию пористых осадков. Кроме того, работая с малоконцентрированными медными электролитами, можно применять только пониженные плотности тока."
http://www.zctc.ru/sections/cooper

saege5b
28.03.2016 12:09Будут пятнами, и чем больший кусок надо «стравить» тем больше будет оставаться.
Т. е. стравится по границе с дорожками и всё.

Gryphon88
27.03.2016 13:33+1Спасибо за статью. Примерно то же мне объясняли на физхимии, но теперь понятно :)
Редакторы Гиктаймс молодцы. Пишут обгрызенные статьи, а на них, уже читатели, ещё 4: 1 опровержения, 2 пояснения-расшифровки, и ещё одну с опросом.
superhimik
27.03.2016 13:35- Спасибо за статью. Примерно то же мне объясняли на физхимии, но теперь понятно :)
:-D
Gryphon88
27.03.2016 14:12Физхимия для меня была самым сложным предметом, потому что за два семестра я так и не смог понять её, хотя честно пытался в течение года. Оглядываясь назад, жалею, что мне никто не врезал прямым текстом:
1. Это всё вероятностые вещи. Фигня случается, поэтому нежелательные продукты у нас будут всегда, а выход полезног опродукта может быть слабо детектируемым. Различия в константах (например, диссоциации) просто сдвигают вероятность, но ничего по факту не гарантируют.
2. Всё, что находится в одном растворе, может влиять друг на друга. Отсюда ерунда со стабильностью/нестабильностью, неожиданные перекосы реакций и прочее.
3. «Минимальная необходимая» — это значит, что при меньшем значении полезная реакция точно не пойдёт, а не то, что при большем или равном точно пойдёт и с удовлетворительными результатами. Практическое значение, относительно минимально необходимого, может быть на несколько порядков выше.
superhimik
27.03.2016 14:31Так и хочется сказать: "Ну, это химия, детка!"
На самом деле надо понять, что есть термодинамика, которая всего лишь говорит "возможно" или "невозможно" и в какой степени, и есть кинетика, которая говорит "как скоро". Но они не пересекаются :-D

Wirtsleg
28.03.2016 03:12Вот вы смеётесь, а я не раз и не два сдавал экзамены благодаря Khan Academy, а не лекциям, хотя и не пропускал ничего. Ваша статья ничего нового не сообщила, но пользу тоже принесёт, будьте уверены. Спасибо, что наполняете GT такими вещами.
Без двух месяцев дипломированный электрохимик, пишущий дипломную работу по электролизу водных растворов без выделения металлов. :)
superhimik
28.03.2016 03:13В моё время никто не знал о Khan Academy. Приходилось перебирать кучу учебников или просить помощи у коллег. Что касается статьи, то да, электрохимику она, конечно, ничего нового не сообщит :-)
Wizard_of_light
27.03.2016 14:07Спасибо! Когда-то пытался рассчитать энергозатраты на меднение электролизом, но энергозатраты всё равно получались сильно больше расчётных. Только теперь понял, как многого я не учёл тогда :)

stalinets
27.03.2016 20:54В условиях дорогого топлива было бы здорово с помощью электролиза решить практическую задачу — получать чистый водород из воды, сжимать компрессором в баллон и ездить на нём, поставив в машину какое-нибудь ГБО, работающее на водороде.
Халявную энергию для электролиза можно брать от солнечной батареи, например. А вот что насчёт установки, которая бы без особых танцев решала бы эту задачу? Или для бытового применения сделать такое будет слишком дорого/сложно?
У меня уже были мысли (до начала массовой установки счётчиков) по поводу того, что можно из городской газовой сети компрессором в баллоны накачивать природный газ и ездить на нём, используя метановое ГБО, но во-первых вряд ли это можно узаконить, во-вторых если стоит счётчик на газ — уже не факт, что будет так выгодно. А что с вдородом?VerdOrr
27.03.2016 21:24Водород? в баллонах? дома? "… Есть такой порошок, с ним летать хорошо, называется пооорох"
"… водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона..."
https://ru.wikipedia.org/wiki/%D0%93%D0%BE%D1%80%D0%B5%D0%BD%D0%B8%D0%B5_%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%B0
Если уж электричество «халявное» есть может лучше об электромобиле задуматься?
stalinets
28.03.2016 00:00Слышал такое про диффузию гелия, про водород не знал. Вроде им шарики и дирижабли раньше заправляли и всё нормально было) Ну да ладно, понял, спасибо.

begin_end
28.03.2016 00:51Шарик что с водородом, что с гелием за некоторое время (дни) сдувается из-за диффузии. Из-за нее же водород может натечь внутрь вакуумного прибора через стекло, конечно если водорода много вокруг. Из стального баллона водород будет выходить таким способом очень медленно, сталь — не тонкий латекс воздушного шарика. Конечно, если помещение герметезировано, то когда-нибудь концентрация водорода дорастет до проблемной, но при естественной вентилляции такой самый легкий газ обычно успешно удаляется из помещения. Так что проблема диффузии несущественна. Другое дело, что требуется высокое давление, чтобы хранить значимое количество газа. Огнеопасность водорода преувеличена из-за первых исторических неудач, он не опаснее бытового газа (метана).
Интерес представляют способы хранения водородов в виде раствора в некоторых металлах (палладий) или в виде гидридов. Но это пока еще сложнее, чем качать в баллоны.rPman
28.03.2016 22:22Всегда интересовало, разница давления внутри и снаружи влияет на дифузию?
Привожу пример — делаем два вложенных баллона, внутренние с меньшим давлением — водород, наружний с давлением повыше, что-нибудь другое, заодно и неопасное.VerdOrr
28.03.2016 22:28https://en.wikipedia.org/wiki/Partial_pressure
В двух словах — поможет, но не сильно

ice938
28.03.2016 18:25Водородный BMW теряет до половины водорода за неделю простоя. И именно поэтому оснащается индикатором «гремучего газа» (концентрации водорода в окружающем воздухе), встроенным в наружные ручки дверей. Очень опасный газ, этот водород. Утекает отовсюду, при смешивании с воздухом легко взрывается.

Mad__Max
28.03.2016 20:47+1Это тот который с криобаками наверно? Тогда не удивительно — у него баки вообще НЕ герметичные, газ в них спокойно испаряется из жидкого состояния и улетучивается. Сдерживается этот процесс только хорошей теплоизоляцией, но как не теплоизолируй при минус 250 градусах испарение идет быстро.

ice938
29.03.2016 13:05Да, действительно, эта цифра для старой технологии хранения низкого давления (LH2), в ней клапан вентиляции открывался при 6 бар. Для новой системы хранения CcH2 (Предварительно охлажденный водород, хранимый при давлении до 350 бар) проблема потерь водорода не так ощутима, но она сохраняется. Емкость бака CcH2 BMW i8 и BMW 5 GT в среднем 235 литров водорода (8 Кг) (зависит от температуры и давления) т.е. объемная плотность водорода (System volumetric capacity (g H2/liter) ) в этой системе хранения 34 г/л Н2 (может достигать 35). Заявленная скорость утечки водорода через соединения и стенки до 7 г/час. Т.е. полный бак утечет за 47 суток. НО! Есть аварийный клапан, который стравливает водород при превышении максимально допустимого давления. Если в старых баках этот клапан открывался при поглощении 5 Ватт-дней (5 Watt-days) тепла (в среднем через 17 часов), то в баках СсН2 этот показатель увеличили до 25 Ватт-дней. Т.е. LH2 терял бак топлива, сопоставимый по объему, за 12 дней, значит CcH2 потеряет его примерно за 60 дней, это примерно 5.5 г/час. Если просуммировать с предыдущими потерями (7+5.5) получим 12.5 г/час утечки или полбака за 320 часов, что примерно равно 2 неделям. При стоимости водорода 5 USD/кг (цена США в октябре 2015, стоимости водорода в Европе не нашел) владелец будет терять примерно $1.5 за каждые сутки простоя автомобиля. Конечно, это значение варьируется в зависимости от температуры окружающего воздуха и количества водорода в баке и реальные значения потерь могут меняться как в большую, так и в меньшую сторону, но потери обязательно будут. А BMW эти цифры скрывает и описывает ситуацию примерно так- в большинстве сценариев использования автомобиля вы этого не заметите. Конечно есть еще баки CGH2 в которых газообразный водород хранится при давлении до 700 бар, но объемная плотность водорода в них меньше в два раза и при том же объеме бака мы имеем не 8 кг, а примерно 3 кг водорода, при той же скорости утечки сквозь стенки 7 г/час, полный бак утечет за 18 дней. А использование "прогрессивных" абсорбционных систем хранения пока дорого и не выгодно. Сейчас они удерживают водорода не более 20% от объема, поэтому баки получаются очень громоздкие, хоть и более безопасные.
Линки: https://e-reports-ext.llnl.gov/pdf/770282.pdf https://www1.eere.energy.gov/hydrogenandfuelcells/pdfs/compressed_hydrogen2011_7_brunner.pdf https://www.hydrogen.energy.gov/pdfs/cryocomp_report.pdf
Mad__Max
29.03.2016 14:21Да, я подобное по криобакам я уже видел. Интереснее было бы посмотреть на независимые исследования современных баков на 700 бар со сжатым водородом "комнатной" температуры.
Какие сейчас используют японские производители в своих "водородных" авто.
Да, плотность в этом случае примерно в 2 раза ниже, но т.к. это не ДВС авто (с водородом вместо бензина) они это компенсируют более чем в 2 раза более высоким КПД своей работы. В результате в габариты обычной легковушки получается упаковать объем сжатого водорода достаточный для пробега от одной заправки больше чем у самых емких электромобилей и на уровне традиционных ДВС с баками повышенного объема.
Но вот по скорости утечки водорода из таких баков никаких внушающих доверия данных пока нет. А напрямую приравнивать к криобакам (убрав скорость испарения) точно неправильно — обычные баки проще по устройству — там меньше мест для утечек, основной канал — просто диффузия через стенки. А во вторых конкретного времени / темпа утечки у них вообще нет в отличии от криогенных:
- криогенные работают при относительно постоянном давлении (пока есть жидкая фаза) и поэтому скорость утечки тоже относительно постоянна
- в обычных давление постоянно снижается по мере расходования топлива (или его утечек) и скорость утечки водорода сильно зависит от текущего % заполненности бака — максимальна сразу после заправки и постепенно снижается.

ice938
29.03.2016 17:24Да, по системам хранения сжатого водорода как-то совсем сложно найти информацию… В промышленных системах утечки составляют до 2% от объема в сутки. А по автомобильным CGH2 с давлением 700 бар я нашел только такую информацию: система безопасности разработана с учетом хранения автомобиля в стандартном гараже без принудительной вентиляции. Об этом пишут в книге Hydrogen Technology: Mobile and Portable Applications https://drive.google.com/open?id=0B5XZpXfBQ1m_VHl3UkZfYzRWdHM А в другом месте на инфографике было указано значение утечки водорода из CGH2 бака 3г/сутки, что можно считать безопасным при наличии минимальной вентиляции

Mad__Max
29.03.2016 18:56угу, такое тоже читал, но везде данные очень сильно разнятся. Где-то говорят о 2-3% утечки в сутки. Где-то что заправленный бак наполовину утекает самое быстрое несколько месяцев, ближе к полугоду.
А если по 3г/сутки взять — то при зарядке 2.5 кг на баллон (в представленных моделях их по 2 штуки обычно и 5-6 кг общий запас при полной заправке) это больше года уйдет на потерю половины объема.
В результате чему верить не ясно. Видимо отзывы от простых реальных владельцев появятся раньше, чем полноценные исследования :)
Благо продажа подобных авто уже началась, хоть и мелкими партиями, а через текущее давление можно довольно точно оценивать объем остающегося газа в баллонах и прикинуть скорость его утечки при длительной стоянке авто.

superhimik
28.03.2016 03:11Вообще-то проблема имеет решение: https://en.wikipedia.org/wiki/Hydrogen_storage

Mad__Max
28.03.2016 20:43Теоретически можно и законно по крайней мере в загородных домах, но сложно и дорого за фирменную сертифицированную компрессорную станцию(а самопал только нелегально использовать можно) и прошибание лобовой брони чиновников при согласованиях.
Но если сделать, то точно будет выгодно будет даже со счетчиками, т.к. тариф для населения в РФ на трубопроводный газ всего около 6 руб за кубометр. А 1 куб.м. метана(в природном газе почти чистый метан) по запасу энергии примерно эквивалентен литру бензина и даже больше 1 литра сжиженного (пропан-бутан) газа.
В самом электролизере ничего сложного нет. Вот пример изготовления из "подручных" материалов: https://youtu.be/cqjn3mup1So
Только нужно раздельный сбор газов делать ставя перегородки между электродами, чтобы поднимающиеся пузырьки газа не смешивались, а так ничего сложного.
А вот сжатие до высоких давлений (иначе этот крайне легкий газ неприличные объемы занимает) и его хранение — слишком сложные (и к тому же опасные) задачи для "самоделкиных".

grekmipt
28.03.2016 01:30+1Чтобы стал возможен электролиз, необходимо подать на катод и анод определённую разность потенциалов. Минимально необходимая разность потенциалов считается с помощью уравнения Нернста
На самом деле, в строгом смысле — это утверждение не верно. Хотя очень мало кто, даже из специалистов, отдает себе в этом отчет.
Строго корректно следующее утверждение: в случае если разность потенциалов ниже того что дает уравнение Нерста (ну и плюс
перенапряжение), скорость электролиза пренебрежимо мала в практическом (т.е. промышленном) смысле.
И пока меня не закидали каками, поясню свою мысль. ))
Штука в том, что дополнительный потенциал приложенный к электродам — уменьшает величину потенциального барьера, который надо преодолеть электронам металла. Т.е. по простому — уменьшает порог энергии электрона металла, при котором он успешно протуннелирует в раствор. И сия зависимость носит экспоненциальный характер. Однако, электронный газ в металле (т.е. наши электроны проводимости, малая часть которых в итоге и туннелируют в раствор) имеет распределение скоростей с весьма широкими "хвостами". Иначе говоря, в электроде есть в некотором кол-ве — дюже "быстрые" электроны. Настолько быстрые, что их собственной кинетической энергии, плюс дополнительного внешнего потенциала (который запросто может быть и меньше высчитанного по уравнению Нерста) уже хватает на то чтобы протеннулировать в раствор. Однако, поскольку зависимость туннелирования (да и доли таких быстрых электронов) экспоненциальная, то лишь очень малая часть таких "горячих" электронов может "воспользоваться" таким небольшим (меньше порогового) внешним потенциалом. В итоге, даже на напряжении скажем 0.5 вольта электролиз таки идет. Но с чрезвычайно низкой скоростью — в практическом смысле близкой к нулю. Чтобы понятны были порядки, при таком напряжении будет образовываться несколько пузырьков водорода за время порядка десятков часов-нескольких дней (в зависимости от состава раствора, его температуры, и т.п.).
А как же термодинамика? Законы термодинамики тут вполне выполняются — имеет место что-то типа теплового насоса (напомню, обычные домашние кондиционеры вполне в состоянии потратив энергию Х, вытащить в дом с улицы энергию в 3-4 раза больше). Подводим некоторую энергию извне — и при этом "изымаем" часть тепловой энергии среды.
Кроме того, разумеется, при таком типе электролиза (на вольтаже ниже порогового) происходит охлаждение воды, а с нею и электрода. А чем ниже температура электрода, тем экспоненциально меньше становится таких вот "горячих" электронов. Так что для того чтобы изолированная от внешней среды электролизная ячейка с вольтажем ниже порогового смогла перевести всю свою тепловую энергию (таким вот процессом) в продукты электролиза, потребуется бесконечное время (по мере охлаждения электролизной ячейки процесс "подпорогового" электролиза будет экспоненциально замедляться).
Так что и теоретически, и практически (читал про такие опыты, но пруфы не найду, давно было), проведение электролиза с КПД по энергии заметно выше 100% вполне возможно, хотя и в совершенно мизерных объемах. Таки да.
Интересно почему никто не пытается какими-нить хитрыми способами заюзать этакой вот "подпороговый" электролиз. Например, создать сверх-разветвленную поверхность электрода, так что даже эта мизерная скорость начала что-то значить в практическом смысле. Или банально нагреть воду с электродом при повышенном давлении (так чтобы "горячий" хвост распределения электронов стал шире). Ну и т.п. По всей видимости, сложностей на таком пути сильно больше чем потенциальный выхлоп...
superhimik
28.03.2016 03:22- Хотя очень мало кто, даже из специалистов, отдает себе в этом отчет.
Обижаете! Про плотность тока обмена все знают!

grekmipt
29.03.2016 02:45Насколько я понимаю определение тока обмена, описанное как раз не является током обмена — это именно электролиз "в одну сторону" )), но на напряжении ниже порогового (т.е. равновесия нет — когда сколько выделилось на прямой реакции столько же сожралось на обратно, а вместо этого есть постоянное выделение продуктов электролиза, хотя вольтаж ниже формального порога).

superhimik
29.03.2016 14:59Про ток обмена вы правы, это скорость при равновесной разности потенциалов. В любом случае, она тоже очень мала.
Электролиз с точки зрения термодинамики по сути не отличается от любой другой реакции с положительным изменением изобарно-изотермического потенциала. Скажем, от диссоциации воды или слабого электролита. Диссоциация воды и слабого электролита протекают при обычных условиях. Другие дело, что они достаточно быстры. Поэтому я не вижу ничего противоестественного в том, что электролиз может протекать и при меньших, чем равновесная разность потенциалов, её значениях. Вот только скорость его, увы, будет очень мала для каких-либо практических нужд.
grekmipt
02.04.2016 07:58+1Кстати, а вот Вам вопрос. Я как-то сам им задался, и сформулировал ответ, но сугубо самостоятельно — ибо ничего похожего на свой вопрос не нашел ни в одном учебнике/источнике…
С физической точки зрения, на микро-уровне (т.е. речь не про макро-статистику в виде термодинамики, а именно единичные взаимодействия), электролит имеет локально-дипольное электростатическое поле, которое взаимодействует с положительными ионами кристаллической решетки — и последние переходят в раствор, формируя тем самым двойной электрический слой. Тут всё понятно и вопросов не вызывает. Однако. Ровно эти же электростатические силы воздействуют также и на электроны проводимости (электронный газ) в поверхностном слое кристаллической решетки. Т.е. не только ионы но так же и электроны должны переходить в раствор вследствие этого — и ДЭС образовываться не будет. Вопрос. В чем ошибка (у меня есть свой, и очень простой, ответ, но интересно что скажете Вы)?
superhimik
02.04.2016 12:31Вообще-то выходят и электроны. И если их время жизни велико, как, например, у натрия в аммиаке, то их можно увидеть по появлению синего окрашивания. А если время их жизни мало, то они реагируют с растворителем, как в случае того же натрия и других щелочных металлов и воды.
Тут без термодинамики не объяснить. Надо сравнивать работу выхода электрона, энергию его сольватации, энергию кристаллической решётки металла и энергию его сольватации.
Да и ДЭС образуется совсем не всегда выходом ионов металла в приэлектродное пространство. Есть и другие механизмы — адсорбция ионов из эоектролита, например.
grekmipt
02.04.2016 19:57Ага. Спасибо за комментарий. Понятно что ДЭС не всегда формируется ионами кристаллической решетки — я просто взял конкретный случай (для четкой постановки вопроса).
На мой взгляд, есть одно объяснение совершенно не требующее макростатистик термодинамики (энергии сольватации и вот этого всего). Всё очень просто, и у Вас даже есть часть ответа в Вашем комменте ).
Ионы кристаллической решетки условно неподвижны, а подвижность ионов электролита достаточно мала. Так что время взаимодействия ионов решетки с дипольными электростатическими полями электролита оказывается достаточным для того чтобы сообщить иону энергию, необходимую для отрыва от решетки.
В случае электрона — это т.н. электронный газ, с крайне высокой средней скоростью "метания" единичного электрона по кристаллу (и достаточно редкими изменениями направлений движений). Ну, цифры легко можно оценить. И выяснится, что среднее время взаимодействия единичного электрона с конкретным дипольным комплексом электролита на очень много порядков меньше этого времени для ионов решетки. Так что за то короткое время пока электрон находится в локальной окрестности конкретного диполя электролита, энергия электрона просто не успевает измениться (даже с учетом того что электрон сильно легче). Грубо говоря, он "проскакивает" по инерции. Ибо работа это сила на перемещение, а чтобы возникло перемещение — требуется время (которого не достаточно в случае электрона).
Если мой вариант ответа верен (пока не вижу причин в этом сомневаться, ибо оценки времени взаимодействия — достаточно точные можно сделать), то это открывает довольно интересные возможности. Ибо специальными средствами (примерно понятно какими) вполне реально значительно увеличить среднее время взаимодействия электронов с дипольными полями электролита — что приведет к существенному уменьшению равновесного потенциала ДЭС (т.е. увеличению КПД электролиза)… Но это лишь общие идеи, толком этим не занимался.
- Хотя очень мало кто, даже из специалистов, отдает себе в этом отчет.


Kidar
В статьях "Импульсный электролиз..." и "Вода горит..." описывал прибор для импульсного электролиза и интересные эффекты, происходящие при этом процессе.
Получается, что при взрыве происходит взрыв гремучего газа в воде.
Как можно посчитать эффективность процесса?
По осциллограмме можно вычислить количество затраченной энергии.
Но как оценить вырабатываемую энергию — выход водорода, мощность взрыва и т. д.
Процесс практически мгновенный, скважность импульсов огромная, электрод несмотря на свой маленький диаметр визуально не изнашивается.
Вы пишете про введение катализатора. Как можно повысить эффективность при импульсном электролизе — подбором материала электрода?
superhimik
Я не умею читать электрические схемы. Поэтому не уверен в том, что то, что у вас описано — действительно импульсный электролиз, а не разложение воды, скажем, из-за её сильного нагрева.
Kidar
Интересная версия — разложение воды из-за её сильного нагрева! Записал в извилины. Погуглил, получается, что это прямой термолиз
В принципе, признаки этого имеются: кончик электрода раскаляется и еще чем выше плотность тока (читай температура и скорость нагрева), тем лучше.
Но разложение воды происходит примерно при 2 500 градусах Цельсия, а температура плавления меди 1 083 градусов и электрод визуально не изнашивается. Скорее всего, из-за короткого времени импульса он не успевает сгореть.
superhimik
Меня смущает, почему водород загорается. Сам по себе он не загорается, нужен нагрев или катализ, как я писал в посте.
У вас там полярность электродов не меняется случайно?
В принципе, горение водорода — это цепная реакция. И если на поверхности меди есть адатомы как промежуточные продукты электровосставновления воды, то они могут быть возможными первичными радикалами. Кроме того, сама медь или её оксиды могут катализировать горение.
Kidar
Полярность не меняется — на тонком электроде "минус", т.е. это катод.
Я предполагал, что в результате электролиза выделяется водород, он взаимодействует с растворенным в воде кислородом, образуется гремучая смесь и происходит взрыв.
superhimik
Он скорее не с растворённым кислородом, а с кислородом воздуха реагирует.
Kidar
Если взрыв поверхностный, то из воздуха тоже "подсасывает" кислород.
Но эффект прекрасно проявляется и под водой, когда весь электрод закрыт (изолирован), и работает только его торец.
В этом случае используется только растворенный кислород.
superhimik
Хм. Странно, что эффект наблюдается в кипячёной и дист. воде, где кислорода очень мало.
Kidar
В кипячёной и дист. воде, где кислорода очень мало… но обязательно соленой, чтобы рабочее напряжение было небольшим.
Если вода несоленая, то необходимы тысячи вольт для достижения эффекта.
По сути, мы наблюдает эффект Юткина (электрогидравлический эффект), но при небольших рабочих напряжениях.
Возможно, но тогда электрод (а это очень и очень тонкая проволочка) уменьшался бы, чего не происходит. Тут скорее всего дело в водороде.
superhimik
Вот не знаю. Дело в том, что оксид меди может потом заново восстанавливаться водородом. Если кислорода нет, откуда вспышка?
Kidar
Тут я пас… Химия для меня "серый и таинственный лес".
Я больше по электросхемкам.
superhimik
Надо больше опытов: с другим катодом, например. Кипятить до потери пульса, чтобы точно убедиться в отсутствии кислорода и снова попробовать.
Kidar
Спасибо за идеи!
Соберу установку, обязательно попробую, тем более, есть возможность достать деаэрированную воду в котельной.
superhimik
Как получится — пишите. Если в деаэрированной воде будут искры, то дело, скорее всего, не в электролизе.
VerdOrr
А кислород, выделяющийся при электролизе, у вас куда девается, извините?
Kidar
Кислород в районе анода образуется и через какое-то время после начала опыта вода конечно же насытится кислородом.
superhimik наверное имел ввиду, что если провести опыт с деаэрированной водой, то в самом его начале, когда кислорода еще нет (мало) в воде — если будут искры (вспышки), то они образуются не в результате реакции выделяющегося в районе катода водорода с отсутствующим на начальный момент растворенным кислородом, а из-за чего-то другого.
В любом случае проверю эту идею.
superhimik
Да, это я и имел в виду. Ну, можно и соляной мостик организовать, тогда точно кислород не попадёт.
superhimik
см. каменты ниже.
saege5b
а попробовать в герметичной системе снизить давление? скажем до половины атмосферного? не так уж и сложно, есть же даже ручные насосы для вакуумного хранения продуктов.
Kidar
Да, есть такой способ для избавления от газов. Можно будет попробовать.
Кстати, один парень, который провел эксперимент с созданием водородного двигателя на базе шприца, также пробовал проводить электролиз при вакууме.
superhimik
хотя если там тепло выделяется, то оно может и поджечь водород. В любом случае с расчётами вряд ли помогу — сложный процесс. В принципе, эффективность можно определить через температуру, до которой происходит нагрев системы, но это нужно в калориметре это всё проводить. Может, есть и проще способы, но они на ум не приходят.
Kidar
Да, тут большая сложность — эффект есть, а его эффективность оценить сложно.
В калориметре наверное не получится, скважность импульсов очень большая. Если только за длительный промежуток работы считать.
В этом опыте наверное самый интересный эффект не в нагреве, а в получающемся взрыве.
Считали затрачиваемую мощность по осциллограмме, по фотографии оценивали примерный размер пламени при вспышке, переводили на объем выделившегося водорода, получилась эффективность 1,05W/L, но кто ж это проверит...
superhimik
Так серию сделать, а потом поделить на число импульсов.
Kidar
Попробую, надо установку соорудить и калориметр достать.
Mad__Max
Хотел спросить откуда 2500гр, но потом понял что это первые ссылки и гугла/яндекса там везде 2500гр указано…
Странно, видимо это температура для "сферического случая" — для полного термического разложения изолированного объема воды на составляющие.
Я всегда считал что температура разложения намного ниже. По крайней мере в промышленности технологи сталкиваются с тем что в реальных условиях и в присутствии металлов (которые всегда присутствуют в реальных условиях — трубопроводы, баки, реакционные колонны и т.д. или даже корпус и стержни атомного реактора) водород в довольно больших количествах начинает образовываться из-за термического распада воды уже при 700-800 градусах. Ну и чем выше температура — тем активнее идет этот процесс.
superhimik
Надо считать. Обычно полагают, что температура разложения — это когда давление газов становится равно атмосферному давлению. Но ощутимое разложение начинается, конечно, раньше.